1. 引言
显色反应是一类将试样中被测组分转变成有色化合物的化学反应。有色化合物的浓度大小与其颜色深浅成正比,通过比较或测量有色物质溶液颜色深度来确定待测组分含量的方法,是化学中十分常用的比色法。显色反应和比色法被广泛应用于生活中各类物质的鉴别以及含量的测定。例如:利用重铬酸钾与酒精作用使溶液由橙红色变为绿色的显色反应,可以进行酒后驾车时酒精含量的测量 [1] ;空气中的甲醛被酚试剂溶液吸收,反应生成嗪,嗪在酸性溶液中被显色剂高铁离子氧化形成蓝绿色化合物,此方法可以用来检测空气中甲醛的含量 [2] ,等等。
市场上大多数饮料中都含有果糖,相比食用高葡萄糖饮料而言,在用餐时食用高果糖饮料会导致胰岛素和瘦素的水平降低,饥饿激素水平升高,同时会加大肝细胞的代谢负担,导致肥胖、非酒精性脂肪肝等一系类问题,对于果糖不耐受人群危害更大 [3] 。如图1果糖在强酸条件下脱水生成糠醛,糠醛可以与半胱氨酸盐酸盐及咔唑生成紫红色络合物,不同浓度梯度的果糖会有不同深度的颜色产生 [4] 。根据该显色反应可进行饮料中果糖含量的测量。
Figure 1. Experimental principle of fructose color reaction
图1. 果糖显色反应实验原理
目前在饮料中果糖含量测定时,主要依赖分光光度法,以吸光度为指标,通过朗伯比尔定律描述出浓度和吸光度的关系,进而根据显色反应后测得的吸光度得出果糖的浓度 [5] 。分光光度法广泛适用于食品中总糖以及多糖的测定,利用糖经水解转化后,与特定化合物反应可以生成有色物质,根据其对一定范围波长光的吸收程度与糖的浓度呈正比,外标法测得糖的含量。除此之外还有液相色谱法,离子色谱检测法等 [6] [7] [8] 。以上方法均可准确测定饮料中的果糖含量,但在实际应用过程中,这些方法均需用到大型仪器设备,不能实现对果糖的便捷检测。目前报道的果糖的快速便捷检测方法较少 [9] [10] ,随着人们对果糖含量的重视,急需一种居家就可进行便捷检测方法。
基于以上问题,我们以不同浓度果糖的标准液进行了显色实验,并且制作出标准比色卡,将发生显色反应后的待测溶液颜色与比色卡进行对比即可简便直观的确定待测溶液中果糖的大致浓度。同时我们还借助紫外可见分光光度计探索了果糖显色反应的最佳反应条件,以便于取得最佳的实验效果。
2. 实验部分
2.1. 试剂或材料
果糖、咔唑、半胱氨酸盐酸盐,以上试剂为分析纯,上海麦克林生化科技有限公司;浓硫酸(98%),天津渤海化工集团供销公司;99.5%无水乙醇,分析纯,国药集团化学试剂有限公司;市面上常见饮料。
2.2. 仪器
比色管、恒温水浴装置、量筒、烧杯、磁力搅拌器、250 mL容量瓶、移液管、洗耳球、100 mL容量瓶、紫外可见分光光度计(尤尼科UV-2100)。
2.3. 实验方法
2.3.1. 紫外可见分光光度计确定最佳显色条件
咔唑是果糖检测过程中的显色剂,其浓度会影响显色效果进而影响检测的灵敏度和准确性。同时,果糖的检测需要在一定的pH范围内进行,如果pH值过高或过低,会影响咔唑显色剂和半胱氨酸盐酸盐的还原能力,从而影响检测的准确性。为了取得更好的显色效果,采用紫外可见分光光度计对反应温度、显色时间、硫酸及显色剂用量等显色反应的影响因素进行了详细探索,确定了最佳显色条件。具体实验过程如下:
配制溶液:质量分数为1.5%的半胱氨酸盐酸盐溶液,质量分数为0.12%的咔唑酒精溶液,浓硫酸溶液(98%的浓硫酸与去离子水以2.5:1比例混合),标准果糖溶液(50 μg/mL)。
最大吸收波长的确定:取三只比色管,里面分别加入配制好的果糖标准溶液0、0.4、0.8 mL (用移液管移取),用移液管分别移取蒸馏水1、0.6、0.2 mL,依次加入到上述比色管中,每只管内加入0.2 mL半胱氨酸盐酸盐溶液,6 mL硫酸溶液,摇匀,于60℃水浴中保温10 min,取出用水冷却至室温,加入2 mL质量分数为0.12%的咔唑酒精溶液,摇匀使得其呈红紫色,分别在波长480,500,520,540,550,560,570,580 nm下测其吸光度。
最佳反应温度的确定:取一支50 mL比色管,于比色管中加入质量浓度为50 μg/mL的果糖标准溶液0.4 mL,再用移液管移取0.6 mL蒸馏水至上述比色管中,然后在管中加入0.2 mL半胱氨酸盐酸盐溶液,6 mL浓硫酸溶液,摇匀,在40℃水浴中保温10 min,取出用水冷却至室温,加入2 mL质量分数为0.12%的咔唑酒精溶液,摇匀待其反应20 min后,用10 mm光径的比色皿,在最大吸收波长下测其吸光度。重复上述步骤,分别将比色管置于50℃,60℃,70℃,80℃水浴中保温10 min,重复后续步骤,在20 min测吸光度,将五组吸光度数据进行比较。
最佳显色时间的确定:取两支50 mL比色管,分别加入果糖标准溶液0、0.4 mL,(用移液管移取),用移液管分别移取蒸馏水1、0.6 mL,依次加入到上述比色管中,每只管内加入0.2 mL半胱氨酸盐酸盐溶液,6 mL硫酸溶液,摇匀,于60℃水浴中保温10 min,取出用水冷却至室温,加入2 mL质量分数为0.12%的咔唑酒精溶液,摇匀。从加入咔唑酒精溶液开始计时,隔2 min计时一次,0.4 mL果糖溶液的最大吸光度的时间即为最佳测定时间。
硫酸用量的确定:取五支50 mL比色管,加入果糖标准溶液0.4 mL,(用移液管移取),用移液管移取蒸馏水0.6 mL,每只管内加入0.2 mL半胱氨酸盐酸盐溶液,分别加入4、5、6、7、8 mL硫酸溶液,摇匀,于60℃水浴中保温10 min,取出用水冷却至室温,分别加入2 mL质量分数为0.12%的咔唑酒精溶液,摇匀,用酒精溶液补充至相同体积,从加入咔唑酒精溶液开始计时,测定其在最佳测定时间的吸光度。
显色剂用量的确定:取五支50 mL比色管,加入果糖标准溶液0.4 mL,(用移液管移取),用移液管移取蒸馏水0.6 mL,每只管内加入0.2 mL半胱氨酸盐酸盐溶液,6 mL硫酸溶液,摇匀,于60℃水浴中保温10 min,取出用水冷却至室温,分别加入0、1、2、3、4 mL质量分数为0.12%的咔唑酒精溶液,摇匀,用酒精溶液补充至相同体积,从加入咔唑酒精溶液开始计时,测定其在最佳测定时间的吸光度。
2.3.2. 制作比色卡
取50 mL比色管,分别加质量浓度为50 μg/mL的果糖标准溶液0,0.2,0.4,0.6,0.8 mL,1 mL,再用蒸馏水分别补充至1 mL,然后每管中加入0.2 mL半胱氨酸盐酸盐溶液,6 mL浓硫酸溶液,摇匀,于60℃水浴中保温10 min,取出用水冷却至室温,加入2 mL质量分数为0.12%的咔唑酒精溶液,摇匀20 min,呈不同深浅的红紫色。根据颜色不同来制作比色卡,待测量溶液经显色后可以根据其颜色来直接得出其浓度,以100 mg∙L−1作为基准1。所得比色卡如图2所示。
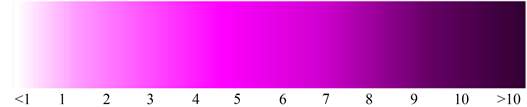
Figure 2. Standard colorimetric card of fructose content detection in beverages (100 mg∙L−1 as 1)
图2. 饮料中果糖含量检测标准比色卡(100 mg∙L−1作为基准1)
2.3.3. 市售饮料中果糖含量的便捷检测
取饮料1 mL放入烧杯中,放入水浴锅中,60℃加热3 min,赶出气泡。将烧杯从水浴锅中取出,冷却至室温。向100 mL容量瓶中加入1 mL处理好的饮料,加蒸馏水定容;取上述溶液5 mL,将其加入另一只100 mL容量瓶中,加蒸馏水定容。用移液管取1 mL稀释2000倍后的雪碧溶液,加入到装有0.2 mL半胱氨酸盐酸盐溶液,6 mL硫酸溶液的50 mL比色管内。60℃水浴中保温10 min,取出用水冷却至室温。加入2 mL质量分数为0.12%的咔唑酒精溶液,摇匀,静置10 min,将溶液的颜色与所制作的标准比色卡进行对比,即可得出溶液中果糖浓度的大致范围。
3. 结果与讨论
3.1. 最佳显色条件的确定
3.1.1. 最大吸收波长的确定
利用分光光度法对待测样品进行定量分析时,确定出最大吸收波长有助于提高测试的灵敏度,减少系统误差,提高测定结果的准确度。为了确定紫红色络合物的最大吸收波长,本实验测试了样品在480 nm~580 nm的波长范围内的吸光度。由图3可见,紫红色络合物在480 nm~580 nm波长范围内的吸光度呈现出先增加后减小的趋势,当吸收波长为560 nm,其吸光度达到最大值0.494。因此,本实验的后续测试所选择最大吸收波长560 nm下进行测试。

Figure 3. Absorbance of fructose complex at different wavelengths
图3. 果糖络合物在不同波长下的吸光度
3.1.2. 最佳反应温度的确定
为了研究反应温度对于吸光度的影响,在保证其它条件不变的前提下,改变显色反应时的环境温度,分别测试在40℃、50℃、60℃、70℃、80℃下时反应溶液的吸光度,测试结果如图4所示。由图4可见,随着反应温度的逐渐升高,吸光度也随之增大,在60℃处达到最大值0.442。当反应温度继续升高时,吸光度下降,可能是由于温度过高不利于的显色反应的完全发生,故本实验中溶液反应的最佳温度为60℃。
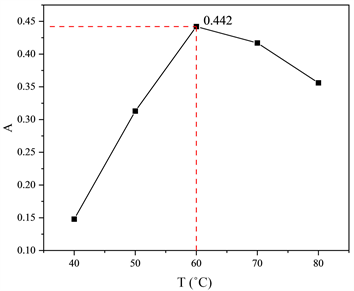
Figure 4. Absorbance with different reaction temperatures
图4. 不同反应温度对吸光度的影响
3.1.3. 络合物最佳显色反应时间的确定
适宜的显色时间是确保的显色反应完全和吸光度测试准确的基础,其值的大小必须通过实验来确定。为了研究显色时间对吸光度的影响,本实验在保证硫酸、咔唑酒精溶液的用量一定时,从加入咔唑酒精溶液开始计时,隔2 min计时一次。如图5所示,当显示时间从0分钟增加至8分钟时,吸光度急剧增加。当显色时间从8分钟继续增加至18分钟至20分钟时,曲线趋于平缓,吸光度变化较小,之后吸光度开始明显下降,推测可能是反应物发生了分解,故显色时间为18到20分钟时即可满足显色要求,为便于把控实验时间故本实验的最佳显色时间为20分钟。
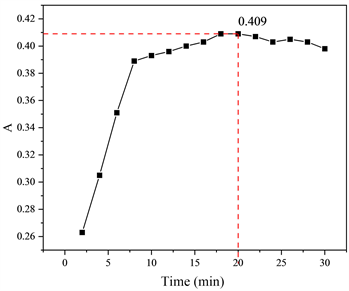
Figure 5. Absorbance with different reaction time
图5. 显色时间对吸光度的影响
3.1.4. 硫酸最佳用量的确定
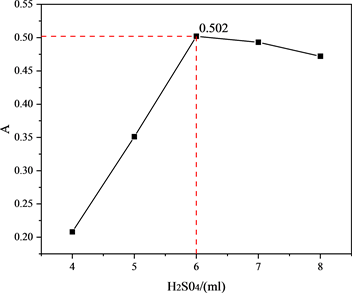
Figure 6. Absorbancewith different acid medium dosages
图6. 酸性介质用量对吸光度的影响
为了研究硫酸的用量对于吸光度的影响,在保证其它条件不变的前提下,改变混合溶液中加入的硫酸的体积,分别测试了加入4.0、5.0、6.0、7.0、8.0 mL的28%硫酸溶液时混合溶液的吸光度,测试结果如图6所示。由图6可见,随着28%硫酸溶液的体积不断增加,吸光度也随之增大,在6.0 mL处达到最大值0.502。当28%硫酸溶液的体积继续增加时,吸光度下降,可能是由于溶液体系中过多的硫酸溶液不利于的显色反应的完全发生,故本实验中28%硫酸溶液的最佳用量为6.0 mL。
3.1.5. 显色剂最佳用量的确定
为了分析半胱氨酸盐酸盐溶液的用量对吸光度的影响,在固定其它条件不变的前提下,改变混合溶液中加入的半胱氨酸盐酸盐溶液的体积,分别测试了加入0、1.0、2.0、3.0、4.0 mL的半胱氨酸盐酸盐溶液时混合溶液的吸光度。如图7所示,随着半胱氨酸盐酸盐溶液的体积不断增加,吸光度呈现先增加后减小的趋势,在2.0 mL处达到最大值0.498。当溶液体积进一步增加时,吸光度下降,可能是由于过多的半胱氨酸盐酸盐溶液易使溶液的酸度过大,整个体系过于稳定,减缓了显色反应的发生,故本实验选用2.0 mL的半胱氨酸盐酸盐溶液。

Figure 7. Absorbance with different dosages of cysteine hydrochloride solution
图7. 不同半胱氨酸盐酸盐溶液用量对吸光度的影响
由以上实验数据可以得出,最佳反应温度为60℃;显色反应的最佳时间为10 min;硫酸的最佳用量为6 mL;显色剂的最佳用量为2 mL。
3.2. 市售饮料中果糖含量的便捷检测

Figure 8. Demonstration and experiment results of fructose content in three drinks: Sprite, Christine and Pulsating
图8. 雪碧、清汀、脉动三种饮料中果糖含量测量演示实验结果
以市场上常见的饮料如雪碧、清汀、脉动等作为实验对象进行实验。如图8果糖在浓无机酸(硫酸、盐酸)作用下,脱水生成糠醛及糠醛衍生物,后者能与半胱氨酸盐酸盐及咔唑生成紫红色络合物,果糖的浓度越高,溶液颜色越深,通过与比色卡进行颜色对比,便可确定溶液中果糖的大致浓度。
在上述确定的最佳显色,从比色结果看,三种饮料中,雪碧中果糖含量最高,大概为6~7 g/100mL,脉动的果糖含量大概为3~4 g/100mL,清汀中果糖含量最低,检测结果为0。
4. 结论
(1) 将半胱氨酸–咔唑溶液与果糖溶液反应进行显色,通过分光光度法确定了最大吸收波长和最佳显色条件。结果表明,在560 nm最大吸收波长下,当显色剂和硫酸溶液的用量分别为2 mL和6 mL,显色时间为20分钟,可获得最大吸光度,取得最佳显色效果。
(2) 在上述最佳显色条件下,对不同浓度的果糖标准溶液进行显色实验,根据所得溶液颜色的深浅自制出标准比色卡。以市场上常见的三种饮料进行显色实验,并与自制标准比色卡比对,得出:雪碧中果糖含量最高,大概为6~7 g/100mL,脉动的果糖含量大概为3~4 g/100mL,清汀中果糖含量最低,检测结果为0。
(3) 本检测方法操作简单、便捷,参照论文给出的比色卡居家即可完成。
NOTES
*通讯作者。