1. 引言
支气管哮喘(Bronchial Asthma),是儿童期最常见的慢性呼吸道疾病,严重影响儿童生活质量。最近20年内我国儿童哮喘患病率以每10年增加50%以上的幅度增长,上海地区的患病率最高7.57%,已接近发达国家水平 [1] 。目前哮喘的发病机制仍不十分清楚,与免疫因素、神经、精神和内分泌因素、遗传学背景和神经信号通路异常密切相关 [2] 。其中T细胞的免疫失衡在哮喘发病过程中的作用成为国内外学者研究的热点 [3] 。Th1/Th2细胞的免疫失衡参与了哮喘的发病 [4] ,儿童哮喘多表现为反复发作的咳嗽、喘息、胸闷、气短等,部分引起呼吸困难、呼吸衰竭等,甚至危及生命 [5] ,据统计,2015~2019儿童哮喘死亡率为0.02~0.03/10万 [6] 。在儿童支气管哮喘的管理中,迫切需要寻找新的生物学标志物,来评估哮喘儿童的急性发作以及对药物治疗的反应 [7] 。
双特异性磷酸酶1 (Dual-specific Phosphatase 1, DUSP1)也被称为丝裂原活化蛋白激酶(Mitogen-activated Protein Kinase, MAPK)磷酸酶1 (Mitogen-activated Protein Kinase, MKP-1),最初被证实是细胞外信号调节激酶(Extracellular Signal-regulated Kinase, ERK)的特异性磷酸酶 [8] 。国外学者报道,DUSP1是辅助性T细胞Th1分化所必需的 [9] ,且Th1/Th2细胞免疫失衡参与儿童支气管哮喘发病机制的研究在国内外大量的文献中得以证实 [10] 。DUSP1是气道上皮细胞中促进过敏反应的负性调节因子,在支气管哮喘的进展中起着至关重要的作用 [11] [12] 。此外,DUSP1通过抑制MAPK活化,并通过p38和ERK1/2信号通路参与哮喘的发病 [9] 。国外学者研究发现,DUSP1还通过抑制M1型巨噬细胞活化,促进M2型巨噬细胞活化,增强糖皮质激素在哮喘中的抗炎作用 [13] 。
本研究旨在探讨血清DUSP1在哮喘患儿中的表达及其与哮喘发作风险、严重程度以及与炎症细胞因子的关系。
2. 方法
2.1. 研究对象
在2020年1月至2021年2月期间,在青岛大学附属医院儿童呼吸科,共选择了52名哮喘急性发作期儿童和50名哮喘慢性持续期作为实验组,并选取了50名健康儿童,作为健康对照组。所有儿童的年龄都在1至14岁之间,各组间在年龄、性别、身高、体重、哮喘家族史等临床特征上无显著性差异。
2.1.1. 纳入标准
1) 符合《儿童支气管哮喘诊断与防治指南(2016年版)》中的诊断标准 [14] ;
2) 家长对研究内容知情,并签署知情同意书;
3) 自愿参与;
4) 经伦理委员会审批通过。
2016版指南推荐的哮喘诊断标准:
1) 反复发作喘息、咳嗽、气促、胸闷,多与接触变应原、冷空气、物理或化学性刺激、呼吸道感染、运动以及过度通气(如大笑和哭闹)等有关,常在夜间和(或)清晨发作或加剧。
2) 发作时在双肺可闻及散在或弥漫性,以呼气相为主的哮鸣音,呼气相延长。
3) 上述症状和体征经抗哮喘治疗有效或自行缓解。
4) 除外其他疾病所引起的喘息、咳嗽、气促和胸闷。
5) 临床表现不典型者(如无明显喘息或哮鸣音),应至少具备以下1项:① 证实存在可逆性气流受限:a) 支气管舒张试验阳性:吸入速效β2受体激动剂(如沙丁胺醇压力定量气雾剂200~400 µg)后15分钟第一秒用力呼气量(FEV1)增加 ≥ 12%;b) 抗炎治疗后肺通气功能改善:给予吸入糖皮质激素和(或)抗白三烯治疗4周,FEV1增加 ≥ 12%;② 支气管激发试验阳性;③ 最大呼气峰流量(PEF)日间变异率(连续监测2周)均值 ≥ 13%。
符合1~4条或4、5条者,可以诊断为哮喘。
2.1.2. 排除标准
1) 合并基础疾病、重要脏器功能障碍;
2) 合并有过敏性疾病或其他呼吸道疾病;
3) 失访患儿;
4) 近四周内全身使用过糖皮质激素及其他免疫抑制剂或免疫增强剂者。
研究方案已获青岛大学附属医院机构审查委员会批准。所有参与者的法定监护人都签署了书面知情同意书。
2.2. 实验方法 采用ELISA法检测所有研究对象IL-1β、IL-6、IL-17、人TNF-α检测的水平
① IL-1β、IL-6、IL-17、人TNF-α检测:青岛大学附属医院检验科。具体步骤如下:
标本采集:血清或血浆(溶血、脂血、黄疸血样标本不用),取血量2 mL,血浆:(EDTA抗凝,紫色采血管)首要推荐。离心条件:取血4小时内,至少1000 g离心10分钟,取分离出的血浆送检。
② 血清DUSP1检测:采用人双特异性蛋白磷酸酶1试剂盒(中国武汉伊艾博公司),采用ELISA法检测血清中DUSP1水平。
2.3. 统计数据
本实验数据采用SPSS 17.0软件进行统计学处理,计数资料采用例数或百分数(%),计量资料以均数 ± 标准差(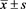 )表示。计量资料的两组数比较釆用χ2检验。相关性检验釆用Pearson相关分析,均以P < 0.05为差异有统计学意义。
)表示。计量资料的两组数比较釆用χ2检验。相关性检验釆用Pearson相关分析,均以P < 0.05为差异有统计学意义。
3. 结果
3.1. 哮喘患儿的临床特点及健康对照
52例哮喘急性发作期儿童、50例慢性持续期儿童和50例健康对照儿童基本情况及检查结果如表1~表3所示,平均年龄分别为6.1 ± 2.8岁、6.1 ± 2.5岁和6.4 ± 2.8岁。嗜酸粒细胞计数、IgE、TNF-α、IL-1β、IL-6、IL-17的中位数及FEV1/FVC和FEV1 (%预测值)的平均数有差异(均P < 0.001)。

Table 1. Basic situation among groups
表1. 各组间基本情况
缩写:SD,标准差。

Table 2. Severity of subjects during acute attack
表2. 受试者急性发作期严重程度

Table 3. Examination results between groups
表3. 各组间检查结果
IgE,免疫球蛋白E;FEV1,用力呼气量在1秒内;FVC;TNF-α,肿瘤坏死因子-α;IL-1β,白细胞介素-1β;IL-6,白细胞介素-6;IL-17,白细胞介素-17。
3.2. 血清DUSP1水平在哮喘患儿中的表达
血清DUSP1水平在健康对照组中最高,在哮喘慢性持续期儿童中次之,在哮喘急性发作期儿童中最低(P < 0.001)。结果显示,哮喘急性发作期和慢性持续期患儿的血清DUSP1水平均低于健康对照组(均P < 0.001)。由ROC曲线可以看出,DUSP1在鉴别哮喘儿童和健康儿童方面有显著差异,AUC为0.847,95%置信区间(CI)为0.780~0.914 (图1);同时,血清DUSP1水平具有一定的鉴别哮喘急性发作期和慢性持续期的能力,AUC (95%CI)为0.755 (0.661~0.849) (图2)。
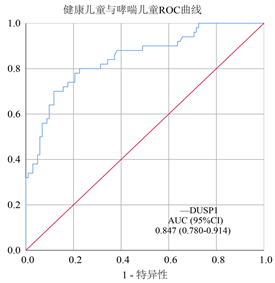
Figure 1. Serum DUSP1 level ROC in healthy children and asthmatic children
图1. 健康儿童与哮喘儿童血清DUSP1水平ROC
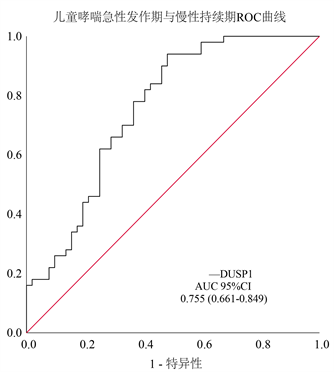
Figure 2. Serum DUSP1 level ROC in acute attack and chronic duration of asthma
图2. 哮喘急性发作期与慢性持续期血清DUSP1水平ROC
3.3. 血清DUSP1水平与哮喘儿童病情严重程度及炎症因子的结果
血清DUSP1水平与哮喘急性发作期儿童的发作严重程度呈负相关(rs = −0.338, P = 0.014)。
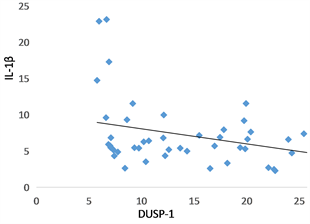
哮喘急性发作期血清DUSP1水平与TNF-α (rs = −0.423, P = 0.002)、IL-1β (rs = −0.389, P = 0.004)、IL17 (rs = −0.293, P = 0.035)呈负相关(图3(a)~(c)),未现血清DUSP1水平与血清IL-6有相关性(rs = −0.241, P = 0.085) (图3(d))。
哮喘慢性持续DUSP1水平TNF−α (rs = −0.300, P = 0.034)、IL-1β (rs = −0.309, P = 0.029)呈负相关。在哮喘慢性持续期儿童及健康对照中,未发现血清DUSP1水平与血清IL-6或IL-17相关(均P > 0.05)。
 (a)
(a)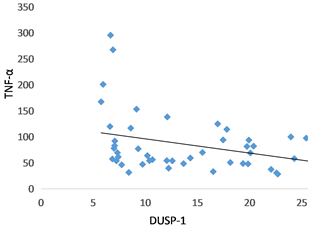 (b)
(b) (c)
(c)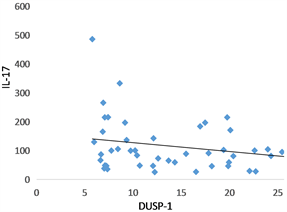 (d)
(d)
Figure 3. (a)~(d) The linear relationship between serum DUSP-1 level and TNF-α, IL-1β, IL-17 and IL-6, respectively
图3. (a)~(d) 血清DUSP-1水平分别与TNF-α、IL-1β、IL-17、IL-6的线性关系
3.4. 血清DUSP1水平与支气管哮喘儿童其他疾病特征的关系
哮喘急性发作期儿童组,血清DUSP1水平与IgE呈负相关(rs = −0.277, P = 0.047),与嗜酸性粒细胞计数、FEV1/FVC或FEV1 (%预测值)无明显相关性(均P > 0.05)。在哮喘慢性持续期及健康对照组儿童中,血清DUSP1水平与嗜酸性粒细胞计数、IgE、FEV1/FVC以及FEV1 (%预测值)没有明显相关性(所有P > 0.05)。
4. 讨论
既往文献表明DUSP1在自身免疫性疾病(如银屑病) [15] 、缺氧性疾病(如高原病) [16] 、炎症性疾病(如骨关节炎) [17] 、心血管系统 [18] 、癌症 [19] 等疾病中发挥着重要作用。与儿童支气管哮喘的关系国内外鲜有报道,我们的研究旨在研究二者的相关性。
4.1. DUSP1与哮喘发作
研究发现血清DUSP1水平在健康对照中最高,其次是支气管哮喘慢性持续期的儿童,在急性发作期儿童中最低。考虑其原因如下:1) DUSP1通过靶向MAPK信号通路参与支气管哮喘的发病机制 [20] [21] ,影响支气管哮喘的发生发展;因此,支气管哮喘儿童的血清DUSP1水平低于健康对照;2) 血清DUSP1是一种具有抗炎特性的蛋白质,较高的炎症水平能提高疾病活动性,因此,支气管哮喘急性发作期儿童的血清DUSP1水平低于慢性持续期儿童。监测血清DUSP1水平可以鉴别哮喘儿童和健康儿童、哮喘急性发作期和慢性持续期,提示血清DUSP1水平可能作为哮喘和哮喘发作风险的生物标志物。
4.2. DUSP1与炎症因子
既往研究表明,DUSP1通过MAPK通路调节炎症因子水平 [22] 。在我们的研究中,血清DUSP1水平与TNF-α、IL-1β、IL-17等炎症细胞因子在哮喘急性发作期儿童中呈负相关,血清DUSP1水平与血清TNF-α、IL-1β水平在慢性持续期儿童中轻度相关。其可能的原因是:1) DUSP1可能通过抑制p38/MAPK和JNK/MAPK信号通路抑制哮喘炎症和分解代谢介质 [23] ,从而减轻炎症反应;2) 支气管哮喘急性发作期儿童组炎症反应较慢性持续期儿童组更明显,支气管哮喘急性发作期儿童组血清DUSP1水平与炎症细胞因子的相关性较慢性持续期儿童组更明显。
4.3. DUSP1与哮喘急性发作期严重程度
急性发作期的严重程度反映支气管哮喘严重程度和炎症程度,早期识别支气管哮喘急性发作期的严重程度,对于指导支气管哮喘患者的治疗具有重要意义。本研究发现血清DUSP1水平与支气管哮喘发作的严重程度有关,其原理可能是DUSP1降低了哮喘免疫细胞的免疫反应,进而抑制了气道慢性炎症,进一步降低了哮喘发作的严重程度。因此,血清DUSP1水平与哮喘急性发作期儿童的发作严重程度呈负相关。此外,在支气管哮喘急性发作期儿童中,血清DUSP1水平与血清IgE水平呈负相关,反映DUSP1可能降低过敏的免疫应答。
5. 结论
综上所述,血清DUSP1水平与儿童支气管哮喘关系密切,在儿童支气管哮喘发作中起到正面作用,其与哮喘急性发作风险呈负相关,即DUSP1越高,哮喘发作风险越低;其与哮喘急性发作程度和炎性细胞因子水平呈负相关,即DUSP1越高,哮喘急性发作严重程度越低,炎性细胞因子水平越低,反之亦然。这些发现提示:第一,血清DUSP1水平可以作为潜在的支气管哮喘发作的生物标志物,预测儿童支气管哮喘的发作,以便临床及时治疗。第二,监测血清DUSP1水平,监测支气管哮喘儿童发病过程,区分急性发作期及慢性持续期,并评估治疗效果。第三,为发现新的支气管哮喘治疗药物提供思路,如炎性细胞因子靶向药物、酶激动剂等。