1. 引言
半导体在我们的日常生活中是必不可少的,半导体在生产过程中,研磨、清洗等工序会产生重金属废水。电子工业为人类带来方便的同时,也造成了一系列的环境污染问题。半导体的生产过程中使用了许多化学物质,正因为如此,电子工业生产的废水中含有一系列有害污染物,例如砷离子。作为重要的半导体材料,砷化镓属于III~V族化合物半导体,由其制成的半绝缘高阻材料的电阻率比硅、锗高3个数量级以上,可用来制作集成电路衬底。在砷化镓晶片生产过程中,晶片表面清洗、湿法刻蚀、减薄及划片等环节会产生含砷废水,废水中主要污染物为酸碱和总砷 [1] 。砷是一种具有强毒害性的非金属元素,广泛存在于有色冶金、钢铁、化肥、硫酸等工业废水中,并被确认为一类致癌物 [2] [3] [4] [5] 。目前,从含砷废水中去除砷的方法主要有化学沉淀(中和、硫化)法及吸附法 [6] [7] [8] [9] 。
硫化物沉淀法是通过投加硫化钠(Na2S),硫离子与废水中的亚砷酸根(
)和砷酸根(
)反应,形成硫化砷(As2S5)和硫化亚砷(As2S3)沉淀,达到除砷的目的。但是在酸性含砷废水中使用硫化钠作为硫化剂,硫化反应相对剧烈,反应过程难以控制,加入的硫化钠会迅速与废水中的酸反应,生成部分硫化氢来不及与溶液中的砷反应,就直接从溶液中溢出进入尾气吸收系统中,另外硫化砷渣化学稳定性低,无害化委托处置成本高。
中和沉淀法主要是通过投加石灰中和水中的酸提升废水pH值,并使废水中
和
与钙盐形成难溶于水的亚砷酸钙
和砷酸钙
沉淀。铁盐沉淀法主要是通过投加铁盐,形成不溶性的亚砷酸铁(FeAsO3)和砷酸铁(FeAsO4)化合物,同时利用投加铁盐后产生的水合铁氧化物的絮凝性能,进一步吸附游离的砷化物,形成共沉淀。铁离子对砷有较强的亲和力,具有较高的除砷潜力 [10] [11] [12] [13] 。因此,与硫化物沉淀法和中和沉淀法相比,铁盐沉淀法的除砷效率较高。由于
离子表面所带的负电荷较
少,因此
较
更难于被水合铁氧化物吸附 [14] 。此外,由于As(III)的毒性远高于As(V),因此在采用沉淀法时宜先将废水中的As(III)氧化为As(V),然后再加入钙盐、铁盐沉淀砷元素。
目前,将三价的砷氧化为As(V)所用到的氧化方法主要有空气氧化法和药剂氧化法。空气氧化法是将空气通入溶液中利用空气中的氧气氧化As(III)。由于空气和氧气的氧化速率比较低,其在As(III)的氧化过程中受到限制 [14] ,在没有催化剂辅助的条件下使用空气氧化As(III)并不可取。药剂氧化法使用的氧化剂分别是次氯酸钠、双氧水、高锰酸盐以及臭氧等。高锰酸盐也已被用于氧化除砷的工业应用中,Li等 [15] 提出一种钢渣–高锰酸钾协同除砷的方法,使污水中的砷被氧化为As(V),再与三价铁形成絮状共同沉淀,以达到净化污水的作用,在3 h反应时间、高锰酸盐用量为2 mmol/L时,砷的去除率高达91.37%。赖兰萍等 [16] 分别采用NaClO、H2O2和空气来氧化处理钨冶炼含砷废水,比较了氧化剂用量、反应时间以及达到同样去除效率时氧化剂的费用,结果显示,H2O2要明显优于NaClO和空气。因此,本文采用H2O2预处理氧化含砷废水,后经钙盐、铁盐沉淀除砷,并探究了双氧水用量、铁盐用量、反应时间、反应温度等对砷去除效率的影响。
2. 材料与方法
2.1. 含砷废水水质指标
某企业产生的含砷废水水质指标如下表1所示。

Table 1. Water quality indexes of arsenic-containing wastewater
表1. 含砷废水水质指标
2.2. 实验原理
主要工艺原理如下:
(1)
(2)
(3)
(4)
由于As(V)的盐类的溶解度相对于As(III)的盐类来说其溶解度更小,所以在进行含砷废水的处理时,需要对于含砷废水加入一定的氧化剂进行氧化预处理。此次实验通过加入H2O2进行预氧化,然后利用钙盐和铁盐作为沉淀剂,经固液分离后,从而达到安全处理含砷废水的目的。
2.3. 工艺流程
取一定量的含砷废水,向其加入适量的H2O2,将废水中的As(III)氧化为As(V)。然后向废水中加入适量氢氧化钙调节其pH值至碱性,同时形成砷酸钙沉淀,去除废水中部分的砷。最后向反应废水中加入适量的硫酸铁进一步去除其中的砷,经混凝沉淀工艺处理后,分析滤液中砷质量浓度,计算砷去除率。当处置后出水砷含量小于0.5 mg/L时,再经过废水蒸发脱盐后经生化处理后达标排放。具体工艺流程见图1。
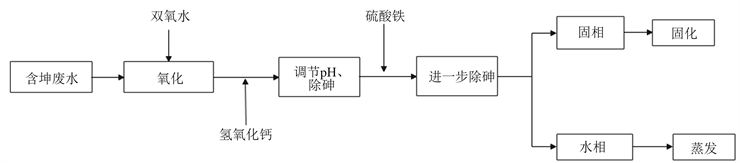
Figure 1. Flowchart of treatment process of arsenic-containing wastewater
图1. 含砷废水处理工艺流程图
3. 实验部分
3.1. 主要实验仪器
实验过程中用到的主要设备和仪器如下表2所示。

Table 2. Main equipments and instruments of the experiment
表2. 实验的主要设备和仪器
3.2. 主要实验试剂
实验过程中用到的主要实验试剂如下表3所示。

Table 3. Main experimental reagents of the experiment
表3. 实验的主要实验试剂
3.3. 实验步骤
取200 mL含砷废水置于500 mL的烧杯中,打开磁力恒温搅拌器,边搅拌边缓慢加入一定量的30% H2O2,反应2 h后,向反应溶液中加入一定氢氧化钙调节其pH至碱性,搅拌反应,加入一定量的硫酸铁反应,静置后过滤,滤液检测砷含量。
4. 结果与讨论
4.1. 双氧水用量对砷去除效率的影响
取含砷废水200 mL置于反应容器中,在磁力搅拌下向其缓慢加入不同体积的H2O2,使得溶液中H2O2和As的物质的量之比分别为0.5、0.8、1.0、1.2和1.4。反应2 h后加入氢氧化钙调节pH值至9.0,然后向溶液中加入一定量的硫酸铁,控制n(Fe)/n(As) = 1.3/1,搅拌速度100 r/min,60℃下反应2 h,探究H2O2用量对除砷的影响,实验结果如图2所示。
从反应结果可以看出(图2),反应溶液中随着H2O2用量的增加,砷含量明显降低,当n(H2O2)/n(As)比为1.2/1.0时,溶液中砷含量降至0.1 mg/L。当H2O2用量较低时,亚砷酸根未被完全氧化为砷酸根,有部分生成亚砷酸盐沉淀,亚砷酸盐溶解度较高且化学性质不稳定,所以溶液中砷含量较高。随着双氧水用量的增加,亚砷酸根被完全氧化为砷酸根,砷酸根进一步生成溶解度更低、化学性质更稳定的砷酸盐沉淀物,使废水中砷质量浓度降低。随着H2O2用量继续增加,溶液中砷含量基本不变,所以当n(H2O2)/n(As)比为1.2/1.0时,溶液中的As(III)已经被氧化为As(V)。考虑经济性,选择n(H2O2)/n(As)比为1.2/1.0时作为最适条件。

Figure 2. Effect of different dosages of hydrogen peroxide on removal efficiency of arsenic
图2. 不同双氧水用量对砷去除效率的影响
4.2. pH值对砷去除效果的影响
H3AsO4在溶液中存在三级电离,当溶液pH值发生变化时,溶液中各物质的电离平衡会受到影响。
由此可见,溶液pH值对砷的去除率有较大的影响。在探究pH值对砷去除的影响实验中,取7份含砷废水每份体积200 mL分别置于烧杯中,加入适量的H2O2,控制n(H2O2)/n(As)比为1.2/1.0。反应2 h后,分别加入氢氧化钙调节pH值分别为6.0、7.0、8.0、9.0、10.0、11.0、12.0,然后向反应溶液中加入适量的硫酸铁,控制n(Fe)/n(As) = 1.3/1,搅拌速度100 r/min,60℃下反应2 h。实验结果如图3所示。

Figure 3. Effect of different pH on removal efficiency of arsenic
图3. 不同pH对砷去除效率的影响
由上述反应结果可知(图3所示),当溶液的pH值从6.0提升到8.0时,反应后滤液中的砷含量从4.2 mg/L快速降低至0.1 mg/L。当溶液pH从9.0提升到10.0时,反应后滤液中砷含量几乎无变化。但是,当溶液pH值从10.0进一步提升到12.0时,反应后滤液中总砷浓度从0.14 mg/L又快速回升至4.5 mg/L。实验结果表明,弱碱性条件有利于铁盐共沉淀除砷。强碱性条件下,铁离子主要以铁的羟基配合物形式存在,从而导致反应产生的FeAsO4沉淀物出现反溶现象,进而导致反应后滤液中砷含量升高。实验结果表明,当反应溶液的pH值为9.0时,反应后的滤液中砷含量降低至0.1 mg/L,满足项目环评要求的0.2 mg/L的排放限值,且相对于pH值为10.0时,所需碱的用量更少,更为经济。因此,反应溶液的最适pH值确定为9.0。
4.3. 硫酸铁用量对除砷的影响
取5份含砷废水每份体积200 mL分别置于不同的烧杯中,加入适量的双氧水,控制反应溶液中n(H2O2)/n(As)比为1.2/1.0,反应2 h后,向反应溶液中加入适量的氢氧化钙调节溶液pH值至9.0。在搅拌速度为100 r/min,60℃下反应2 h,然后加入硫酸铁,探究不同硫酸铁用量对溶液除砷的影响,实验结果如图4所示。
从实验结果可知(图4),随着n(Fe)/n(As)增大,废水中砷含量不断降低;当n(Fe)/n(As) = 1.3/1时,废水中砷质量浓度降至0.1 mg/L。硫酸铁用量较低时,反应产物砷酸铁和氢氧化铁的量较少,砷去除率较低。随硫酸铁用量增加,砷酸铁和氢氧化铁产生量增大,铁盐的吸附、包裹、闭合等作用,达到深度除砷的目的。综合考虑,确定n(Fe)/n(As) = 1.3/1时为最佳处置条件。

Figure 4. Effect of different dosages of ferric sulfate on removal efficiency of arsenic
图4. 不同硫酸铁用量对砷去除效率的影响
4.4. 搅拌速度对除砷的影响
取5份含砷废水每份体积200 mL分别置于不同的烧杯中,控制n(H2O2)/n(As)比为1.2/1.0,反应2 h后,加入氢氧化钙调节溶液pH值至9.0,然后加入适量的硫酸铁,控制n(Fe)/n(As) = 1.3/1,60℃下反应2 h,探究搅拌速度对除砷的影响,实验结果如图5所示。

Figure 5. Effect of different stirring speeds on removal efficiency of arsenic
图5. 不同搅拌速度对砷去除效率的影响
从上述实验结果可知(图5),随搅拌速度增大,反应后溶液中砷质量浓度越低;搅拌速度为100 r/min时,反应后溶液中砷含量降至0.1 mg/L。当搅拌速度为60 r/min时,搅拌速度较低,硫酸铁的扩散速度较慢,与砷酸根之间接触概率低,生成砷酸铁的反应不充分,同时硫酸铁水解生成的氢氧化铁胶体的量也较少,对砷的吸附量也较少,砷脱除效果相对较差,反应后砷含量大于1.0 mg/L。随搅拌速度增大,硫酸铁与砷酸根之间得到更充分的接触,反应速度加快,生成的砷酸铁及氢氧化铁胶体更多,更有利于脱砷。综合考虑,确定搅拌速度为100 r/min时最佳。
4.5. 反应时间对砷去除效率的影响
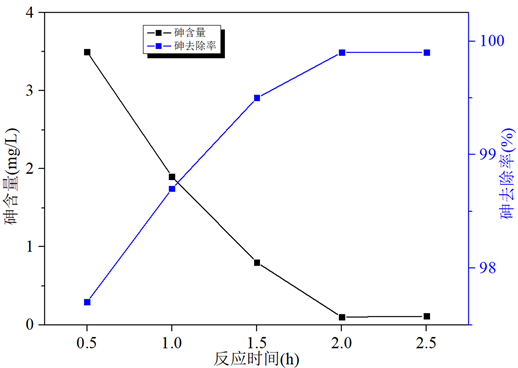
Figure 6. Effect of different reaction time on removal efficiency of arsenic
图6. 不同反应时间对砷去除效率的影响
取5份含砷废水每份体积200 mL分别置于不同的烧杯中,加入适量H2O2,控制n(H2O2)/n(As)比为1.2/1.0。反应2 h后,加入氢氧化钙调节pH值9.0,然后加入硫酸铁,控制n(Fe)/n(As) = 1.3/1,搅拌速度100 r/min,60℃下进行反应,控制反应时间为0.5 h、1 h、1.5 h、2 h、2.5 h,探究反应时间对除砷的影响。实验结果如图6所示。
由图6可以看出,随反应时间延长,反应后废水中砷质量浓度逐渐降低;当反应时间达到2 h时,反应后废水中砷质量浓度降至0.1 mg/L。进一步,随着反应时间的继续增加,As质量浓度无明显变化,可知随反应时间继续延长,反应基本完成。为了使砷酸铁沉淀反应更完全,更有利于除砷并考虑到能耗和时间的影响,确定反应时间以2 h最佳。
4.6. 反应温度对砷去除效率的影响
取5份含砷废水每份体积200 mL分别置于不同的烧杯中,加入适量的H2O2,控制n(H2O2)/n(As)比为1.2/1.0。反应2 h后,加入氢氧化钙调节废水pH值至9.0,然后加入硫酸铁,控制n(Fe)/n(As) = 1.3/1,搅拌速度100 r/min,反应时间为2 h,控制反应温度为20℃、40℃、60℃、80℃、100℃,探究反应温度对除砷的影响。实验结果如图7所示。

Figure 7. Effect of different reaction temperatures on removal efficiency of arsenic
图7. 不同反应温度对砷去除效率的影响
从上述实验结果可知(图7),随反应温度升高,废水中砷含量快速降低;温度升至60℃时,反应后溶液中砷质量浓度降至为0.1mg/L。温度较低时,硫酸铁与
、硫酸铁水解反应均较慢,反应不充分。随温度升高,反应速度加快,有利于反应正向进行;但温度高于60℃时,砷酸铁稳定性受到影响,使得砷去除效果也略受影响。综合考虑,确定温度以60℃为最佳。
4.7. 重复性实验验证
根据最佳反应条件,控制n(H2O2)/n(As)比为1.2/1.0。反应2 h后,加入氢氧化钙调节pH值9.0,然后加入硫酸铁,控制n(Fe)/n(As) = 1.3/1,搅拌速度100 r/min,反应时间为2 h,60℃下进行反应,扩大反应量为2 L,进行重复性实验,验证结果,实验结果如下表4所示。

Table 4. Repeatability test results
表4. 重复性实验结果
由表4看出:5次扩大试验后,废水中砷质量浓度均在0.2 mg/L以下,除砷效果较好;说明此法较为稳定,除砷后的废水可达标排放。
5. 结论
采用预氧化–铁盐沉淀法对高浓度含砷废水进行处理,研究确定了氧化剂H2O2的用量,考察了n(Fe)/n(As)、pH值和反应时间等试验条件对砷去除效果的影响。得出如下结论:
1) 通过将高浓度含砷废水氧化后,再进行沉淀反应,有助于提高废水的除砷效果和沉淀的稳定性,亚砷酸盐溶解度较高且化学性质不稳定,亚砷酸根氧化为砷酸根,砷酸根进一步生成溶解度更低、化学性质更稳定的砷酸盐沉淀物,从而提高含砷的去除率。当n(H2O2)/n(As)比为1.2/1.0时,预氧化处置后,废水砷含量降为0.1 mg/L。
2) 通过实验研究,pH值对硫酸铁除砷影响较大,砷酸钙盐化合物的稳定性相对较差,长期暴露于空气中,会与空气中的二氧化碳反应分解成碳酸钙和砷酸。在酸性条件下生成的部分砷酸钙会和酸反应,导致少量的砷重新进入到溶液中。弱碱性环境有利于铁盐共沉淀除砷。强碱性环境下,铁离子主要以铁的羟基配合物形式存在,从而导致反应产生的FeAsO4沉淀物出现反溶现象,处置后砷含量会增加。
3) 向高浓度含砷废水中投加铁离子,有助于提高废水的除砷率和沉淀的稳定性,除砷效果明显。因为铁盐水解生成氢氧化铁,与亚砷酸根或砷酸根作用,生成难溶的亚砷酸铁或砷酸铁沉淀。另外,通过铁盐的吸附、包裹、闭合等作用,达到深度除砷的目的。
4) As(V)-Fe(III)溶液在升温过程中就会生成无定形砷酸铁,温度超过60℃时,砷酸铁稳定性受到影响,因为温度是影响砷酸铁溶解度的重要因素之一。随着温度升高,砷酸铁在水中的溶解度也会增加,使得废水中砷去除效果也略受影响。实验结果表明,最适的实验温度为60℃。
5) 通过使用预氧化–铁盐法处理含砷废水,出水总砷浓度为0.1 mg/L,达到了GB 8978-1996《污水综合排放标准》(≤0.5 mg/L)中的一级指标。
综上所述,当n(H2O2)/n(As)比为1.2/1.0、反应溶液pH为9.0、n(Fe)/n(As)比为1.3/1.0、反应温度为60℃、反应时间为2 h时,处置后的废水砷含量为0.1 mg/L,砷的去除率在99.9%以上。处置后的废水满足《污水综合排放标准》GB 8978-1996中排放指标的要求。