摘要: 目的:建立愈创甘油醚片的溶出度测定方法,用于后期评价其内在质量差异。方法:采用桨法,溶出介质为水900 ml,转速为每分钟50转,取样时间为45分钟,采用紫外–可见分光光度法,在274 nm波长下处测定溶出量。结果:在测定波长274 nm处,空白辅料对愈创甘油醚检测无干扰;精密度的RSD为0.29%,线性范围为0.0135~0.081 mg/mL (r = 0.9999),回收率为94.97%~97.27% (RSD = 0.78%, n = 9),在室温条件下5小时内溶出溶液保持稳定。3批愈创甘油醚片的溶出度分别为95.2%、95.1%、95.2%,大于限度要求的85%。结论:该方法简单可靠,重复性好,灵敏度高,可用于测定愈创甘油醚片的溶出度。
Abstract:
Objective: To explore a method for determination of dissolution of guaifenesin tablets, for later evaluation of their intrinsic quality differences. Methods: Using paddle method, the dissolution medium was 900 ml water, the rotation speed was 50 r∙min−1, the sampling time was 45 min, and the dissolution was determined by UV spectrophotometry at 274 nm wavelength. Results: At the wave-length of 274 nm, the blank excipients did not interfere with the detection of guaifenesin. The RSD of precision was 0.29%, the linear range was 0.0135~0.081 mg/mL (r = 0.9999), the recoveries were 94.97%~97.27% (RSD = 0.78%, n = 9), and the solution remained stable within 5 hours at room temperature. The dissolution rates of the three batches of guaifenesin tablets were 95.2%, 95.1% and 95.2%, respectively, which were higher than the limit requirement of 85%. Conclusion: The method is simple, reliable, repeatable and sensitive, and can be used to determine the dissolution of guaifenesin tablets.
1. 引言
愈创甘油醚片为祛痰镇咳药 [1] ,本品为《国家药品标准·化学药品地方标准上升国家标准》(第七册)收载的品种,标准号WS-10001-(HD-0678-2002) [2] 。标准中未收载溶出度控制项,且目前国内尚未见收载该品种溶出度测定方法的报道,为了更好地控制该制剂的内在质量,完善药品质量标准,参考《美国药典》中愈创甘油醚片的质量标准 [3] 及《中国药典》2020年版四部“0931溶出度与释放度测定法”中相关要求 [4] ,建立愈创甘油醚片的溶出度测定方法。
2. 仪器与试药
安捷伦Aglient708-DS溶出度分析仪;HITACHI (日立) U-3900紫外–可见分光光度计;MS105DU电子天平。
愈创甘油醚片(批号:141101、141102、141103,来自广东众生药业股份有限公司);愈创甘油醚对照品(批号:100528-201303,来自中国食品药品检定研究院)。
3. 方法与结果
3.1. 测定方法
取本品,照《中国药典》2020年版四部通则“0931溶出度与释放度测定法”第二法,以水900 ml为溶出介质,温度37.0℃ ± 0.5℃,转速为每分钟50转,依法操作,经45分钟时,取溶液10 ml,滤过,精密量取续滤液5 ml,置25 ml量瓶中,用水稀释至刻度,摇匀,作为供试品溶液,照《中国药典》2020年版四部通则“0401紫外–可见分光光度法”,在274 nm的波长处测定吸光度;另取愈创甘油醚对照品,精密称定,加水溶解并定量稀释制成每1 ml中含40 μg的溶液,作为对照品溶液,同法测定吸光度,计算每片的溶出量。
3.2. 方法学试验
3.2.1. 专属性试验
空白辅料溶液:取空白辅料(按处方比例配制)适量,置50 ml量瓶中,加水适量,振摇混匀,加水稀释至刻度,摇匀,滤过,精密量取续滤液5 ml,置25 ml量瓶中,加水稀释至刻度,摇匀,作为空白辅料溶液。
依次取空白辅料溶液、对照品溶液、供试品溶液进行全波长扫描,可知,空白辅料全波长扫描基线平稳,最大吸收波长为274.50 nm;参考《美国药典》中愈创甘油醚片的溶出度测定方法,选取274 nm作为检测波长,在该波长下测定上述三个样品,可知,空白辅料的溶出量为2.79%,故可判定空白辅料对供试品的溶出度测定无影响。结果见表1,图1。

Table 1. Excipients interfere with the test results
表1. 辅料干扰试验结果
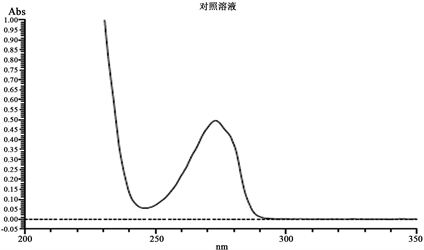
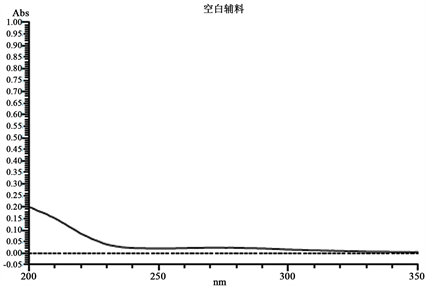
Figure 1. Full wavelength scan of the reference and blank excipient solution
图1. 对照品和空白辅料溶液全波长扫描图
3.2.2. 滤膜吸附性试验
取本品,照“3.1测定方法中供试品溶液制备方法”,制备供试品1号溶液,另取适量,经0.45 μm的微孔滤膜过滤,作为供试品2号溶液。取供试品1溶液和2号溶液,照紫外–可见分光光度法在274 nm处测定吸光度,过滤前后吸光度差值为0.0008,该值 < 0.1,溶出量差值为0.15%,说明滤膜对供试品没有吸附作用。
3.2.3. 精密度试验
1) 重复性
取本品,照“3.1测定方法中供试品溶液制备方法”操作,连续取样6次,分别配制成供试品溶液,在274 nm波长下测定吸光度,吸光度的均值为0.4843、RSD值0.29%,表明本方法精密度良好。
2) 中间精密度
取本品,照“3.1测定方法中供试品溶液制备方法”操作,在不同日期,由不同分析人员于另一溶出仪上进行溶出试验,平行配制6份供试品溶液,在274 nm波长下测定吸光度,与上述“1) 重复性”的6份样品吸光度进行比较,12份测定结果的吸光度均值为0.4868、RSD值0.31%,表明本方法中间精密度良好。
3.2.4. 线性和范围试验
愈创甘油醚对照品溶液母液:取愈创甘油醚对照品约22 mg,精密称定,置25 mL量瓶中,加水稀释至刻度,摇匀,即得。
精密量取上述母液1、2、3、4、5、6 mL,分别置10 mL量瓶中,加水稀释至刻度,摇匀;分别精密量取3 mL,各置20 mL容量瓶中,加水稀释至刻度,摇匀,备用。在274 nm波长下测定吸光度,以浓度为横坐标,吸光系数为纵坐标进行线性回归,愈创甘油醚线性方程为:y = 11.333x + 0.0087,r = 0.9999,见图2,可知,愈创甘油醚在浓度为0.0135~0.081 mg/ml的浓度范围内,方法的线性良好。
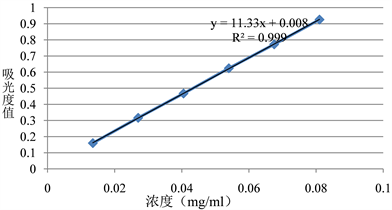
Figure 2. Linear diagram of guaifenesin tablets
图2. 愈创甘油醚片线性图
3.2.5. 准确度试验
取空白辅料(按处方比例配制) 10 mg,共9份,置20 mL量瓶中,分别精密称取愈创甘油醚对照品10、15、20 mg,各3份,加水适量,振摇使溶解,再定容至刻度,摇匀,经0.8 μm滤膜过滤,取滤液2 mL,置50 mL量瓶中,摇匀,作为供试品溶液;取愈创甘油醚约10 mg,置10 mL量瓶中,加水溶解至刻度,精密量取1 mL,置25 mL容量瓶中,用水定容至刻度,作为对照品溶液。
取供试品溶液和对照品溶液,照紫外–可见分光光度法,在274 nm波长下测定吸光度。各个样品的回收率均在95%~102%之间,平均回收率为96.0%,RSD为0.78%,小于2.0%。说明本法的回收率符合溶出度测定要求。结果见表2。

Table 2. Results of accuracy tests (n = 9)
表2. 准确度试验结果(n = 9)
3.2.6. 溶液稳定性
取本品,照“3.1测定方法中供试品和对照品溶液制备方法”操作,制备供试品溶液和对照品溶液,室温条件下放置,分别于0 h、1 h、2 h、3 h、5 h时,在247 nm波长处测定其吸光度值。RSD值为0.19%,表明样品在5小时内溶液稳定性好。
3.2.7. 耐用性
取本品,照“3.1测定方法中供试品和对照品溶液制备方法”操作,制备供试品溶液和对照品溶液,分别在245 nm、247 nm、249 nm波长处测定其吸光度值。各条件下测得的样品溶出量与拟定条件下测得的溶出量的绝对差值不大于2%,表明检测波长耐用性良好。
3.3. 供试品测定
取本品(批号:141101、141102、141103),照“3.1测定方法中供试品和对照品溶液制备方法”操作,制备供试品溶液和对照品溶液。照紫外–可见分光光度法,在274 nm波长下测定吸光度值,计算每片的溶出量,限度为标示量的85%。结果均大于85%,符合规定,结果见表3。

Table 3. Dissolution test results of three batches of samples
表3. 三批样品溶出度试验结果
4. 讨论
4.1. 溶出介质的选择
取愈创甘油醚片,分别选取不同的溶出介质:水、0.1 mol/L盐酸溶液、pH 4.5醋酸盐缓冲溶液、pH 6.8磷酸盐缓冲溶液各900 ml,转速为每分钟50转,经5、10、15、30、45、60分钟取样,测得的溶出量绘制曲线,通过拐点的确认,确定溶出介质和取样时间点。
可知,不同溶出介质的四条溶出曲线重合(各时间点溶出量相差不大于5.0%),同时参考《美国药典》中愈创甘油醚片质量标准中的参数,结合原料性质可知水溶性良好,并且制剂中所用辅料也基本为水溶性的,因此选择以水900 ml为溶出介质,根据溶出曲线拟合图,取样时间选择为45分钟。结果见图3。
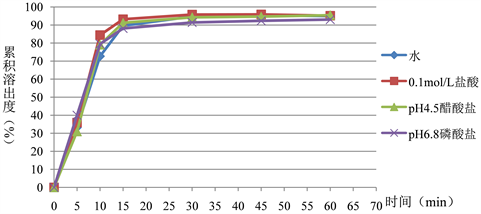
Figure 3. Fitting diagram of dissolution curve of guaifenesin tablets
图3. 愈创甘油醚片溶出曲线拟合图
4.2. 转速的选择
根据《普通口服固体制剂溶出度试验技术指导原则》 [5] ,可知,桨法常用的转速为50~75 rpm之间,比较50 rpm和75 rpm条件下愈创甘油醚片的溶出结果,两种转速条件下本品的溶出性质基本一致,参照《美国药典》中的质量标准参数,综合考虑,选择本品溶出度试验的转速为50 rpm,结果见图4。

Figure 4. Comparison of dissolution results at two different rotational speeds
图4. 两种不同转速条件下的溶出结果比较
4.3. 测定方法的选择
对于口服固体制剂,溶出度已作为控制药品质量的重要指标之一,因此建立该方法能更好地控制产品质量;本文中采用紫外–可见分光光度法测定愈创甘油醚的溶出量,较李筱玲等的愈创维林片的溶出度测定方法研究中使用高校液相色谱法而言 [6] ,方法更简便快捷、可行,根据“3.3供试品测定”测定结果,该方法能对产品质量进行有效控制。