1. 前言
某药业有限公司是一家专业从事医药原料药和中间体的研发、生产、销售企业,是目前国内产量最大的β-内酰胺酶抑制剂原料生产厂家。制药生产过程中,会用到多种材料和溶剂,生产工艺复杂,副产物多,反应复杂,生产流程较长,所以废水中的物质比较多,废水中的污染物含量高、浓度波动大,废水的BOD5/COD值差异较大,COD值和BOD值比较高,氨氮浓度高,色度深,固体悬浮物SS浓度高,有毒有害物质多 [1] [2] [3] 。抗生素医药中间体的废水、抗生素发酵废水等就是一种难降解的、有毒性废水,这类废水含有大量不易降解的物质和抑制微生物作用的物质,使得传统的处理方法很难有成果,且处理成本高。因此处理难降解制药废水是废水治理过程中的难点和重点 [4] [5] [6] 。
Fenton法在治理难降解废水和一般传统污水处理方法难以起效的特种废水时包含有其他技术无法比拟的优越性,既可以作废水的预处理,又可以作废水的深度处理,所以Fenton法在废水处理中具有广阔的应用前景 [7] [8] [9] 。Fenton法具有很高的氧化除污染能力,垃圾掩埋场渗出水、地下水修复、受污染土壤,苯胺以及生物毒性物质如、农药、多氯联苯、硝基苯、氯酚类化合物、染料废水等都可以用Fenton法进行处理 [10] [11] [12] 。
Fenton法已被应用于多种工业废水的处理。但此工艺的主要缺点是需要投加大量的亚铁盐(通常是硫酸亚铁),亚铁盐的过量使用可能产生大量铁泥,而这些含铁污泥的处理十分困难。近年来,研究人员正在进行其他类Fenton体系的研究,如零价铁(Fe0)在酸性条件下氧化原位产生Fe2+,促进羟基自由基的生成研究。这种替代法主要的优点是可利用便宜的Fe0代替Fenton反应中的铁盐,而且反应过程产生的Fe3+还可以在Fe0颗粒表面被快速还原成Fe2+来取代亚铁盐的添加 [13] [14] 。本实验为了探究Fe0/H2O2技术处理江西富祥药业公司制药废水的可行性,考察Fe0的还原时间、Fenton试剂反应时间、Fe0的投加量、H2O2的投加量、pH、制药废水初始浓度等对废水中有机污染物去除率的影响,为医药化工废水氧化预处理提供借鉴。
2. 实验内容
2.1. 实验水样
实验中废水来自某制药企业的二沉池废水。本次实验是检测废水的COD和氨氮的去除情况。水样的水质指标为:COD = 22,300 mg/L,NH3-N = 1204 mg/L,pH = 6.1~7.5。
2.2. 实验药品
还原铁粉,氢氧化钠(A.R,国药集团化学药剂有限公司),邻菲罗啉(C12H8N2·H2O),过氧化氢(30%),次氯酸钠(A.R,西陇化工股份有限公司),浓硫酸、硫酸亚铁铵、硫酸亚铁、氯化铵、硫酸银和氢氧化钾(A.R,上海九亿化学试剂有限公司),水杨酸([C6H4(OH)COOH]、酒石酸钾钠(KNaC4H6O6·4H2O)、重铬酸钾、硫酸铝钾(A.R,天津恒兴化学试剂制造有限公司),钼酸铵(A.R,天津市化学试剂四厂凯达化工厂),硫酸汞、亚硝基铁氰化钠(Na2[Fe(CN)6NO]·2H2O,A.R,上海展云化工有限公司),去离子水(实验室制备)。
2.3. 试验仪器和设备
紫外可见分光光度计(UV-5100B,上海元析仪器有限公司),pH/电导计(DZS-708-A,上海仪电科学仪器股份有限公司),恒温水浴震荡器(SHA-B,金坛市荣华仪器制造有限公司),智能消解仪和COD快速测定仪(6B-12,江苏盛奥华环保科技有限公司)。
2.4. 实验过程
试验均为水浴控温室温(25℃ ± 1℃),常压下进行。取100 mL废水置于三角锥形瓶,使用1 mol/L硫酸和1 mol/L氢氧化钠调节废水至某一pH值,投加一定量的Fe0,置于摇床180 r/min振荡反应一段时间,反应结束后向体系中投加一定量H2O2,置于摇床180 r/min振荡反应继续反应一段时间;反应结束后,将溶液从反应体系中脱离,并向溶液中加1 mol/L NaOH溶液将水样pH调至中性,使水样中铁离子形成氢氧化铁,从而进行混凝沉淀。经过一定时间静沉后,水样用滤膜过滤后采用重铬酸钾测定COD、采用水杨酸分光光度法(GB7481-87)测定氨氮。氨氮标准曲线A = 0.06015C + 0.02582,R2 = 0.9952。
3. 实验结果与分析
3.1. 对照试验
考察单独Fe0还原作用,实验中控制废水初始pH = 4.0,Fe0投量为0.3 g/L,在摇床160 rpm转速下反应12 h,反应结束后调节废水pH使废水中产生的Fe沉淀进行混凝反应,测定反应前后的COD及氨氮含量。实验发现,单独零价铁还原对COD及氨氮去除率低于25%。同时,为考察单独H2O2氧化作用,实验中投加12 mmol/L H2O2,废水pH = 4,静置反应12 h,反应前后测定废水的COD。实验发现,单独 H2O2氧化作用对COD去除率仅达到27.6%。
以上实验说明,废水中有机物成分复杂,稳定性高,单独采用Fe0还原作用或是H2O2氧化作用对有机物去除效果较差。下一步考虑将Fe0还原作用和H2O2氧化作用结合,并对药剂投加量、时间、pH值、废水浓度等参数进行优化。
3.2. Fe0还原时间对去除率的影响
实验中考察了Fe0及H2O2投加时间间隔,即Fe0还原时间对有机物去除效果的影响。先投加0.2 g/L Fe0反应一段时间后再投加10 mmol/L H2O2,控制废水pH = 4,Fe0反应时间分别为0 min、20 min、40 min、60 min、80 min,再加入H2O2后反应时间为40 min,检测COD和氨氮的含量,计算去除率。结果如图1所示。
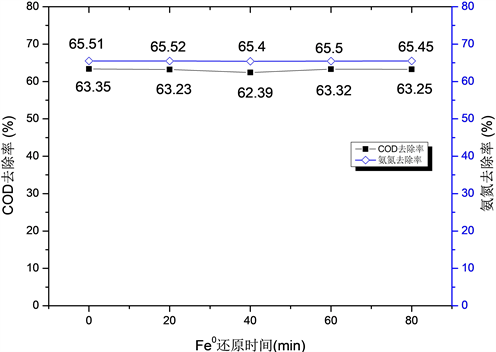 (pH = 4, Fe0 = 0.2g/L, H2O2 = 10 mmol/L, t = 60 min)
(pH = 4, Fe0 = 0.2g/L, H2O2 = 10 mmol/L, t = 60 min)
Figure 1. Effect of Fe0 reduction time on removal rate
图1. Fe0还原时间)对去除率影响
从图中可以发现,对比单独Fe0及H2O2作用,在Fe0之后投加H2O2后,COD去除率提高至60%以上,两者结合明显提高有机物去除效果;同时,在同一时间加入Fe0、H2O2和分不同的时间投加Fe0后再加入H2O2对有机物去除几乎没有影响,探究其中的原因,已经发现,单独Fe0作用对有机物去除速率慢,效率低。前期实验发现,单独混凝处理废水时,有机物去除为17%左右;这与单独Fe0作用有机物去除率很接近,因此猜测单独Fe0作用主要通过在酸性pH下Fe0腐蚀,溶出Fe2+离子,进而产生的铁盐混凝作用来去除有机物,而Fe0还原作用对此有机物的直接去除并不显著。
由于Fe0与H2O2投加间隔时间对有机物去除影响较低,因此,在后续实验中采用Fe0之后立即加入H2O2的投加方式。
3.3. Fe0/H2O2反应时间的影响
实验中考察了Fe0/H2O2反应时间的影响。在Fe0 = 0.2 g/L,H2O2 = 10 mmol/L的投加量下,控制废水pH = 4,原废水稀释10倍,Fe0/H2O2一起反应时间分别为10 min、20 min、40 min、60 min、80 min、100 min。结果如图2所示。
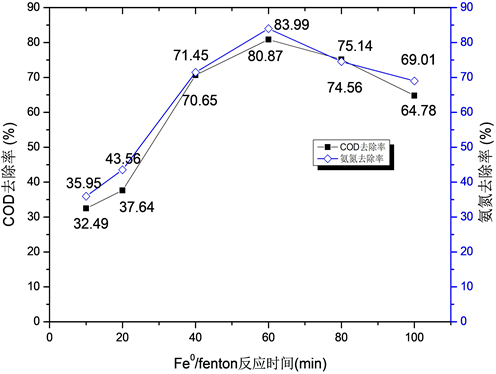 (H2O2 = 8 mmol/L, Fe0 = 0.2 g/L, pH = 4)
(H2O2 = 8 mmol/L, Fe0 = 0.2 g/L, pH = 4)
Figure 2. The effect of Fe0/H2O2 reaction time on removal rate
图2. Fe0/H2O2反应时间对去除率的影响
前期实验发现采用传统Fenton试剂处理废水时,2 min的反应时间就能够达到较高的有机物去除效果,而Fe0/H2O2处理废水所需时间更长。这可能是因为在Fe0/H2O2体系中,Fe0反应溶出的Fe2+与H2O2构成的Fenton试剂的氧化作用在有机物的去除中占用更重要的作用;尽管Fe2+与H2O2速率较快,但Fe0与H+反应生成Fe2+的过程相对缓慢一些,所以在图中可以看到0~20 min时,去除率上升较慢,20 min之后速率就加快了很多。
随着Fenton反应的开始,水样中产生的·OH逐渐增多,图中可以看出,随着反应时间的增长,COD 及氨氮去除率逐渐上升,并在60 min处,均达到最大值,同时随着反应的进行,反应中pH值逐渐升高,60 min后去除率开始逐渐下降,水中最后只剩下不能被降解的有机物。反应时间再增加不能进一步提高有机物去除效果。因此,最佳反应时间为60 min,并作为后续实验的反应时间。
3.4. pH对废水COD和氨氮去除率的影响
实验中考察了pH对废水COD和氨氮去除率的影响。在Fe0 = 0.2 g/L,H2O2 = 10 mmol/L的投加量下,控制反应时间为60 min,pH分别为1、2、3、4、5,原废水分别稀释10倍时,分别检测COD和氨氮的去除率。结果如图3所示。
pH是Fenton试剂等高级氧化技术的有机物去除效果的重要影响因素。由于在中性和碱性条件下,H2O2会很快钝化Fe0表面,阻止Fe0进一步腐蚀,大大的减少了Fe离子的溶出,影响反应的进一步进行,因此一般认为酸性pH适宜Fe0/H2O2反应。实验中只考察了酸性pH = 1.0~6.0条件下有机物去除情况。
实验中控制Fe0 = 0.2 g/L,H2O2 = 10 mmol/L,反应时间为60 min,研究了PH对Fe0/H2O2反应有机物去除率的影响,结果如图所示。从图中可以看出,废水pH对COD去除率影响较大,在其他反应条件相同的情况下,反应中的pH从1.0逐渐增加至6.0,COD及氨氮去除率为先上升再下降,并在在pH = 3.0处达到最大值,COD和氨氮的去除率分别为85.96%,84.53%。在H2O2存在下,pH对于铁的腐蚀和表面钝化起着非常重要的作用,H+主要消耗在铁的腐蚀反应中,产生的Fe2+进一步和H2O2反应,产生氧化性极强的羟基自由基,进一步氧化有机物。在pH值为3.0~4.0时,去除率相对比较稳定,当pH增大时,
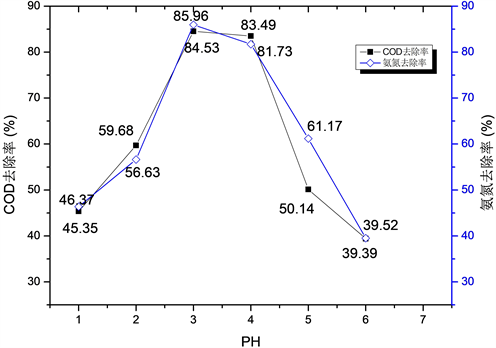 (Fe0 = 0.2 g/L,H2O2 = 10 mmol/L,反应时间 = 60 min)
(Fe0 = 0.2 g/L,H2O2 = 10 mmol/L,反应时间 = 60 min)
Figure 3. The effect of pH on removal rate
图3. pH对去除率的影响
与Fe0反应的H+量较少,进而产生的羟基自由基量较少,而且使溶液中的Fe2+以氢氧化物的形式沉淀而失去催化能力。因此COD去除效率降低;而在pH = 1时,过量的H+与铁离子水合,降低铁离子活性;同时H+也是羟基自由基抑制剂,因此降低了有机物的去除效率。将pH = 3作为后续的反应条件。
3.5. Fe0投加量对废水COD和氨氮去除率的影响
实验中考察了Fe0投加量对废水COD和氨氮去除率的影响。在H2O2 = 10 mmol/L,Fe0分别投加0.05 g/L、0.1 g/L、0.2 g/L、0.4 g/L、0.6 g/L的投加量下,控制反应时间为60 min,pH = 3,原废水稀释10倍时,分别检测COD和氨氮的去除率。结果如图4所示。
 (H2O2 = 8 mmol/L,pH = 3,反应时间 = 60 min)
(H2O2 = 8 mmol/L,pH = 3,反应时间 = 60 min)
Figure 4. The effect of Fe0 dosage on removal rate
图4. Fe0投加量对去除率的影响
由图可知,COD和氨氮的去除率随Fe0投加量的增加而增加,在投加量为0.2 g/L时达到最大,随后去除率又开始下降。所以,在一定范围内,随着零价铁的加入,有机物去除率会逐渐增加的。原因可能是,随着Fe0投量的增加,一方面过量的Fe0与H+反应生成的Fe2+,会消耗羟基自由基,而产生的Fe3+很容易发生凝结或沉淀。另一方面,过量的Fe3+再生成Fe2+的反应速率比较慢。反应式为:
故Fe0投加量为0.2 g/L时为最佳,也将用于后续实验的投加量。
3.6. H2O2投加量对去除率影响
实验中考察了H2O2投加量对废水COD和氨氮去除率的影响。Fe0 = 0.2 g/L,H2O2分别投加4 mmol/L、6 mmol/L、8 mmol/L、10 mmol/L、12 mmol/L的投加量下,控制反应时间为60 min,pH = 3,原废水分别稀释10倍时,分别检测COD和氨氮的去除率。结果如图5所示。
 (Fe0 = 0.2g/L,pH = 3,反应时间 = 60 min)
(Fe0 = 0.2g/L,pH = 3,反应时间 = 60 min)
Figure 5. Effect of H2O2 dosage on removal rate
图5. H2O2投加量对去除率影响
在Fe0/H2O2反应体系中,H2O2消耗量略高于传统Fenton体系,这可能与体系特殊的氧化途径有关,在Fe0/H2O2反应体系中,H2O2的消耗,一方面用于反应生产的Fe2+进行反应,同传统Fenton试剂反应途径产生羟基自由基氧化有机物;另一方面,H2O2/H2O氧化还原电为1.77,远大于H+/H2O的氧化还原电位,H2O2消耗在同Fe0直接反应上,反应式为:
;
;
。
随着H2O2投加量的增加,COD及氨氮的去除率均逐渐增加,当H2O2投量超过10 mmol/L后,COD及氨氮的去除率均增加不大。可能的原因是,过量的H2O2成为了羟基自由基(·OH)的抑制剂,产生的·OH可与过量的H2O2进一步反应生成氧化能力低于·OH的·HO2,·OH还会与生成的·HO2继续发生反应,最终放出O2,导致部分·OH被自消耗。同时过量的H2O2也抑制了Fe0向Fe2+的转变。反应式为:
;
因此将10 mmol/L作为过氧化氢的最佳投量。
3.7. 初始废水浓度对去除率的影响
实验中考察了废水初始浓度对废水COD和氨氮去除率的影响。Fe0 = 0.2 g/L,H2O2 = 10 mmol/L的投加量下,控制反应时间为60 min,pH = 3,原废水分别稀释40倍、20倍、10倍、5倍、2倍时,分别检测COD和氨氮的去除率。结果如图6所示。
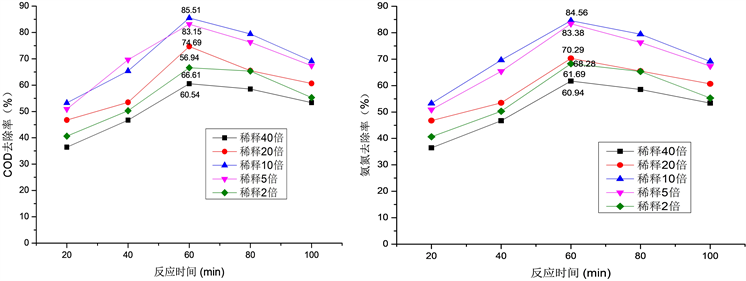 (Fe0=0.2 g/L,H2O2=10 mmol/L,反应时间= 60 min)
(Fe0=0.2 g/L,H2O2=10 mmol/L,反应时间= 60 min)
Figure 6. The effect of initial concentration of wastewater on removal rate
图6. 废水初始浓度对去除率的影响
由图6中可以看出,废水初始浓度的改变,对有机物的氧化效率有较大的影响,在废水浓度在稀释40倍后,即COD浓度为557.5 mg/L,氨氮浓度30.1 mg/L左右时,去除率是最低的,可能Fe0和H2O2的过量存在会导致抑制反应的进行,另一方面过量的会Fe0与H2O2反应,造成OH−的增多,然后与Fe3+发生反应,导致去除率降低。反应式如下:
废水浓度稀释10倍,即COD浓度为2230 mg/L氨氮浓度为120.4 mg/L左右,在其他条件相同时,COD去除率达到最高为85.52%,氨氮去除率最高为84.56%。在废水稀释10倍、20倍时,废水中有机物的去除率比较稳定,说明废水浓度为2000 mg/L~4000 mg/L时,废水COD和氨氮去除率是相对较高的。废水浓度稀释2倍时,有机物的去除率开始下降,由于废水浓度过大,Fe0和H2O2的投加量要适当调解。所以在废水浓度稀释10倍时,COD和氨氮的去除率是最高的。
3.8. Fe0/ H2O2氧化与传统Fenton法比较
传统Fenton工艺具有高效、操作费用低等优点,但后续会产生氢氧化铁污泥。Fenton反应体系中存在的问题就是Fe3+返回Fe2+的反应速率很低,反应过程中铁离子循环受阻,因此,需要不断地补充Fe2+使反应得以继续。
而Fe0/ H2O2类Fenton体系可以克服这些缺陷。
依靠零价铁在酸性条件下生成的Fe2+和H2O2构成Fenton体系,通过Fe0的还原作用和Fenton体系产生的羟基自由基(·OH)的氧化作用来降解废水中的有机物。·OH的氧化电位较高是2.8 V,仅次于氟的2.87 V,它可使难降解有机污染物发生断键、取代、电子转移、开环、加成等反应,使难降解的大分子有机物转变为易降解的小分子物质,反应最终产物基本上为CO2和 H2O,并且无剩余污泥和浓缩物生成。主要作用机理如式(1)~(7)。
(1)
(2)
(3)
(4)
(5)
(6)
(7)
从反应式可以看出,在Fe0/H2O2非均相类Fenton系中Fe0可以生成Fe2+,同时Fe0的存在能及时将产生的Fe3+还原成Fe2+,使Fe2+得到及时补充,这样可以提高·OH产率从而有效提高有机污染物降解能力。
4. 结论
本研究的目的是采用Fe0/H2O2技术处理景德镇市富祥药业有限公司废水的可行性。依靠零价铁在酸性条件下生成的Fe2+和H2O2构成Fenton体系,通过Fe0的还原作用和Fenton体系产生的羟基自由基(·OH)的氧化作用来降解废水中的有机物。通过单因素的对比实验,研究了Fe0/H2O2深度氧化处理制药废水的影响因素,得到如下结论:
1) 废水中有机物成分复杂,稳定性高,单独采用Fe0还原作用或是H2O2氧化作用对有机物去除效果较差。
2) Fe0/H2O2氧化的组合对废水有机物的降解具有速度快,去除率较高的优点。通过对影响因素分析,确定了Fe0/H2O2体系–混凝工艺深度处理制药废水的最佳条件为:H2O2 = 10 mmol/L,Fe0 = 0.2 g/L,反应初始pH值为3,反应时间为60 min,混凝pH为7.0。在该条件下,原废水稀释10倍,即COD浓度为2230 mg/L氨氮浓度是120.4 mg/L时,COD去除率为85.52%,氨氮去除率为84.56%。
3) Fe0/H2O2氧化受初始pH影响大,且需要较长反应时间,控制Fe0和H2O2在一定范围内;但Fe0/H2O2氧化对Fe利用率较高,Fe0/H2O2体系对Fe的需求量比Fenton体系的低得多。
4) Fe0/H2O2氧化的组合针对富祥药业的废水的处理是可行的。由于富祥药业制药废水COD含量过大,因此要根据实际出水情况,调节药剂投加量;其次,可进一步优化处理工艺,使深度处理后出水达到回用水标准,并进行回用。
参考文献