摘要: 目的:探讨在治疗颈动脉粥样硬化性狭窄手术中,运用神经电生理实时监测和荧光造影辅助下的临床疗效。方法:收集2021年1月至2023年1月术中神经电生理监测联合荧光造影下行颈动脉内膜剥脱术(carotid endarterectomy, CEA)治疗的90例103侧颈动脉狭窄的临床资料,其中13例是双侧狭窄,先后接受两次手术治疗,采用经典式或者翻转式CEA,术中采用神经电生理技术监测躯体感觉诱发电位(somato sensory evoked potential, SEP)和躯体运动诱发电位(motion evoked potential, MEP)波幅的改变,使用吲哚菁绿(indocyanine green, ICG)血管造影和FLOW 800计算机整合软件分析技术,评估颈动脉斑块切除前后血管荧光显影。结果:术中神经电生理监测未见波幅异常94例,有异常监测指标9例,MEP异常检测指标6例、SEP异常检测指标7例,MEP和SEP同时出现异常检测指标4例,术后神经功能均良好,无遗留神经功能障碍病例。ICG造影均显示术侧颈动脉术后血流通畅,术后1、6个月复诊,均无遗留神经功能障碍。9例术后再狭窄,均为轻度狭窄无症状。结论:术中神经电生理监测联合荧光造影下颈动脉内膜剥脱术治疗颈动脉粥样硬化性狭窄是一种实用、高效、稳妥的方法,可为术者及时反馈神经功能信息,并评估脑供血情况和组织灌注状态,术中应用ICG荧光造影对术中明确斑块位置、避免斑块残余、预防脑缺血或过度灌注有重要作用,提高手术的成功率,降低术后并发症的发生率,有效改善患者的预后。
Abstract:
Aim: To investigate the clinical effect of real-time neurophysiological monitoring and fluorescein angiography in the treatment of carotid atherosclerotic stenosis. Method: Clinical data of 103 carot-id artery strictures in 90 cases with intraoperative neurophysiological monitoring combined with carotid endarterectomy under fluorescence angiography were collected from January 2021 to Jan-uary 2023. Among them, 13 cases were bilateral strictures, which were treated with classic or in-verted CEA. During the operation, the changes of somatosensory evoked potential and somatomotor evoked potential amplitude were monitored by neuroelectrophysiological techniques. Indocyanine green angiography and FLOW 800 computer integrated software analysis techniques were used to evaluate vascular fluorescence imaging before and after carotid plaque resection. Results: In-traoperative neuroelectrophysiological monitoring showed no abnormal amplitude in 94 cases, ab-normal monitoring indicators in 9 cases, abnormal MEP detection indicators in 6 cases, abnormal SEP detection indicators in 7 cases, and abnormal MEP and SEP detection indicators in 4 cases. All the postoperative neurological functions were good, and no cases of residual neurological dysfunc-tion were found. ICG angiography showed unobstructed carotid blood flow after operation, and no residual neurological dysfunction was found at 1 and 6 months after surgery. Restenosis occurred in 9 cases, all of which were mild and asymptomatic. Conclusion: Intraoperative nerve electrophysio-logical monitoring combined with carotid endarterectomy under fluorescence angiography is a practical, efficient and secure method for the treatment of carotid atherosclerotic stenosis, which can provide timely feedback of nerve function information and evaluate the cerebral blood supply and tissue perfusion status. Intraoperative ICG fluorography plays an important role in determining the location of plaques, avoiding plaque residual, preventing cerebral ischemia or overperfusion, improving the success rate of surgery, reducing the incidence of postoperative complications, and effectively improving the prognosis of patients.
1. 引言
颈动脉粥样硬化性狭窄是引起缺血性脑卒中和短暂性脑缺血发作(Transient ischemic attack, TIA)的主要原因之一 [1] ,缺血性脑卒中是全球第二大死因,也是导致残疾的主要原因 [2] 。目前,颈动脉内膜剥脱术(carotid endarterectomy, CEA)是手术治疗颈动脉狭窄的有效方法 [3] 。然而CEA的术后并发症始终困扰着神经外科医生,如术中操作干扰到颈动脉周围颅神经、脑组织灌注不足导致的术后神经功能障碍,和术后脑高灌注综合征、残余狭窄等 [4] 。手术中运用神经电生理监测技术,可以实时监测处在危险状态的神经功能,及时发现和辨明可能由于手术造成的神经损害,并迅速纠正可逆性损害,避免永久性损害,提高手术安全性。秦海林等人研究多参数监测应用在颈动脉内膜斑块剥脱术(CEA)中,75例患者术中应用SEP、MEP联合监测,术中发生预警17例,预警后及时提醒术者改变操作等措施干预,术后仅1例出现短暂性脑缺血发作,1例因过度灌注致对侧肢体轻瘫,术后未发生栓塞事件 [5] 。Haga等 [6] 在2011年报道,将ICG荧光造影应用CEA中,能够清晰地显示术中颈内动脉斑块的位置,评估颈内动脉血流通畅情况;FLOW800计算机整合软件分析造影的原始图像,获取斑块的位置信息,斑块和血管的位置关系,颈内动脉严重狭窄,尤其是伴血管内塌陷情况下,得到半定量、实时的信息,更好地判断手术效果 [7] 。2021年1月至2023年1月CEA术中运用神经电生理监测联合IGG造影治疗颈动脉狭窄90例,现报道如下。
2. 临床资料
2.1. 一般资料
收集2021年1月至2023年1月术中神经电生理监测联合荧光造影下CEA治疗的90例103侧颈动脉粥样硬化性狭窄的临床资料,均采用经典式或者翻转式CEA。90例中,男73例,女17例;平均年龄66 (65.98)岁,双侧狭窄并行手术患者13例,平均55 (55.53)岁。头晕43例,一过性黑朦、TIA 25例,脑梗死史致肢体感觉或运动障碍13例,脑梗死史致语言功能障碍9例。
2.2. 术前检查
术前明确颈部血管狭窄和颅脑血管情况,行颈部血管超声、经颅多普勒内段 + 球后血管、颅脑和颈部CT血管造影(CT angiography, CTA)、数字减影血管造影(digital subtraction angiography, DSA)、脑动脉血质子自旋标记灌注成像、颅脑核磁共振平扫(Magnetic Resonance, MR)检查。颈动脉狭窄程度分级标准参考北美症状性颈动脉狭窄检测方法(NASCET) [8] 。单侧中、重度狭窄54例,双侧中、重度狭窄36例。
2.3. 治疗方法
术前患者均口服阿司匹林或者氯吡格雷等进行抗血小板治疗,阿司匹林100 mg/d或者氯吡格雷75 mg/d、口服阿托伐他汀钙片20 mg/d或者瑞他伐他汀钙片10 mg/d进行降脂治疗。首次行手术治疗的双侧颈动脉狭窄者,选取有症状发生的一侧责任血管CEA治疗,双侧均有症状时,先做症状严重的一侧,两个月后做对侧手术,第二次手术前均行电子喉镜检查,检查声带和舌头运动情况,双侧声带或舌下神经麻痹是不可逆的严重并发症。采用经典式或者翻转式CEA,采用标准颈动脉内膜剥脱术(Standard carotid endarterectomy, sCEA) 32侧、外翻式颈动脉内膜剥脱术(Valgus carotid endarterectomy, eCEA) 71侧,均未使用转流,不使用补片。颈动脉阻断时间15~60 min,平均22 (21.66) min,术中推低分子肝素5000 U。
手术均在气管插管全身麻醉下进行,术中神经电生理监测方式;术中为患者进行MEP、SEP。采用美国Cadwell Cascade 32导术中诱发电位监护系统,由1名经验丰富的电生理监测医师进行监测,对所有患者进行MEP和SSEP监测。根据国际脑电图电极放置10/20系统标准 [9] ,安放电极及设定参数:1) MEP监测,刺激部位为C1 (左)和C2 (右),记录部位为大小鱼际肌和拇短展肌。刺激电极为螺旋状电极,记录电极为针状电极。MEP一般采用8个脉冲序列,刺激强度为100~400 V,刺激间隔为50~500 μs,刺激频率为250~500 Hz。带通滤波器范围为30~3000 Hz,陷波滤波器为50 Hz,分析时间为50~100 ms。2) SEP 监测,刺激部位为正中神经和踝部胫后神经,记录部位为C3'、C4'和Cz,参考部位为FPz。刺激电极采用针电极,记录电极采用螺旋电极。采用恒流单相脉冲刺激,刺激频率2.79 Hz,刺激间期200 μs,电流


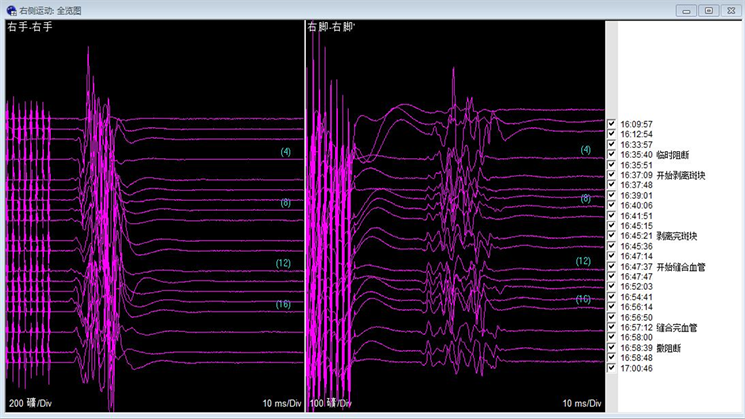
Figure 1. Normal electrophysiological monitoring potential amplitude during CEA surgery for carotid artery stenosis
图1. 颈动脉狭窄CEA术中正常电生理监测电位波幅
刺激强度15~35 mA,灵敏度1~10 μV,带通30~500 Hz,时程50~100 ms,平均叠加100~200次 [10] 。麻醉后和阻断颈动脉前分别记录一次MEP和SEP,以获得基线值。阻断颈动脉时,应频繁记录MEP和SEP。排除麻醉和生理作用,预警标准:MEP或SEP波幅下降超过50%或潜伏期延长超过10%被认为是需要早期预警和干预的重大变化。一旦出现警告,手术医生应采取适当的措施,如放置转流或者提高患者血压,以恢复MEP或SEP波幅,防止不可逆的缺血性损伤。CEA术中正常电生理监测电位波幅见图1。
ICG术中以12.5 mg静脉推注给药,给予约0.25 mg/kg剂量(25 mg溶解在5 ml盐水中)。静脉注射后,ICG主要与循环球蛋白结合,并保持血管内。与球蛋白结合后,它成为具有805 nm吸收和835 nm发射峰的NIR荧光染料。在这些波长下,内源性色球引起的吸收很低。ICG由肝脏排泄,血浆半衰期为2~4分钟。当染料进入近红外光照射的手术视野中的血管时,诱导ICG荧光 [5] 。ICG造影和FLOW 800计算机整合软件分析技术,即时彩色显示术中ICG荧光造影结果分析ICG荧光强度,评估颈动脉内膜斑块剥脱前后颈动脉的荧光显影成像 [11] 。
2.4. 术后处理
术后24 h严密监测患者生命体征和神经功能状态,严格控制血压,由于术后颈动脉压力感受器功能丧失,易导致血压波动过大,高血压病史病人,收缩压控制在120~140 mmHg。生命体征平稳情况下术后当天口服抗血小板药物和降脂药物。出院前、出院后1个月、6个月复查,使用颈部血管超声、颈部CTA或者DSA评估血管情况。
3. 结果
术中电生理监测90例患者103侧颈动脉内膜剥脱手术。术中神经电生理监测未见波幅异常94例,有异常监测指标9例,MEP异常检测指标6例、SEP异常检测指标7例,MEP和SEP同时出现异常检测指标4例,术中及时提醒术者,做出应对措施,提高患者血压、补充血容量等,术后未遗留神经功能障碍。颈动脉阻断前荧光造影显现术侧颈动脉狭窄处斑块的位置,内膜斑块剥离解除阻断后术侧颈动脉显示血流通畅,斑块剥离彻底,血流速度上升。出院前、术后1个月和6个月复查颈部CTA或颈部超声,提示术侧血管均通畅,术后无脑高灌注综合征、脑卒中等并发症出现,9例出现术后再狭窄,均为轻度狭窄无症状。
4. 典型病例
4.1. 病例1
患者女性,67岁,主诉右侧肢体无力进行性加重伴头晕4月,于2021年4月12日入住我院神经外科。入院诊断:左侧颈内动脉重度狭窄;颅内多发腔隙性梗塞;高血压病;2型糖尿病;冠脉动脉钙化。行颈部CTA示左侧颈内动脉起始处管腔重度狭窄(见图2),术前患者规律口服抗血小板和降脂药物治疗,在全身麻醉下行左侧颈动脉内膜切除术(翻转式),术中运用神经电生理监测和ICG造影辅助。术中行MEP和SEP联合监测,颈动脉阻断时间24分钟。术中行ICG荧光造影显示斑块主体位于颈内动脉起始部,颈动脉狭窄处显影欠佳,解除阻断后颈动脉血管通畅(见图3)。术中阻断血管进行斑块剥离时出现MEP和SEP波幅消失,负责监测医师排除非手术因素后向术者报告。术者随即嘱麻醉医师使用升压药物、补充血容量等方法使患者血压收缩压提高基础血压的10%,缝合完毕解除血管阻断后波幅完全恢复(见图4)。术后第3天复查颈部CTA示颈动脉狭窄解除,血流通畅,无斑块残留,术后患者肢体活动明显改善,头晕症状完全消失,无神经功能障碍遗留。术后患者规律口服抗血小板和降脂药物治疗,术后半年和一年行DSA复查示左侧颈动脉血管显影通畅,无再发狭窄,无斑块残留(见图5)。
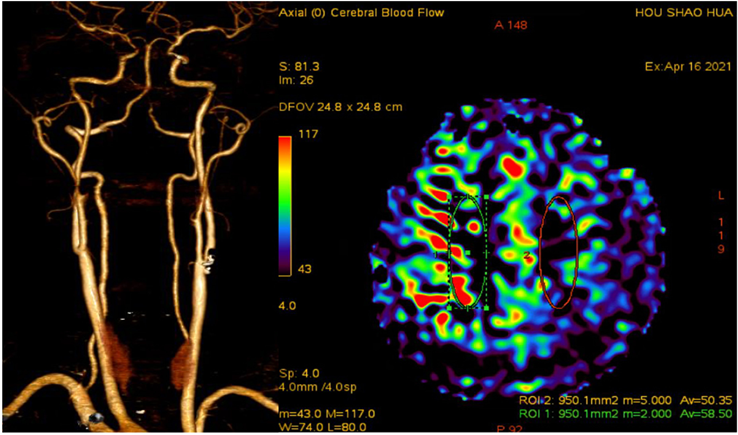
Figure 2. Preoperative CTA and ASL in the patient’s neck and brain indicate severe stenosis above the bifurcation of the left carotid artery, and the blood flow perfusion in the left brain is significantly decreased compared to the contralateral side
图2. 患者术前颈部和脑部CTA和ASL,提示左侧颈动脉分叉部上方重度狭窄,左侧大脑血流量灌注较对侧明显下降
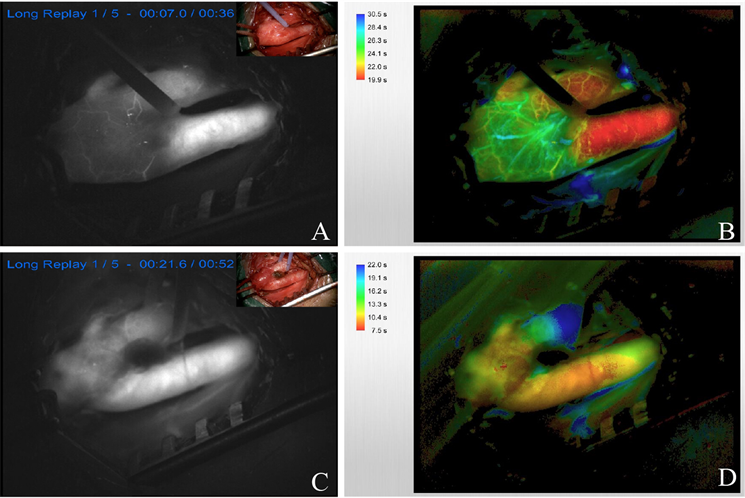
Figure 3. Comparison of intraoperative fluorescein before and after carotid endarterectomy
图3. 术中对患者颈动脉内膜剥脱前后的荧光造影对比


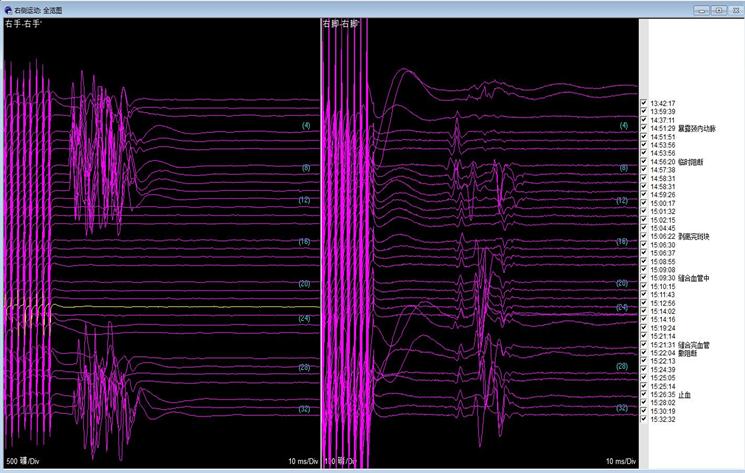
Figure 4. Intraoperative neuroelectrophysiological monitoring of potential amplitude indicated that the decrease in sensory and motor potential of the right limb nearly disappeared during the operation and returned to the baseline level with the opening of blood vessels
图4. 术中神经电生理监测电位波幅,提示右侧肢体感觉和运动电位术中有下降接近消失,随着血管的开放恢复至基线水平

Figure 5. DSA reexamination six months after surgery (figures A and B) and one year (figures C and D) showed that the left carotid artery was unobstructed
图5. 术后半年(A和B图)和一年(C和D图)行DSA复查示左侧颈动脉血管显影通畅
4.2. 病例2
患者男性,64岁,主诉因头晕3年,加重1周于2022年6月28日入住我院神经外科。入院诊断:双侧颈内动脉中重度狭窄。行颈部CTA示右侧颈内动脉起始处管腔重度狭窄(见图6),术前患者规律口服抗血小板和降脂药物治疗,在我院全身麻醉下行右侧颈动脉内膜切除术(翻转式),术中运用神经电生理技术和ICG造影辅助。颈动脉阻断时间22分钟,解除阻断后颈内动脉血管通畅,颈外动脉显影稍差,术中未作处理(见图7)。术中行MEP和SEP联合监测,颈动脉阻断时间22分钟,术中阻断血管进行斑块剥离时出现SEP和MEP波幅消失,负责监测医师排除非手术因素后向术者报告,术者随即进行血压的调整和加快手术进程,缝合完毕解除血管阻断后SEP波幅完全恢复。左下肢MEP波幅未恢复至基线水平(见图8)。术中行ICG荧光造影显示斑块主体位于颈动脉球部和颈内动脉起始部,颈动脉狭窄处显影欠佳,术后第3天复查颈部CTA示颈内动脉血流通畅,颈外动脉未显影,颈动脉分叉部无斑块残留,狭窄解除,术后患者肢体活动无明显不适,头晕症状基本消失,无神经功能障碍遗留。术后患者规律口服抗血小板和降脂药物治疗,术后半年复查颈部CTA示左侧颈内动脉血管显影通畅,颈外动脉血管起始部轻度狭窄。

Figure 6. Preoperative CTA in the patient’s neck and brain, indicating severe internal carotid artery stenosis above the right carotid artery bifurcation
图6. 患者术前颈部和脑部CTA,提示右侧颈动脉分叉部上方颈内动脉重度狭窄

Figure 7. Comparison of intraoperative fluorescein before and after carotid endarterectomy
图7. 术中对患者颈动脉内膜剥脱前后的荧光造影对比

Figure 8. Intraoperative neuroelectrophysiological monitoring of potential amplitude indicated that the decrease in sensory and motor potential of the left limb was close to disappearing during the operation, and the sensory potential returned to the baseline level with the opening of blood vessels, but the motor potential amplitude of the left lower limb did not recover
图8. 术中神经电生理监测电位波幅,提示左侧肢体感觉和运动电位术中有下降接近消失,随着血管的开放感觉电位恢复至基线水平,但左下肢运动电位波幅未恢复
5. 讨论
颈动脉内膜剥脱术即手术切除增厚的颈动脉内膜粥样硬化斑块,是预防颈动脉斑块脱落引起脑卒中的一种重要方法,自1951年Spence首次手术成功以来,经过多年大量手术病例总结,颈动脉内膜剥脱术已被证明是防治缺血性脑血管疾病的有效方法 [12] 。近年来,血管介入材料的不断更新,血管内介入治疗颈动脉粥样硬化性狭窄发展很快,但颈动脉内膜剥脱手术仍然是治疗颈动脉狭窄一种安全的、有效的方法。而且手术切除治疗的往往是颈动脉狭窄严重或接近闭塞、钙化严重、斑块破溃严重的患者,这就要求神经外科医师必须掌握一些先进的术中监测技术及围手术期的策略,保证手术的安全和高效。术中颈动脉的暴露、临时阻断、斑块的剥离、修剪内膜和开放颈动脉等手术操作,都有可能导致颈动脉周围颅神经损伤、大脑组织血流灌注不足、脑血管痉挛、斑块脱落引起脑缺血性损害和神经功能障碍。为保证术中颅神经和脑组织功能完整性,避免手术操作导致的不可逆性损伤,采用安全、高效、实时的术中神经电生理监测技术显得尤为重要,术中电生理监测在颈动脉内膜剥脱术手术中具有很高的临床价值 [13] 。
术中神经电生理监测不仅可以及时、准确地监测到异常的颅神经和脑组织功能,还能评估脑血管的侧支代偿能力,进一步提高了术后患者的预后。目前术中神经电生理监测技术逐渐在神经外科手术中广泛使用。最早用于术中神经电生理监测的指标是SEP,这种监测方式具有较高灵敏度,对脑神经功能保护有良好效果,也为术后并发症预测提供了可靠的数据支持 [14] 。MEP可以推断运动功能皮质到肌肉传导通路的完整性,但易受患者体位、血压、体温、麻醉等因素的影响,术中监测时会出现假阳性问题 [15] 。有研究发现,单独MEP监测时灵敏度为83.0%,联合EEP和MEP监测时灵敏度则会提升至90.0% [16] 。宫达森等人研究中,单独MEP敏感性100%,特异性85.96%,单独SEP敏感性80%,特异性80.70%,SEP + MEP敏感性100%,特异性98.25%,联合监测模式特异性明显高于SEP、MEP单独监测模式 [17] 。Malhotra和Shaffrey研究发现,单一模式的SEP监测假阴性率为0.063%~2.7%,明显高于多模式监测的假阴性率(0%~0.79%) [18] 。Michael等对264例患者运用SEP + MEP方案在CEA术中研究表明,SSEP + MEP的假阳性率仅为0.4% [19] 。上文中典型病例二中出现的术中MEP消失,直至血管开放和手术结束都未能恢复至基线水平,但术后患者并无神经功能障碍遗留,除手术者操作原因外,我们有理由相信MEP有一定假阳性的可能。因此,MEP联合SEP的监测方式虽然提升了术中监测的有效性,但我们需要进一步收集分析更大的样本量来验证。
ICG荧光血管造影是一种安全、有效和实用的术中血管成像技术,目前已逐渐成为神经外科手术中常用的血流评价手段 [11] 。术中不仅可以为术者明确斑块的确切位置,而且也可以明确颈内动脉内血流通畅情况、避免斑块残余和预防脑缺血或过度灌注作用。本文中典型病例第二例术中吻合血管后解除阻断造影显示颈外动脉显影欠佳,提示术者术中开放血管过程中可能有斑块脱落造成颈外动脉闭塞,但术后未出现缺血性脑卒中,这也暴露出术中ICG荧光造影的局限性,无法让术者了解开放后颈内动脉和颈外动脉远端血管的通畅性,但是术中运用神经电生理监测技术恰恰在一定程度上弥补了这一点,两者联合下更加提高了手术的安全性。
本研究组中,回顾性分析的93例103侧颈动脉粥样硬化性狭窄的临床资料,采用经典式或者翻转式CEA,术中均未使用转流、补片,有研究表明,所有患者常规使用转流会增加栓子脱落栓塞事件导致围手术期卒中的风险 [20] ,在我们的经验中,大多数对侧狭窄患者能够耐受颈动脉阻断而不发生神经功能的改变,在本研究组中也相应证实了这一点,术后患者无一例遗留永久性神经功能障碍。
6. 结论
综上所述,运用CEA治疗颈动脉粥样硬化性狭窄是一种效果显著、安全性高的方法,术中运用神经电生理监测、蔡司P900显微镜下IGG造影和FLOW 800分析提高了手术的安全性,降低了术后并发症的发生率,改善了患者的预后,而且也在一定程度上证实了颈动脉内膜剥脱术治疗颈动脉粥样硬化性狭窄的安全和有效。