摘要: 目的:探讨槲皮素(Quercetin, QU)联合索拉非尼(Solafenib)对索拉非尼耐药Hela细胞的作用及其机制。方法:MTT法测定不同浓度索拉非尼(0, 2.5, 5.0, 7.5, 10.0, 15.0, 20.0 µmol/L)对细胞的增殖的影响;细胞划痕实验检测各组细胞的迁移水平;PCR实验检测各组凋亡基因Bax、Bcl-2及自噬基因LC3-B、Beclin-1的表达水平;Western-blot (WB)检测细胞凋亡相关蛋白caspase-3的相对表达量。结果:随着药物浓度的增加,耐药细胞和亲本细胞的抑制率逐渐升高,且对亲本细胞的抑制率明显高于耐药细胞。联合用药组抑制耐药细胞的迁移率,并且联合用药组的Bax和LC3-B基因相对表达量降低,Bcl-2、Beclin-1基因相对表达量、Bax/Bcl-2的值以及caspase-3蛋白相对表达量升高,与空白对照组和索拉非尼组相比,联合用药组细胞凋亡显著升高。结论:槲皮素与索拉非尼联合用药是通过上调Bcl-2、Beclin-1、Bax/Bcl-2基因相对表达量、下调Bax、LC3-B基因相对表达量同时上调caspase-3蛋白相对表达量的途径,抑制耐药细胞的迁移率、促进耐药细胞凋亡、抑制细胞自噬,从而起到逆转耐索拉非尼Hela细胞耐药性的作用。
Abstract:
Objective: To investigate the effect and mechanism of quercetin and sorafenib on soraf-enib-resistant Hela cells. Methods: The effects of sorafenib at different concentrations (0, 2.5, 5.0, 7.5, 10.0, 15.0, 20.0 µmol/L) were measured on cell proliferation by cell nicking assay; the expres-sion levels of apoptotic genes Bax, Bcl-2 and autophagy genes LC3-B, Beclin-1 by PCR; and the rela-tive expression of apoptosis related protein caspase-3 by Western-blot (WB). Results: With the in-crease of the drug concentration, the inhibition rate of the resistant cells and the parent cells was significantly higher than that of the resistant cells. The combination group inhibited the migration rate of resistant cells, and the relative expression of Bax and LC3-B genes, the relative expression of Bcl-2 and Beclin-1 genes, values of Bax/Bcl-2 and caspase-3 protein was increased and significantly increased apoptosis in the combination group compared with the blank control group and sorafenib group. Conclusion: The combination of quercetin and sorafenib regulates the relative expression of Bcl-2, Beclin-1, Bax/Bcl-2 genes, the down-regulation of the relative expression rate of caspase-3 protein, inhibits the mobility of resistant cells, promotes the apoptosis and autophagy, so as to re-verse the drug resistance of sorafenib-resistant Hela cells.
1. 引言
宫颈癌是危害女性身体健康的重要疾病之一,在全球妇女癌症中发病率位于第四位 [1] 。宫颈癌治疗以手术及放化疗为主,但化疗药物的肝肾毒性及耐药等问题,使其临床应用受到了一定限制 [2] 。对于复发性、转移性、难治性宫颈癌患者,化疗是常用的姑息治疗手段,化学疗法已被广泛应用于宫颈癌的临床治疗,因此化疗在宫颈癌的治疗中越来越重要,然而随着肿瘤化疗耐药性的产生,耐药已经成为导致化疗失败、疾病复发的主要原因 [3] [4] 。
关于槲皮素(Quercetin, QU)用于逆转和抗肿瘤的研究有很多。文献数据表明,近十年来专家围绕槲皮素在抗癌方面的作用、作用机制和制剂做了大量研究;槲皮素作为黄酮醇类黄酮亚类的主要代表,它具有多重生物活性,如抗氧化、抗病毒、抗炎作用 [5] 。本研究以耐索拉非尼(Solafenib) Hela细胞为研究对象,研究槲皮素、索拉非尼以及联合用药对耐药株的增殖影响以及凋亡和自噬的变化,最终探讨不同作用药物对耐药细胞的调控机制。槲皮素具有广泛的生物学和药物学功效 [6] ,其作为一种生物类黄酮,具有抗炎、抗癌、抗氧化等特性 [7] ,具有抑制细胞凋亡的药理活性 [8] 。在抗癌作用方面,有文章报道槲皮素通过调节PI3K/Akt/mTOR促进细胞活力丧失、细胞凋亡和自噬的能力 [9] 。
2. 材料与方法
2.1. 材料
2.1.1. 细胞
亲本Hela细胞,耐索拉非尼Hela细胞,来自于新乡医学院三全学院生育力保存重点实验室。
2.1.2. 试剂
试剂:RNA Extraction Kit、BCA蛋白浓度测定试剂盒、Active Caspase 3 Mouse mAB、GAPDH Ab、胎牛血清、RPMI Medium 1640、Trypsin-EDTA Solution (批号依次为:9767、BL521A、EM1188、AF7021、10099133、31800-500、BL501;生产家依次为:Takara Bio、Biosharp、ELK Biotechnology、Thermo Fisher Scientific、索莱宝、Biosharp)。
2.1.3. 仪器
自动细胞计数仪(型号:IC1000),睿钰生物;梯度式热循环仪(型号:Labcycler),SensoQuest;电泳仪(型号:DYY-8C),北京六一;落地冷冻高速离心机(型号:75004250),Thermo Fisher Scientific;二氧化碳培养箱(型号:HERACELL150i),Thermo Fisher Scientific;生物安全柜(型号:1384),Thermo Fisher Scientific;倒置荧光显微镜(型号:IX73P2F),Olympus。
2.2. 方法
2.2.1. 细胞培养及分组
将细胞从液氮罐中取出,讯速地放入37℃水浴锅中解冻。解冻后,将细胞吸取到15 mL离心管中,生理盐水冲洗2~3次,1000 rpm离心5 min。再拿入超净工作台,弃去上清,并向离心管中加入1 mL培养液,缓慢吹打,形成细胞悬液。加入5~6 mL完全培养液并转移至T25细胞培养瓶中,在37℃、5% CO2的培养箱中培养。每2~3 d将旧培养液吸出,加入生理盐水,轻缓晃动瓶体并将生理盐水吸出,重复2~3次。吸取经过37℃水浴后0.25%的胰蛋白酶2 mL到培养瓶中,使贴壁细胞缩小变圆便于从培养瓶上脱落,加入等体积的培养液终止消化。将其吸取到15 mL离心管中,用生理盐水冲洗2~3次,1000 rpm离心5 min。弃去上清,并向离心管中加入1 mL培养液,缓慢吹打,形成细胞悬液并以1:3的比例进行传代培养。空白对照组(Control)使用RPMI 1640完全培养基,索拉非尼组(Solafenib)含终浓度17 µmol/L索拉非尼进行培养,槲皮素组(Quercetin)含终浓度5 µmol/L QU进行培养,联合用药组(Combined)含终浓度17 µmol/L索拉非尼和5 µmol/L QU进行培养。依照此分组用于后续实验。
2.2.2. MTT实验检测细胞增殖
将3 × 104 cells/mL呈对数生长期的Hela细胞和耐索拉非尼Hela细胞的细胞悬液以100 µL/孔加入到96孔板中。培养12 h后,分成7组,各组更换为含索拉非尼浓度分别为0、2.5、5.0、7.5、10.0、15.0、20.0 µmol/L的培养液,各组设立6个重复;放入培养箱中培养24 h。吸出原液,每孔加入10 µL浓度为5 mg/mL的MTT溶液;孵育4 h后。清除孔中的溶液,加入150 µL/孔的DMSO溶液;空白对照组只添加150 µL的DMSO,充分震荡10 min,在570 nm条件下检测吸光值(OD);计算细胞抑制率。
2.2.3. 细胞划痕实验检测各组细胞迁移率
将对数生长期的耐药细胞以2.0 × 105个/孔的细胞量接种于6孔板中,用完全培养基培养细胞直至细胞生长至每个孔95%以上,用10 µL的枪头垂直于6孔板并沿着灭过菌的直尺进行划线。细胞划线后用生理盐水对每个孔轻轻洗涤3次。洗涤完成后进行拍照记录。按照上述分组更换为含有不同药物的培养基,放入培养箱中进行培养,24 h和48 h后拍照。使用Imang J软件对细胞划痕的面积进行分析,计算求得细胞迁移率。
。
2.2.4. 总RNA的提取和PCR检测
TRIzoL法提取细胞的总RNA,将样品进行逆转录反应,以逆转录得到的CDNA为模板用PCR试剂盒说明书进行实验,以GAPDH为内参。取10 µL Taq mix (Taq + dNPT)、6 µL H2O、1 µL Forward Primer、1 µL Reverse Primer、2 µL。
Sample混合为20 µL总体系,放入PCR仪,设定程序,PCR扩增结束,进行电泳,对电泳图进行灰度值分析,进而分析实验结果。
2.2.5. Western Bloting检测蛋白表达
Hela细胞中加适量细胞裂解液,冰上裂解30 min;于4℃下12,000 rpm离心5 min,保留上清,使用BCA蛋白定量试剂盒测定样品蛋白浓度并进行定量。取20 µL样品进行SDS-PAGE电泳分离,设置90 V电泳30 min,达到分离胶后调整电压为120 V,待其达到末端停止电泳。使用电泳槽湿转1 h,将样品转移至PVDF膜,再用5%脱脂奶粉在37℃孵箱中封闭0.5 h。取出膜,进行一抗孵育,放置于4℃冰箱过夜。之后用HPR二抗,在室温状态下孵育1 h,最后在凝胶成像系统中进行曝光,进行灰度分析。
2.2.6. 统计学分析
实验数据采用SPSS 22.0软件和GraphPad Prism 8.0进行统计分析以及作图。数据以均数 ± 标准差(
)表示,对处理后的数据进行方差计算,P < 0.05为显著差异。
3. 结果
3.1. 不同浓度索拉非尼对亲本细胞和耐药细胞的抑制率
MTT检测结果显示,索拉非尼对Hela细胞增殖有抑制作用,且呈浓度依赖性,结果如图1所示,当处理24 h后,索拉非尼对亲本细胞的抑制作用比耐药细胞的抑制作用更高。
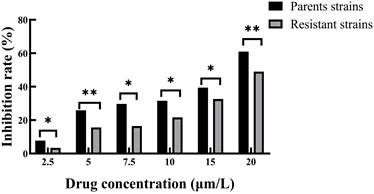 注:vs亲本细胞,*P < 0.05,**P < 0.01 (Parents strains:亲本细胞;Resistant strains:耐药细胞)。
注:vs亲本细胞,*P < 0.05,**P < 0.01 (Parents strains:亲本细胞;Resistant strains:耐药细胞)。
Figure 1. Inhibition rate of parental and resistant cells for 24 h after treatment with different concentrations of sorafenib
图1. 不同浓度索拉非尼对亲本细胞和耐药细胞处理24 h后的抑制率
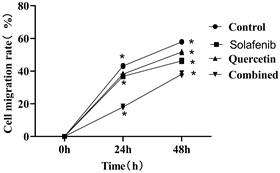
3.2. 各组细胞迁移率比较
在划痕愈合实验中,结果如图2(a)、图2(b)所示,索拉菲尼组、槲皮素组和联合用药组Hela细胞迁移率与空白对照组迁移率相比,差别有统计学意义(P < 0.05),表明索拉菲尼,槲皮素和联合用药均具有抑制Hela细胞迁移的能力。

 (a)(b)注:vs空白对照,*P < 0.05。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组)。
(a)(b)注:vs空白对照,*P < 0.05。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组)。
Figure 2. Cell migration in different dosing groups (40×)
图2. 不同加药组的细胞迁移情况(40×)
3.3. 各组细胞凋亡情况的比较
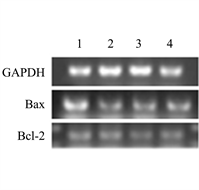
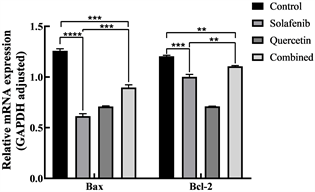 (a)(b)
(a)(b) (c)注:图(a)为PCR产物电泳图;图(b)为各组细胞中Bax、Bcl-2基因表达量;图(c)为各组细胞中Bax/Bcl-2值。vs空白对照组,**P < 0.01,***P < 0.001,****P < 0.0001;vs索拉非尼组,**P < 0.01,***P < 0.001。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组;图(c):vs空白对照组,ns无显著性差异)。
(c)注:图(a)为PCR产物电泳图;图(b)为各组细胞中Bax、Bcl-2基因表达量;图(c)为各组细胞中Bax/Bcl-2值。vs空白对照组,**P < 0.01,***P < 0.001,****P < 0.0001;vs索拉非尼组,**P < 0.01,***P < 0.001。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组;图(c):vs空白对照组,ns无显著性差异)。
Figure 3. Expression of Bax and Bcl-2 genes in cells of each group
图3. 各组细胞中Bax、Bcl-2基因表达量
索拉非尼组、槲皮素组、联合用药组和空白对照组细胞内GAPDH、Bax、Bcl-2表达产物的电泳结果图,见图3(a)。索拉非尼组、槲皮素组、联合用药组和空白对照组各组细胞中GAPDH、Bax及Bcl-2表达比较,索拉非尼组、槲皮素组、联合用药组细胞的促凋亡基因Bax、抑凋亡基因Bcl-2的相对表达含量均小于空白对照组。联合用药组细胞的促凋亡基因Bax、抑凋亡基因Bcl-2的相对表达含量大于索拉非尼组、槲皮素组(P < 0.05),见图3(b)。索拉非尼组,槲皮素组,联合用药组Bax/Bcl-2的值与空白对照组相比均显著降低,联合用药组Bax/Bcl-2的值显著高于索拉非尼组低于槲皮素组(P < 0.05),见图3(c)。
索拉非尼组、联合用药组细胞的caspase-3蛋白的相对表达含量低于空白对照组,槲皮素组细胞的caspase-3蛋白的相对表达含量高于空白对照组,槲皮素组细胞的caspase-3蛋白的相对表达含量高于索拉非尼组、联合用药组(P < 0.05),见图4。实验结果说明,索拉非尼和槲皮素联合用药可以促进耐药细胞发生凋亡,单独使用槲皮素存进耐药细胞凋亡作用更明显。

 (a) (b)注:vs空白对照组,**P < 0.01,***P < 0.001,****P < 0.0001,ns无显著性差异;vs索拉非尼组,***P < 0.001。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组)。
(a) (b)注:vs空白对照组,**P < 0.01,***P < 0.001,****P < 0.0001,ns无显著性差异;vs索拉非尼组,***P < 0.001。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组)。
Figure 4. The caspase-3 protein expression in the cells of each group
图4. 各组细胞中caspase-3蛋白表达量
3.4. 各组细胞自噬情况的比较
 (a) (b)
(a) (b) (c)注:图(a)为PCR产物电泳图;图(b)、(c)为各组细胞中LC3-B、Beclin-1基因表达量。vs空白对照组,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001;vs槲皮素组,***P < 0.001。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组;图(c):vs槲皮素组,ns无显著性差异)。
(c)注:图(a)为PCR产物电泳图;图(b)、(c)为各组细胞中LC3-B、Beclin-1基因表达量。vs空白对照组,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001;vs槲皮素组,***P < 0.001。(图(a):1空白对照组;2索拉非尼组;3槲皮素组;4联合用药组;图(b):control空白对照组;solafenib索拉非尼组;Quercetin槲皮素组;Combined联合用药组;图(c):vs槲皮素组,ns无显著性差异)。
Figure 5. LC3-B and Beclin-1 gene expression in cells of each group
图5. 各组细胞中LC3-B、Beclin-1基因表达量
索拉非尼组、槲皮素组、联合用药组和空白对照组细胞内GAPDH、LC3-B、Beclin-1表达产物的电泳结果图,见图5(a)。索拉非尼组、槲皮素组、联合用药组和空白对照组各组细胞中LC3-B及Beclin-1表达比较,索拉非尼组、槲皮素组、联合用药组细胞的自噬标记基因LC3-B的相对表达含量均低于空白对照组。联合用药组细胞的自噬相关基因Beclin-1的相对表达含量大于索拉非尼组、槲皮素组(P < 0.05),见图5(b)、见图5(c)。实验结果说明,与索拉菲尼组相比,联合用药对耐药细胞的自噬作用有一定降低。其中与Bcl-2相互结合的Beclin-1自噬相关基因有明显变化,Beclin-1与Bcl-2结合增加时,会抑制细胞自噬。因此联合用药通过降低细胞自噬途径逆转细胞的耐药性。
4. 讨论
我国癌症中心最新报告指出,宫颈癌位居中国恶性肿瘤发病率的第八位,且在女性恶性肿瘤中的发病率仅次于乳腺癌,位居第二 [10] 。宫颈癌是发生在子宫阴道部及宫颈管的恶性肿瘤,多产生于子宫颈黏膜上皮层内,后侵入黏膜下间质,逐步进展为肿瘤侵入阴道及生殖器官 [11] 。宫颈癌患者在由于长期依赖性用药,从而对药物产生耐受,在治疗过程中大大降低了治疗效果,这些患者的疗效不明显并且花费较高,治疗后恢复的概率也低,最终降低肿瘤化疗的效果。因此,采用有效方法预防和治疗抗肿瘤药物的不良反应具有重要的临床意义 [12] [13] 。
有研究发现,槲皮素是具有多种生物活性的天然抗氧化剂,是一种来源广泛的天然黄酮类化合物,因其酚类化学结构而表现出诸多生物学功能 [14] ,可调节众多与疾病进展有关的细胞内、外信号通路 [15] 。人们日常可食用的蔬菜、水果中广泛存在槲皮素,其作为膳食中的一种抗氧化剂而受到人们的普遍重视 [16] 。有研究显示,槲皮素联合顺铂处理能降低增殖能力、克隆形成能力、迁移能力及PI3K、Akt、Survivin、MMP-2 mRNA和蛋白表达,并呈剂量依赖性 [17] 。近年来,中药单体槲皮素在抑制多种肿瘤细胞的生长和转移等方面具有较显著的作用,受到越来越多的重视 [18] 。在人类的正常健康状态下,人体内的细胞稳态受到细胞自噬积极调控。但如果由于某些外界或内部因素细胞发生过度自噬,细胞自噬后的分解的营养物质会向癌细胞提供进一步促进肿瘤的发展 [19] 。Wei等研究发现,细胞自噬与肝癌索拉非尼耐药性有关,抑制细胞自噬可以减低肿瘤细胞对索拉非尼耐药的概率 [20] 。索拉菲尼可以抑制癌肿瘤的生长和诱导癌细胞发生凋亡 [21] 。维持细胞的正常活动与细胞自噬抑制细胞凋亡有所联系,它也可以通过与细胞凋亡相互作用或单独作用使细胞死亡。研究表示,肿瘤耐药细胞可以通过调控肿瘤微环境诱导细胞缓慢增殖,肿瘤微环境对肿瘤发生发展具有关键作用,可以影响肿瘤行为和药物敏感性 [22] [23] 。癌细胞迁移同样也是癌细胞耐药所造成的严重后果,相同条件下耐药的癌细胞发生迁移及侵袭的概率是非耐药细胞的5~8倍 [24] 。Chen等首次发现QU可以通过调节FZD7/β-catenin信号通路逆转HepG2的耐药性 [25] ,此外,研究发现QU可以通过抑制ATP驱动ABCB1的转运活性从而达到逆转耐药性的目的 [26] 。综上所述,QU与索拉非尼联合用药逆转耐索拉非尼Hela的耐药性是通过诱导细胞凋亡,抑制细胞自噬和细胞迁移率产生作用,但QU对耐药细胞具体是通过调节哪些通路完成的尚不清楚,其分子作用机制仍需进一步研究。
5. 结论
本研究结果显示,1) 诱导耐药细胞的细胞抑制率低于亲本细胞,耐药细胞具有耐药性。2) 槲皮素和索拉非尼联合用药通过上调Beclin-1基因相对表达量、Bax/Bcl-2的值以及caspase-3蛋白的相对表达量,下调Bax、Bcl-2、LC3-B基因的相对表达量,促进耐药株细胞凋亡、抑制耐药株细胞自噬和细胞迁移率,从而逆转耐药株的耐药性。但是caspase-3蛋白的表达在槲皮素单药处理组降低更为显著,该现象产生的原因有待进一步的研究。
基金项目
河南省科技攻关项目(232102310065,232102310303);新乡医学院三全学院学术技术带头人培养计划(SQ2023XSJSDTR01);新乡医学院三全学院骨干教师培养计划(SQ2023GGJS06)。
NOTES
*通讯作者。