1. 正文
肾细胞癌(RCC)是泌尿系统最常见的恶性肿瘤之一。在肾细胞癌早期,无明显症状,由于缺乏明确的诊断标准,约20%~30%的患者在第一次就诊时可能发生远处转移 [1] 。到目前为止,已发现有两种主要类型的因子参与了肾细胞癌的转移:一种是可促进转移的肿瘤血管生成因子,如MMPs和CD44,另一种是肿瘤抑制因子,如VHL和PTEN。然而,其确切的机制仍有待进一步研究。因此,探索新的特异性有效因素以及预测转移性肾细胞癌的治疗靶点至关重要。
据既往报道,MMP-9和CD44在RCC中的表达水平也较高。已有研究表明,在Ras-MEK-ERK信号通路的刺激下,MMP-9可以与CD44-ICD结合,进行进一步的调控 [2] 。我们用组织切片通过免疫组化研究了人正常肾组织和肾细胞癌肿瘤组织中CD44和MMP-9蛋白的表达,发现CD44和MMP-9蛋白在肾细胞癌组织中表达强烈。这表明CD44和MMP-9可能在肾细胞癌的发生发展中起致癌作用。为了验证这一假设,我们评估了CD44和MMP-9在RCC组织中的表达,分析了CD44和MMP-9的表达与RCC患者的临床病理特征之间的关系。
循环肿瘤细胞(CTC)检测是一种新的液体活检分析方法,是一种无创、准确、有效的方法,在预测肿瘤患者的预后、转移和临床药物治疗方面起着至关重要的作用 [3] 。CTC与疾病预后明确相关,即CTC检测结果阳性的患者通常预后较差本研究旨在探讨肾细胞癌中MMP-9和CD44蛋白在肾细胞癌中表达的关系,以及与临床特征和CTC的相关性,以期为肾细胞癌的早期诊断、治疗和预测预后探索新的途径。
2. 材料和方法
2.1. 患者信息
西京医院病理档案中共发现2017年3月至2019年10月连续104例透明细胞肾CC患者,未发现复发转移。104例肾CC患者,男性88例,女性16例,平均年龄54.2岁(19~80岁)。所有患者均经病理检查诊断为肾细胞癌,未见肾或肾外复发转移。根据WHO/ISUP核仁分级 [4] ,82例划分为低级别(1~2级),22例为高级别(3~4级)。肾细胞癌组织取自患者,用于标本的制备。以西京医院住院肾炎患者的非癌性肾组织作为对照。患者分别为男7例,女3例,年龄34~67岁,平均年龄53岁。
2.2. 细胞系
人肾细胞癌细胞系ACHN来自实验动物饲养中心(中国西安空军军医大学),在RPMI 1640 (HyClone,Thermo,美国)与10%胎牛血清(胎牛血清;吉布科,卡尔斯巴德,美国)和5% CO2在37℃。
2.3. 免疫组化染色
免疫组化染色:切片在柠檬酸缓冲液(pH = 6.0)中微波加热提取抗原。针对人CD44的特异性抗体(1:100稀释;CST,美国)和MMP-9蛋白(1:200稀释;CST,美国)按照制造商说明书进行稀释。免疫染色的程度由两名独立的观察员进行回顾和评分。肾细胞癌的连续切片与PBS和小鼠IgG1 (Santa Cruz生物技术)作为空白和阴性对照平行运行。每个样本的阳性染色均显示为棕色。MMP-9在细胞质中表达,而CD44在细胞膜上表达。根据文献对染色结果进行半定量分析 [5] 。阳性细胞百分比为0~100%,染色强度从弱到强:0,无染色;1,浅棕色;2,棕色;3,深棕色。将阳性细胞的百分比和染色强度评分相乘。随机选取3个视野。最后,得到一个从0到300分的分数。≥100分的肿瘤样本被认为是阳性。
2.4. CTC
肾细胞癌患者采用静脉穿刺采集5 mL外周血标本,用直径为8 μm的孔隙校准膜过滤。所需的过滤系统包括包含膜的过滤管、带有阀设置的歧管真空板、E-Z 96真空歧管和真空泵。用红细胞溶解缓冲液在去离子水中去除红细胞。剩余的细胞悬浮5分钟,然后用含有4%甲醛的磷酸盐缓冲盐水(pbs)过滤。将电池悬架转移到过滤管后,泵阀被打开和关闭至少0.08 mpa,然后通过开关歧管真空板阀进行过滤 [6] 。
2.5. 多重RNA原位杂交(RNA-ISH)检测
建立三组核酸探针,通过多重RNA-ISH检测CTC中上皮基因和间充质基因的表达。第一组包括4个上皮生物标志物特异性捕获探针EpCAM和细胞角蛋白(cks) 8/18/19。第二组由两个间充质生物标志物特异性捕获探针波形蛋白和扭曲组成。最后一组仅包含白细胞生物标志物CD45的捕获探针(表1)。简单地说,保留在滤膜上的细胞在杂交前用蛋白酶处理。然后,用上述不同的捕获探针进行了一系列的杂交反应。最后,细胞用4,6-二氨基-2-苯甲酰脲(DAPI)染色。样品采用100个油透镜(奥林巴斯BX53;奥林巴斯,东京,日本)。细胞中观察到的荧光信号的红色和绿色点分别代表上皮和间充质基因的表达,紫色荧光点代表CD45基因(白细胞标记物)的表达 [7] [8] 。

Table 1. Multiplex RNA-in situ hybridization (RNA-ISH) assay
表1. 多重RNA原位杂交(RNA-ISH)检测
2.6. 统计分析
采用卡方检验评估CD44、MMP-9的表达与RCC患者的临床病理特征之间的相关性,并评估CTC结果与患者预后之间的相关性。所有测试均使用社会科学统计程序(SPSS)软件(13.0版,SPSS Inc.,芝加哥,IL,USA)双面进行。P-values < 0.05被认为是显著性的。
3. 结果
3.1. CD44和MMP-9在肾细胞癌和正常组织中的表达
CD44在肾细胞癌组织中的阳性表达率为65.4% (68/104),而MMP-9的比例为69.2% (72/104)。在正常肾脏组织中几乎没有发现CD44或MMP-9的表达。见图1。

Figure 1. The expressions of CD44 and MMP-9 in human RCC tissues and normal kidney tissues. ((a), (c)) CD44 and MMP-9 are overexpression in human RCC tissues, ×400; ((b), (d)) CD44 and MMP-9 are weakly expression in normal kidney tissues, ×400
图1. CD44和MMP-9在RCC和正常肾组织在中的表达。((a), (c)) CD44和MMP-9在RCC中高表达,×400;((b), (d)) CD44和MMP-9在正常肾组织在中低表达,×400
3.2. CD44、MMP-9蛋白的表达及与临床特征的相关性
不同性别和年龄的MMP-9与CD44和RCC患者的表达差异无统计学意义(P > 0.05)。而卡方检验显示CD44和MMP-9在较高的Fuhrman分级中过表达(P < 0.05) (表2)。

Table 2. Comparison of CD44 and MMP-9 expression among RCC patients with different clinicopathological features
表2. 具有不同临床病理特征的肾细胞癌患者CD44和MMP-9表达的比较
3.3. CTC的分类
根据EMT标记物,将CTC分为三个亚群:上皮细胞(E+)、双表型(E+/M+)和间充质细胞(M+),如图2所示,85例CTC检测为CTC阳性(>3 CTC/5 mL血液) [9] 。这三个CTC亚群在癌症患者中占优势(81.7%),而在对照组中较为罕见(10%, P < 0.05)。
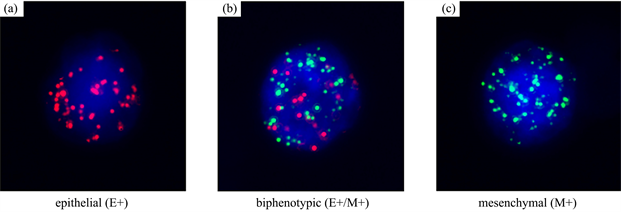
Figure 2. Representative fluorescence images show RNA in situ hybridization of epithelial-type (E+), biphenotypic (E+/M+) and mesenchymal-type (M+) CTCs. (a) E+ CTCs; (b) E+/M+ CTCs; (c) M+ CTCs
图2. 上皮型(E+)、双表型(E+/M+)和间充质型(M+) CTC的RNA原位杂交荧光图像。(a) E+ CTCs;(b) E+/M+ CTCs;(c) M+ CTCs
3.4. CTC与CD44、MMP-9表达的关系
根据对104例患者的分析,CTC为0~75/5 mL,中位数为14/5 mL。在CTC阳性患者中,MMP-9在RCC中的阳性表达率为74.1% (63/85),CD44的阳性表达率为70.5% (60/85)。在CTC阴性的患者中,MMP-9在RCC中的阳性表达率为47.4% (9/19),CD44的阳性表达率为42.1% (8/18)。MMP-9和CD44的阳性表达率均高于CTC阴性患者(P < 0.05)。结果显示,MMP-9在E+、M+和E+/M+ CTC患者中的阳性表达率分别为57.6% (19/33)、78.6% (22/28)和91.7% (22/24),CD44的阳性表达率分别为55.9% (19/34)、75.0% (21/28)和87.0% (20/23)。MMP-9和CD44在RCC和M+ CTC患者中的阳性表达率高于其他两种CTC类型的患者(P < 0.05,表3)。

Table 3. Relationship of epithelial-type (E+), biphenotypic (E+/M+) and mesenchymal-type (M+) CTC to CD44 and MMP-9
表3. 上皮型(E+)、双表型(E+/M+)和间充质型(M+) CTC与CD44和MMP-9的关系
3.5. CD44和MMP-9的过表达可能预示着RCC患者的不良预后
有42例患者接受了生存随访。其中CD44阳性31例,MMP-9阳性34例。log-rank检验显示,cd44阳性患者的生存率明显低于阴性患者(P = 0.006,表4),MMP-9的生存率也较差(P = 0.025,表4)。同样,WHO/ISUP核仁分级与较差的生存率相关(P = 0.027,表4)。不同性别、年龄间差异无统计学意义(P > 0.05,表4)。多因素分析显示,CD44 (HR: 0.203, P = 0.013)、MMP-9 (HR: 0.268, P = 0.027)、WHO/ISUP分级(HR: 2.478, P = 0.035)是生存的独立预后指标(表4)。

Table 4. Univariate and multivariate analysis of 42 RCC cases with follow-up information
表4. 42例肾细胞癌预后的单因素及多因素分析
4. 讨论
肾细胞癌是泌尿系统最常见的恶性肿瘤之一,早期难以诊断。我们探索了MMP-9和CD44的综合表达分析以及与CTC检测的相关性。MMP反复涉及转移,这是侵袭后的一个连续步骤,由于其在转移和血管生成中的多功能作用,已在恶性肿瘤中得到了广泛的研究 [10] 。原癌基因的激活可能导致MMP-9转录本的积累,在肿瘤发生的早期阶段介导细胞外基质和基底膜的降解 [11] 。成熟和激活的MMP-9可以帮助形成一个促进肿瘤生长和转移的微环境 [12] 。CD44与配体的相互作用可能诱导细胞吸收和降解透明质酸,从而促进细胞的迁移。MMP-9可与CD44胞外结构域结合。这种组合允许MMP-9的分裂和激活,导致CD44胞内结构域(CD44ICD)的释放 [13] 。MMP-9还可以通过CD44增强肌动蛋白和p-MLC2水平的收缩性。这一现象增加了p-STAT3的水平,导致MMP-9的高表达和分泌,并形成一个正反馈回路,以维持肿瘤细胞的侵袭和转移 [14] 。
在本研究中,MMP-9和CD44在肾细胞癌中的阳性表达率高于正常肾组织,并与较高的WHO/ISUP分级相关,提示这两种分子的表达可能与肾细胞癌生存率差相关,肾细胞癌转移频率高。
上皮–间充质转化(EMT)是癌症进展的一个关键过程,涉及上皮标志物如上皮细胞粘附分子(EpCAM)和细胞角蛋白) (CKs)的下调,以及肿瘤细胞中间充质标志物如波形蛋白和TWIST1的上调 [15] 。CTC对肿瘤转移的影响越来越受到人们的关注,目前的医生已经使用CTC检测来诊断乳腺癌、前列腺癌、肾癌、肺癌等疾病 [16] [17] 。CTC检测甚至可在影像学检查之前用于早期检测肿瘤。此外,CTC检测被广泛用于评估肿瘤患者的预后:CTC阳性结果往往提示预后较差 [18] 。然而,并非所有恶性肿瘤患者均未检测到CTC。既往研究报道,不同肿瘤对CTC的检出率有所不同。它最容易在肺癌中被发现,其次是乳腺癌、结肠癌和宫颈癌 [17] 。目前报道的肾癌中CTC的检出率与本研究的结果相似。许多研究表明,EMT在肾癌的循环肿瘤细胞(CTC)亚群中存在 [19] 。间充质CTC与患者预后不良相关,转移和对化疗的耐药性 [20] 。这些研究提示CTC在肾癌中具有潜在的预后价值。然而,这些研究存在一些局限性:缺乏明确的标记来识别EMT表型CTC的亚群,缺乏CTC检测技术的临床验证,样本量有限。因此,在一个大队列的肾癌患者中,使用一组明确的EMT标记物和一种临床可行的CTC检测技术来全面分析CTC亚群是必要的。
CTC在肿瘤转移过程中可能经历上皮–间充质转化。不同类型的CTC提示不同的预后。E+ CTC患者的预后优于混合和M+ CTC患者 [21] 。此外,间充质型CTC患者往往预后最差。本研究中,M+ CTC患者RCC中MMP-9和CD44的阳性表达率高于其他两种CTC患者。因此,这种类型的CTC可能会增强肿瘤的侵袭和转移。这一结果可能与M+ CTC患者复杂的肿瘤微环境有关。
评估肿瘤患者的预后是一个复杂的过程。原发肿瘤是否有早期远处转移是其关键因素之一。CTC是血液中发现的一种肿瘤细胞,CTC阳性表示血液中肿瘤细胞数量增加,提示肿瘤侵袭的可能性较高。在本研究中,CTC阳性的RCC患者中MMP-9和CD44的阳性表达率高于CTC阴性的患者。这可能是由于MMP-9和CD44是肾细胞癌的关键调控分子,这些分子表达的表达增加表明该通路的持续激活,从而促进癌细胞的侵袭和转移,增加血液中肿瘤细胞的数量。特别是CD44,作为该通路的下游调控分子,可以帮助癌细胞在癌症转移过程中靶向该器官。癌细胞表面的CD44分子与内皮细胞一起工作,导致在到达靶器官时血液内的细胞循环终止。CD44的变异蛋白通过影响细胞的骨骼和信号传递系统,改变细胞的生物学行为,促进细胞的侵袭转移。
5. 结论
综上所述,MMP-9和CD44在肾细胞癌中过表达,其表达与肾细胞癌的病理特征和CTC检测结果相关。这些分子的高表达表明预后不良。CD44和MMP-9都可能被认为是促进肾癌转移的基因。然而,具体的潜在机制还需要通过分子实验来进一步研究。
NOTES
*共第一作者。
#通讯作者。