1. 前言
中风是全世界死亡和发病的主要原因之一。自发性(非创伤性)脑出血(sICH)是中风的主要原因,占所有中风类型的10%,给个体及家庭带来了灾难性的破坏 [1] [2] 。患者在住院期间,血肿进一步扩大或水肿的发展均可导致自发性脑出血患者的病情迅速发生改变,严重时导致呼吸系统和循环系统的损害 [3] [4] 。由于脑出血患者意识障碍可能出现舌后坠相关气道狭窄、咳嗽反射抑制、吞咽困难 [5] [6] 。据统计40%脑出血患者住院期间出现无症状误吸等相关呼吸道异常情况在临床中常被忽视 [7] ,进而引发卒中相关坠积性肺炎和分泌物潴留,增加气道阻力 [8] [9] [10] 。上述多种原因使得对自发性脑出血患者的临床管理至关重要。
识别与需要重症治疗相关的危险因素可以帮助临床医生提前分配医疗资源(如将患者分配到离护士站更近的房间,更频繁地评估患者的状态等)。同时避免潜在的病情延误或各种不必要的氧合策略(鼻导管、呼吸面罩、高流量吸氧等)。目前,已经训练了各种预后评分模型来预测患者脑出血后的生存情况,它们使用的预后因素、复杂性和易用性方面各有不同 [11] [12] 。然而还没有确切的预测卒中患者需要接受重症治疗的预后模型,为患者及其家属提供脑出血后生存情况的精准个性化评估。因此,我们训练并验证了一个预后模型,旨在识别出血患者入院时与治疗期间出现的与需要重症治疗相关的危险因素。
2. 资料与方法
2.1. 研究设计和数据来源
2.1.1. 训练队列
研究数据来自中国重庆的一个综合三级中风中心的患者队列(2019年1月~2023年1月)。患者在院期间,采用电子健康记录系统地收集数据,这些参与者一直接受随访,直到2023年7月。并经重庆医科大学附属第二医院伦理委员会批准[科研伦理第(2024)5]。
纳入标准如下:
1) 所有原发性脑出血患者均经计算机断层扫描(CT)确诊;
2) 年龄为 ≥ 18岁;
3) 脑卒中前功能残疾水平(改良Rankin量表评分 ≤ 2)。
排除标准如下:
1) 入院前已接受重症相关治疗(转入中心ICU;行气管插管;呼吸机辅助通气;镇痛镇静治疗);
2) 入院时接受急诊手术治疗。
2.1.2. 验证队列
在2021年1月至2023年1月期间,在重庆的另一个综合性三级卒中中心进行的回顾性队列研究被纳入外部验证队列。纳入和排除标准与训练队列相同。这两个中风中心隶属于同一所医科大学,具有相似的中风管理途径和治疗标准。
2.2. 中风治疗及氧气使用管理
所有患者均遵循相关的ICH指南进行标准化治疗 [13] 。进行紧急头部CT检查,我科神经外科医生评估并在与患者或其亲属讨论后决定是否进行手术。当手术不合适时,患者被转移到我们的治疗病房,一致降压目标是收缩压(SBP)为140 mmHg。标准氧气通过鼻导管或呼吸面罩提供2~6 L/min的氧气流速。经鼻高流量氧疗(HFNC)使用30~50 L/min的氧气流量,患者均没有接受无创正压通气治疗(NIPPV)。
2.3. 候选预测因素
在入院当天收集所有的候选预测因素:包括人口统计数据(年龄、性别)、出血部位(基底节、丘脑、脑叶、小脑、脑干和脑室)、病史(高血压、充血性心力衰竭、糖尿病、慢性支气管炎、慢性阻塞性肺疾病和中风病史)、生活方式(吸烟和饮酒)、生命体征(体温、心率、呼吸频率、SBP和DBP)。入院时和入院后2小时记录脉搏血氧测定得出的血氧饱和度(SpO2)及入院后24小时内的最低SpO2。体格检查(GCS评分、瞳孔直径、反射、瞳孔对称性)、CT评价急诊神经影像资料(血肿体积、血肿分层、脑池和脑沟压迫、中线移位、继发性脑室出血、中脑导管出血)、CT评价胸部影像(渗出性病变、支气管内痰液、胸腔积液)、实验室检查、入院时血气结果。血肿体积的测量采用公式V = A*B*C/2 [14] 。根据既往研究,其他被认为与神经系统疾病预后相关的指标同样纳入统计学计算如:心率血压乘积[RPP]、中性粒细胞与淋巴细胞比值[NLR]、血小板淋巴细胞与淋巴细胞比率[PLR]和系统炎症反应指数[SIRI] [15] - [22] 。分别根据以下公式计算:RPP = 收缩压 × 心率;NLR = 中性粒细胞计数/淋巴细胞计数;PLR = 血小板计数/淋巴细胞计数;和SIRI = (中性粒细胞计数 × 单核细胞计数)/淋巴细胞计数。
2.4. 重症治疗的预定标准
住院期间病情恶化需要接受重症治疗是主要的结果指标,结果由一位经验丰富的外科医生进行评估,对潜在的预测因素不知情。两中风综合治疗中心隶属于同一所医科大学,具有相同的重症治疗标准,其预定标准为:
(1) 有持续或恶化的呼吸衰竭迹象,至少符合以下两项标准:呼吸频率 > 40次/分钟,持续的呼吸肌疲劳,伴有pH < 7.35,PaCO2 > 50 mmHg,PaO2 < 60 mmHg或PaO2/FIO2 < 200,持续SpO2 < 90%超过5分钟;
(2) 血流动力学不稳定或心脏骤停;
(3) 神经状况恶化(GCS评分改变大于2分) [11] 。
2.5. 样本量
由于本研究为描述性研究,因此没有进行检验效能计算,并使用选择标准来建立最终的队列规模。使用主要终点的估计的置信区间来评估样本量是否充分。
2.6. 统计分析
2.6.1. 缺失数据
用链式方程多重插补法来插补缺失的数据,共进行了5次插补。所有候选预测因子和结局变量均被纳入插补过程。根据Rubin规则合并不同数据集的结果,缺失数据 > 10%的变量均在插补前被排除 [23] 。
2.6.2. 模型训练
采用单变量逻辑回归分析识别与需要接受重症治疗相关的潜在相关变量。将与重症治疗有单变量关联的候选变量(p < 0.1)纳入多变量逻辑回归模型进行向后逐步回归,并通过赤池信息量准则(AIC)评估模型拟合优度的改善。最终的预测模型是对1000次自举抽样后向后逐步回归筛选出的预测因子进行逻辑回归分析训练的。最终预测模型中纳入的预测因子需要至少在50%的抽样结果中被逐步回归法选出。最终模型中排除了选择频率 < 50%的变量。在最终的模型中没有包含交互项。最终模型的诊断分析包括检查非线性关系(通过RCS回归评估)、强影响点(通过Cook距离评估)和多重共线性(通过每个协变量的方差膨胀因子检测)。基于最终的模型,建立了一个列线图来预测需要接受重症治疗的风险。
为了进一步简化预后模型,我们还将列线图模型中的连续变量转化为分类变量,训练了一个积分评分系统(重症治疗评分[ITscore])。GCS评分可分为3~8、9~12、13~15分3组。其他连续变量通过受试者工作特征(ROC)曲线分析确定的截断值进行二分法。然后利用列线图模型变换的分类变量建立了一个评分系统。以最小SpO2 > 94.5%,D-二聚体 ≤ 1048.6,GCS评分13~15,NLR ≤ 11为基线(参考值)。评分系统中每个变量的比例权重通过多元逻辑回归的变量β系数进行评估。一个基于系数的分数图被创建来估计结果的概率。
2.6.3. 评估列线图模型和推导出的评分系统
通过对模型判别和校准的评价,分别对列线图模型和推导出的评分模型进行了验证。1000次自举抽样被实现为内部验证。采用来自训练队列的数据集,通过1000次重抽样来评估内部验证的结果。外部验证队列用于外部验证。分别采用C-统计量、Brier评分和Hosmer-Lemeshow拟合优度检验来评估模型的判别和校准。采用决策曲线分析(DCA)方法评估两种预测模型的临床效益。
2.6.4. 风险分类系统
需要接受重症治疗风险分类系统也根据评分系统产生的训练队列中每个患者的总得分将所有患者分为三个预后组(低风险:评估风险 < 20%,中等风险:评估风险20%~60%,和高风险:评估风险 ≥ 60%)。采用Logistic回归方法比较不同风险组可能需要接受重症治疗的优势比。
本研究所有分析均采用R软件。本研究采用TRIPOD (针对个体预后或诊断的多变量预测模型报告)的声明来进行分析及报告。
3. 结果
3.1. 研究人群
在分析数据之前,对所有不超过10%的缺失值变量进行计算(训练队列:C反应蛋白[CRP],8%缺失;电解质水平,缺失2%;凝血试验,缺失6%)。最终的训练队列包括234名患者。其中,42人接受了重症治疗。在所有接受了重症治疗病例中,24例主要是由于持续或恶化的氧饱和度下降,11例是由于血流动力学不稳定或心脏骤停,7例是由于神经系统状态的恶化。重症治疗的中位时间为入院后2 (1.5)天。患者基线特征见表1。外部验证队列包括100例患者,其中,其中16例接受了重症治疗。

Table 1. Baseline characteristics and univariate analysis of non-receiving/receiving intensive care in the training cohort
表1. 训练队列中未接受/接受重症治疗的基线特征和单因素分析
注:APTT:活化部分凝血活素时间;CRP:C-反应蛋白;FDPs:纤维蛋白/纤维蛋白原降解产物;Fib:纤维蛋白原;GCS:格拉斯哥昏迷量表;Hb:血红蛋白;IQR:四分位间距;Lac:乳酸;LYM:淋巴细胞;MON:单核细胞;NEU:中性粒细胞;PAB:前白蛋白;PLR:血小板与淋巴细胞比值;PLT:血小板;PT:凝血酶原时间;RPP:心率血压乘积;SIRI:系统炎症反应指数;TBIL:总胆红素;WBC:白细胞。
3.2. 列线图模型的训练
整个队列使用了1000个自举重样本来训练该模型。最终预测模型中涉及的变量包括入院时采集的GCS评分、D-二聚体、NLR和入院后24小时内的最小SpO2。logistic模型中每个预测指标的系数和优势比(ORs)见表2。在模型诊断中没有检测到显著的非线性关系、强影响点或多重共线性。从最终的模型中得到了一个列线图见图1。

Table 2. Coefficient and odds ratio (ORs) of each predictor in the Logistic model
表2. Logistic模型中各预测指标的系数和优势比(ORs)
注:GCS:格拉斯哥昏迷评分;NLR:中性粒细胞/淋巴细胞比值;D-二聚体:ng/mL。
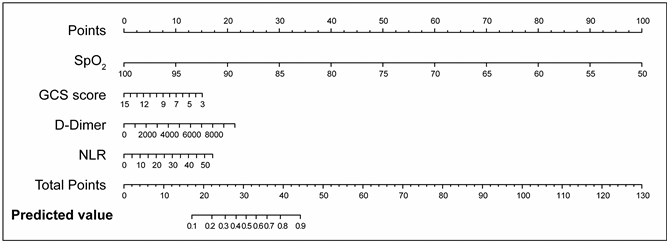
Figure 1. Establishment of a nomogram model for predicting severe treatment in patients with spontaneous intracerebral hemorrhage
图1. 预测自发性脑出血患者接受重症治疗的列线图模型建立
3.3. 训练衍生评分模型(ITcore)
通过转化GCS评分和D-二聚体、NLR和最小SpO2所对应的截断值见图2,建立一个导出的逻辑模型。为了方便临床实际使用,我们将导出的logistic回归模型转换为评分表,通过添加患者评分,可以较容易计算不良结局(重症治疗)的概率见表3。

Table 3. Coefficient and derived score model for each predictor (ITscore)
表3. 每个预测指标的系数和衍生评分模型(ITscore)
注:接受重症治疗的发生风险按以下公式计算:概率(呼吸衰竭) = 1/[1+e−(−3.974755+0.6504176*总分)];GCS:格拉斯哥昏迷量表;NLR:中性粒细胞与淋巴细胞的比值;D-二聚体:ng/mL。
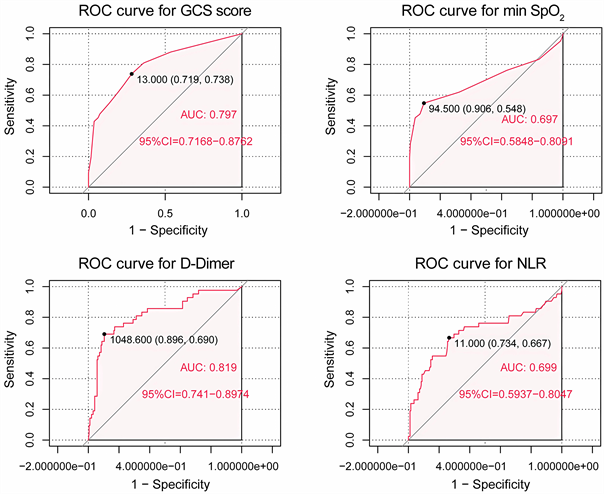
Figure 2. ROC curves and AUC values of GCS score, plasma D-dimer, NLR, and minimum SpO2 in the training cohort
图2. 训练队列中,GCS评分、血浆D-二聚体、NLR、最小SpO2的ROC曲线及AUC值
3.4. 列线图模型和评分系统的评估
为了评估我们的列线图和评分系统的性能,我们采用C-统计来评估模型的识别能力,并采用Brier评分和Hosmer-Lemeshow拟合优度检验来校准模型。与列线图模型相比,评分系统在内部和外部验证中表现出更好的识别和校准见表4。评分模型的内部和外部验证中的C指数分别为0.908 (95% CI = 0.903~0.913)和0.919 (95% CI = 0.844~0.993)。评分模型内部和外部验证的Brier得分分别为0.080和0.068;Hosmer-Lemeshow拟合优度检验不显著。列线图模型和推导出的评分模型在临床决策中都表现出了良好效益。

Table 4. Evaluation of the nomogram model and the derived scoring model
表4. 列线图模型和推导出的评分模型的评估
注:HL:Hosmer-Lemeshow拟合优度检验。
3.5. 风险分类
需要接受重症治疗风险分类系统也根据评分系统产生的训练队列中每个患者的总得分将所有患者分为三个预后组(低风险:评估风险 < 20%,中等风险:评估风险20%~60%,和高危组:评估风险 ≥ 60%)。不同危险组出现接受重症治疗的优势比(OR)见表5。认识到住院期间需要接受重症治疗的风险有助于医生提前安排医疗资源。风险较高的患者应接受更高的护理级别和更为密切的监测,避免病情的突然变化导致不良预后。

Table 5. Estimated risk and odds ratios for requiring intensive care in different risk groups
表5. 不同危险组中需要接受重症治疗的估计风险和优势比
注:调整后OR:根据年龄、血肿体积和CRP进行调整。
4. 讨论
我们训练并验证了一种新的列线图和一个评分模型来预测颅脑出血患者住院期间需要接受重症治疗的风险。预测因子包括神经系统体征(GCS评分)、呼吸体征(SpO2)和血液检测结果(D-二聚体等)。
颅脑自发性出血患者在呼吸、循环或神经系统状况恶化后可能即将需要接受重症治疗,其病理生理变化可能相互作用。血肿的扩大、脑积水的出现和病灶周围水肿的进展都在患者的病情恶化中发挥作用,颅内压进一步升高可能导致严重的呼吸和循环衰竭 [24] 。除了血肿的直接影响外,卒中后的全身性炎症反应也可能诱发患者的继发性损伤 [10] 。出血引起的脑损伤可引起炎症免疫反应,持续的炎症反应抑制全身免疫活性和细胞免疫反应,最终增加卒中相关肺炎(SAP)的风险 [19] 。由严重肺炎引起的持续缺氧也会加剧大脑的损伤。在我们目前的研究中,我们没有选择预测SAP或神经系统恶化,而是选择需要接受重症治疗作为结果指标,因为这是卒中后全身相互作用的结果,是患者病情快速恶化的一个表现,也提示患者死亡率随即升高 [25] [26] 。
在我们的模型中,中性粒细胞与淋巴细胞的比值是需要接受重症治疗的独立预测因子。脑出血后,发生了一个复杂的局部和全身免疫反应的级联反应 [27] 。中性粒细胞早在出血后4小时就迁移到大脑,并在ICH的3~5天达到峰值 [27] [28] [29] 。中性粒细胞释放的分子可能进一步刺激小胶质细胞/巨噬细胞,导致神经炎症过程的加重,从而导致血脑屏障的破坏、脑水肿和细胞损伤,导致ICH后的不良预后 [30] 。同时,中风后交感神经系统可能被过度激活,导致儿茶酚胺水平持续增加,循环淋巴细胞数量减少 [31] [32] 。同样,下丘脑–垂体–肾上腺轴在感知到中风后产生的炎症标志物后也可以被激活。过量的糖皮质激素会从肾上腺的束状带过度分泌,导致淋巴细胞减少和炎症/抗炎水平的改变 [28] 。儿茶酚胺/糖皮质激素介导的早期淋巴细胞激活缺陷主导了受损伤的免疫反应,并与中风诱导的免疫抑制综合征(SIDS)密切相关,这增加了患者对SAP的易感性 [31] 。综上所述,NLR升高,结合中性粒细胞和淋巴细胞,可能提示进行性神经炎症过程或免疫反应抑制,并作为卒中预后不良的预测因素,这与以往的研究一致 [17] [19] 。
我们检测到血浆D-二聚体与颅脑出血患者接受重症治疗风险之间的密切关系。D-二聚体是凝血终末产物,提示凝血和纤溶系统的系统激活。既往的研究显示,较高基线的D-二聚体与ICH的早期神经功能恶化(END)和较高的死亡率相关 [32] [33] [34] 。在亚组分析中,基线D-二聚体水平与血肿扩大的体积有关。相比于那些没有出现血肿扩大的患者(400 [250~610] ng/mL),在血肿扩大的患者中检测到更高水平的血浆D-二聚体(1060 [400~1900] ng/mL, P = 0.03) [32] 。虽然血肿扩大可能是END的原因之一,但D-二聚体与血肿扩大、END或死亡之间联系的具体机制尚不清楚。D-二聚体可能反映了凝血和纤溶途径的损伤,从而导致早期血肿的扩大。D-二聚体本身也能刺激单核细胞的合成和促炎细胞因子如IL-6的释放,这与水肿和血肿扩大的发生发展有关 [35] 。然而,在更为严重的脑损伤和脑出血的情况下,D-二聚体的激增也可能是一种急性期反应。尽管其机制尚不清楚,但D-二聚体在预测ICH的不良预后方面仍具有较好的能力 [32] [33] [34] [35] 。
我们发现期间SpO2 ≤ 94.5%的患者接受重症治疗的可能性显著升高(调整后OR = 7.37,95% CI = 2.74~20.66)。值得注意的是,住院期间最小SpO2的临床应用暂不清楚。在我们的234例患者队列中,227人(97.0%)在入院后的前24小时内通过鼻导管或呼吸面罩以2~6 L/min的流速接受标准氧气,其中5人接受了30~50 L/min气体流量的HFNC。近年来,SpO2作为急性疾病的预测指标格外引人注意。英国胸科学会发布了氧气使用指南,并建议无2型呼吸衰竭的急性患者的SpO2目标为94%至98% [36] 。另一项回顾性研究重申了同样的SpO2目标范围 [37] 。在2018年,AHA/ASA推荐缺血性卒中患者维持动脉氧血红蛋白饱和度 > 94%,无上限要求 [38] 。我们的SpO2截断值似乎与之前研究的数据基本一致。然而,我们对SpO2的结果仅仅提供了对未来风险的评估。对于那些最低SpO2 < 94.5%的患者,外科医生应该计划和分配必要的资源监测,及时调整治疗方案,而不是盲目以增加SpO2为目标,特别是对于2型呼吸衰竭患者,延迟呼吸支持等重症治疗可能与更高的死亡率相关,因为在标准氧气或HFNC模式下掩盖了呼吸窘迫的迹象 [11] [12] 。
据我们所知,本研究是第一个预测颅脑出血患者需要接受重症治疗的预后模型。我们的预后模型包含了多方面的预测因子,以全面评估颅脑出血患者的神经、呼吸和炎症/免疫状况。列线图模型和评分模型都具有良好的鉴别能力和校准性能。但是,我们的研究存在一定的局限性。首先,我们的模型是基于一个回顾性观察队列的,很难从未测量的变量中完全排除潜在的混杂因素。第二,由于部分数据缺失,存在潜在的偏差。
5. 结论
新训练的列线图模型和推导出的评分模型可能可用于预测自发性脑出血患者接受重症治疗的发生情况,并有助于医生提前分配医疗资源。
NOTES
*通讯作者。