1. 引言
动脉粥样硬化是一种最常见的心血管疾病,常见于大、中型动脉中,是心血管疾病和中风的主要原因 [1] 。其发病机理尚不明确,普遍认为是由于吸烟、高血压等条件下造成的血管内皮损伤而引发炎症反应,最终导致动脉壁变硬和管腔狭窄。近年来射频消融作为一种新的治疗手段由于其微创、低成本的特点正广泛被接受 [2] [3] 。但由于无法有效监控温度场分布,仅仅依靠临床医生经验判断消融质量,导致射频治疗后再狭窄的发生率很高 [4] 。有研究考虑在射频电极与斑块接触表面施加冷对流,以防止斑块纤维帽上的内皮细胞过热损伤进而引发炎症反应并造成狭窄化 [5] 。该方案要求既保证达到合适的消融深度,又要保证内皮细胞不受破坏,实现选择性消融斑块的效果。由此温度场分布以及温度梯度带来的血管内热应力的监测至关重要。
然而现阶段没有能够实施有效地监测血管薄壁温度场及热应力分布的手段。近年来利用数值方法求解物理方程进而得到射频热疗过程的温度场分布的方法越来越受到关注 [6] [7] [8] 。计算机建模仿真技术不仅能够观测消融区温度变化,还有助于医生术前制定合理手术计划。在求解数学物理模型时需要先了解几种组织材料的物性参数和其他输入参数,但这些参数却很少为人所知。而且通常在个体之间表现出很大的差异,甚至对于同一个体在不同的生理条件下也是如此,比如高温下参数可能会随温度波动 [9] 。文献中对于上述参数都是设置为固定值,没有考虑生物组织热物性参数的特异性变化,从而造成了仿真的结果与实际情况相差较大,无法提供精准的温度预测。针对上述问题,可通过温度反馈来调节组织参数,减少仿真误差。由于温度场仿真模型中具有多个特性参数,因此反馈调节需要重点关注对误差影响显著的因素,即敏感性参数。
基于此,为了解不同电极和组织参数对动脉粥样硬化斑块射频消融效果的影响,提高仿真预测结果的精准性。本研究首先建立了动脉粥样硬化斑块射频消融电–热–应力耦合仿真模型,分析了不同电极和组织参数下的温度和应力分布,并借助Arrhenius模型定量描述了热损伤效果。随后通过敏感性分析方法来精确表征模型参数如何影响模拟温度和损伤体积。通过设计田口实验,对温度分布模型的特征参数进行主效应和方差分析,得出对消融温度和消融体积有显著影响的敏感性参数。本研究将为优化动脉粥样硬化斑块射频治疗的控制策略提供理论指导。
2. 方法
2.1. 几何描述(Geometry Description)
图1(a)展示了应用于动脉粥样硬化斑块的射频消融过程示意图。射频电极贴片直接接触狭窄的血管壁进行加热。同时,消融导管内的冷却循环水被用来防止血管壁受到热损伤。这种射频加热方案既能确保选择性消融斑块,又能保护正常血管组织,从而将治疗后再狭窄的风险降至最低。血管壁是由内膜、中膜、和外膜组成,其中内膜最薄仅占壁厚的14%,中膜和外膜分别占比44%和42% [10] 。如图1(b)所示的几何结构,由SolidWorks2022软件建立,模仿了真实的髂总动脉(CIA)粥样硬化 [11] ,并且假定沿轴向面对称。随后,几何图形被导入COMSOL Multiphysics软件,以实现下一节中描述的数学模型计算。CIA管腔半径(不包含斑块)为Rlum = 4 mm,血管内膜、中膜、外膜的厚度分别为Tin = 0.15 mm、Tmed = 0.46 mm、Tadv = 0.44 mm。血管总长度设置为L = 30 mm,斑块长度为l = 15 mm。纤维帽半径为Rfc = 8.13 mm,纤维帽厚度为Tfc = 0.2 mm,脂质核心最大厚度为Tlc = 5 mm。采用了正、负电极作为射频加热源,长约为4 mm,宽为1.5 mm,电极间距设置了2、3、4 mm。
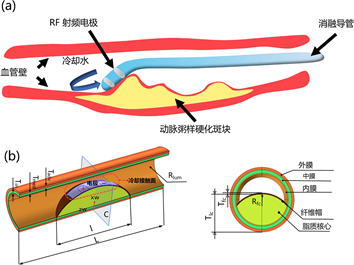
Figure 1. (a) Schematic diagram of radiofrequency ablation process for atherosclerotic plaques; (b) Geometric model
图1. (a) 动脉粥样硬化斑块的射频消融过程示意图;(b) 几何模型
2.2. 控制方程及边界条件
在本研究中将要求解的是一个电–热–应力多物理场耦合的仿真模型。首先求解电–热耦合模型,确定所应用的电场对温度分布的贡献。随后将电–热耦合分析结果作为热应力分析的温度载荷进行力学计算。对于所使用的460 KHz低频RF,Maxwell’s方程可以简化成Laplace’s方程:
(1)
其中,
是组织内电导率(S∙m−1),
是组织内电势(V)。
对于电学边界条件我们考虑:1) 在上述双电极工况中,其中一个电极电势设置为35、40、45 V,另一个电极设置为0 V;2) 除去双电极和斑块接触区域外,其他内表面区域均为电绝缘,即电流密度的法向分量为0;
在髂主动脉中,单位体积内的能量沉积率
可以用如下方程计算:
(2)
其中,E代表电场矢量(V∙m−1)。将
作为内热源项带入传热方程中,如方程(3)所示,电学模型和传热模型得以耦合。温度分布可通过求解电–热耦合的传热控制方程获得。
(3)
代表组织密度(kg∙m−3),c是比热(J∙kg−1K−1),T是温度(K),
是时间(s),k是导热系数(W∙m−1K−1)。
热边界条件我们考虑了射频导管和斑块接触区域施加了对流边界条件,模拟冷却水对内皮细胞的冷却保护。
(4)
代表着表面对流换热系数,
(W∙m−2K−1)。
和
分别是导管和斑块接触区域的温度和血管内膜壁面温度,
和
分别是冷却水温度和血液温度,
、
。为模拟整个传热过程,初始温度设为37℃,血管外表面设为绝热,加热持续时间为100 s。
随着消融温度不断地升高,由温度梯度所引发的热应力是不可避免的,无论血管或者斑块都有可能发生弹性收缩或膨胀。在本研究中,将血管和斑块视作为弹性线性材料,热应变率
和热应力
可以表示为:
(5)
(6)
其中,E为血管的弹性模量,
为热膨胀系数,
为参考温度设为37℃。血管的弹性模量设置为1.5 MPa [12] 。斑块的弹性模量受到种类不同和个体化差异,其值跨度范围较大。依据先前的研究设置了三个水平值(0.08/0.16/0.24 MPa) [13] ,不同水平值可代表不同斑块的硬化程度。血管和斑块泊松比设置为0.45,
分别设置为0.001 K−1和0.002 K−1 [14] 。
2.3. 生物热损伤模型
RF加热致使斑块发生不可逆热消融,本研究引入了Arrhenius模型来定量描述斑块热消融效果。Arrhenius模型考虑了组织温度和热消融时间的累积效应,描述了生物组织的细胞活性与温度和暴露时间的指数关系,具体表达式如下 [15] :
(7)
(8)
其中
代表组织坏死程度,
表示未加热前生物组织未受损细胞的比例,
表示
时刻组织中未受损细胞的比例。热损伤系数
表示受损细胞所占比例。
为加热时间,单位为s,A为频率因子,单位为(s−1),
为不可逆反应的活化能,单位为(J∙mol−1),R为通用气体常数,R = 8.314 (J∙mol−1K−1),
为
时刻的绝对温度(K)。斑块热损伤的参数A和
分别为1.823 × 1051 (s−1)、3.27 × 105 (J∙mol−1) [16] ,血管壁的A和
分别为5.6 × 1063 (s−1)、4.0 × 105 (J∙mol−1)。当热损伤
达到临界值4时,经过持续加热,生物组织内98.2%的细胞发生坏死,并开始产生不可逆的损伤。热损伤体积可通过方程(9)计算:
(9)
2.4. 参数敏感性分析
本研究进行了广泛的文献回顾 [16] [17] [18] [19] ,确定了电和热物性参数的取值范围(最大、平均、最小)以进行参数敏感性分析,见表1。有限元模型中涉及到不确定性参数包括:血管壁和纤维层
、
、
、
,斑块
、
、
、
。为了定量评估各参数对温度场的影响 [20] [21] ,本文对上述提到的八个参数进行了温度的主效应分析和方差分析(ANOVA)。采用田口实验 [22] (Taguchi Method)设计了8参数3水平的L-27正交阵列,由Minitab软件生成,见表2。分别将27组实验安排输入到已建好的有限元仿真模型中,每组实验仿真100 s,依次获得不同实验安排下的各测点的温度,每间隔1 s提取一次数据。
首先利用信噪比的主效应图衡量各参数变化对温度的影响程度。其中信噪比 [20] 表示为:
(10)
再利用方差贡献率(SS%) [20] 对其影响程度进行定量分析:
(11)
其中,Adj_SSi代表参数的方差和。
3. 结果与讨论
3.1. 不同电极参数对温度和热损伤分布的影响
在实际进行射频消融时,由于斑块的纤维帽以及周围正常血管壁受热损伤后可能引发炎症反应进而造成斑块的再狭窄化,需要时刻关注温度场在血管斑块中的分布。如图2所示,本文探究了在不同电压和电极间距下加热100 s后的温度分布,组织参数设置为表1的标准值。图中品红色曲线为50℃等温线,并标记了加热100 s后能达到的最高温度。35 V电极电压下射频加热效果不显著,在间距为3、4 mm
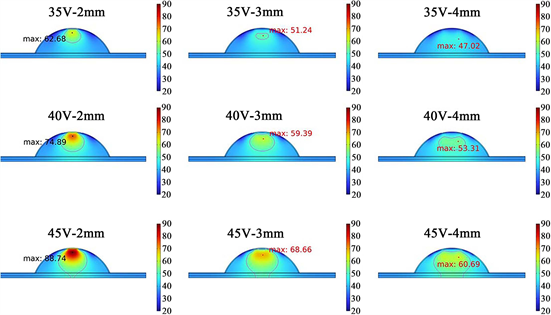
Figure 2. Temperature distribution at different voltages and electrode spacing (z = 0 cross-section) after heating for 100 seconds
图2. 加热100 s后,不同电压和电极间距下(z = 0截面)的温度分布
时斑块内几乎看不到50℃等温线,4 mm间距时最高温度甚至并未超过50℃的消融温度。2 mm间距下的50℃温区范围依然很小,而且高温容易集中到纤维层。然而当电压达到45 V时,50℃温区超出了斑块层,扩展到了纤维层和内膜层,会对正常组织造成不可逆损伤。
相较之下40 V电压加热表现较为良好,图3(a)~(c)展示了电压为40 V时斑块的热损伤分布。仅仅2 mm间隔会造成高温扩散到纤维帽层,3、4 mm间隔有良好的消融效果,但3 mm间隔的消融区域更大。这主要是因为双电极距离越近,电场强度就越大,双电极之间的射频能量也就越大。相反电极间距越大,射频能量不容易集中,从而难以达到有效的消融效果。其次,得益于表面冷却作用,大量热量被带走,有效减少了沉积在纤维帽表面的热能,从而成功避免了对纤维帽的热损伤。40 V、3 mm下的热损伤体积为28.642 mm3,其余电极参数下消融区域要么超出斑块层,要么消融区域过小,均未达到理想的消融效果。如图3(d)所示,40 V电压下,纤维帽内(0~0.2 mm)的温度处于相对安全的温区,温度并未超过50℃,并且可以达到4 mm的消融深度。综合上述结果可以得出结论,电极电压越大、间距越小,高温更容易集中在纤维层。为了保证相对安全的消融效果,可以根据实际治疗情况调节电极参数,间距不宜太近,当间距较远时可以适当增大电压或延长射频加热时间。
3.2. 斑块硬化程度对热应力分布的影响
先前很多的研究 [23] [24] [25] [26] 都关注了动脉粥样硬化斑块的在血流作用或血管支架下的力学效应,但是很少有专门针对斑块在热疗过程中受热应力的理论分析。随着射频能量的不断累积斑块内的温度会持续升高,这个阶段血管及斑块会因存在温度梯度而伴随热应力的产生。不同斑块硬化程度可能会引发不同的热应力损伤,因此本文针对不同斑块的弹性模量进行了热应力分析。
如图4、图5所示,当斑块弹性模量分别为0.08 MPa、0.16 MPa和0.24 MPa时,纤维层最大应力分别为43.2 kPa、53.3 kPa和59.5 kPa,血管壁最大应力分别为10.0 kPa、10.6 kPa和11.2 kPa,斑块的最大应力分别为1.6 kPa、2.9 kPa和4.0 kPa。热应力随着斑块弹性模量的增大而逐渐增大,并且应力主要集中
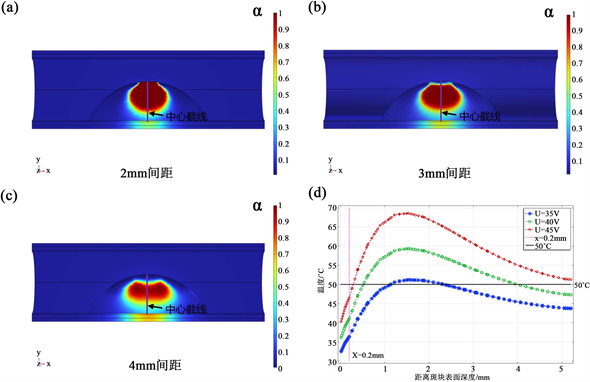
Figure 3. After heating for 100 seconds, the thermal damage distribution at (a) 2 mm; (b) 3 mm; (c) 4 mm spacing at an electrode voltage of 40 V; and (d) temperature distribution along the centerline at different voltages with an electrode spacing of 3 mm
图3. 加热100 s后,电极电压为40 V时(a) 2 mm;(b) 3 mm;(c) 4 mm间距下的热损伤分布;(d) 电极间距为3 mm不同电压下沿中心截线上的温度分布
于双电极周围下的纤维层区域,血管壁次之,斑块区域的应力最小。在实际治疗过程中,应尽量将电极位置放在纤维层较厚的区域,避免应力过分集中于纤维层造成斑块破裂。随着斑块弹性模量从0.08 Mpa增至0.24 Mpa,相应的最大应变分别为108.6 μm、99.2 μm和93.1 μm。应变主要发生在纤维层和血管壁,其中血管壁的应变更为突出。相比之下,热应变分布表现出与应力相反的规律,随着斑块的弹性模量增加,形变量却变得更小。

Figure 4. Stress and strain distribution under different patch elastic moduli (0.08 MPa, 0.16 MPa, 0.24 MPa from left to right) after heating for 100 seconds
图4. 加热100 s后不同斑块弹性模量(从左到右依次为0.08 MPa、0.16 MPa、0.24 MPa)下,应力和应变分布

Figure 5. Stress distribution along the central cross-section under different patch elastic moduli after heating for 100 seconds
图5. 加热100 s后不同斑块弹性模量下,沿中心截线上的应力分布
3.3. 电和热物性参数对温度分布及消融体积的敏感性分析
根据表2中的L-27正交实验安排,分别在COMSOL软件中进行温度场模型仿真,并提取了加热100 s不同测点处TC1、TC2、TC3 (如图6(a)所示)的温度和消融体积。参数σ1、k1、ρ1、cp1、σ2、k2、ρ2、cp2对三个测点处的主效应如图6(b)~(d)所示。很显然,各参数对温度的响应程度并不相同,并且在不同测点之间表现也有较大差异。在TC1点主要影响信噪比的参数是σ2,而在TC2点主要是k2和σ2起了作用,TC3则是σ1和σ2。另外可以很明显观察到σ2、σ1对温度的影响呈正相关,k2呈负相关。相较之下,其他热物性参数在可取值的范围内对温度的影响很小。如图6(f)~(h)方差贡献率所示,对TC1的参数敏感性为:σ2 > σ1 > k1 > cp2 > k2 > ρ2 > ρ1 > cp1,其中σ2和σ1的SS%分别是93.2%和3.14%。对TC2的参数敏感性为:σ2 > k2 > σ1 > ρ2 > cp2 > k1 > cp1 > ρ1,其中σ2和k2这两个参数的SS%分别为82.17%和14.64%。对TC3的参数敏感性为:σ1 > σ2 > ρ2 > k2 > cp2 > k1 > cp1 > ρ1,其中σ1和σ2的SS%分别是64.34%和35.31%。其他参数的SS%要小于3%,因此很容易得出结论:影响温度场分布的主要因素是σ2,σ1,k2。
然而,仅仅基于单个点的敏感性分析具有一定的特殊性。本研究进一步讨论了热消融体积相对参数的敏感性。从图6(e)和图6(i)可以看出,影响消融体积的主要因素是σ2和k2,它们分别与消融体积呈负相关和正相关,方差贡献率SS%分别是73.8%和11.5%。造成这样结果的原因主要有以下两点。首先,从公式(2)中可以看出射频能量是电导率和电场平方的乘积,因此较高的电导率较容易积聚更高的射频能量从而产生高温累积,消融体积自然会趋向更大。其次,较高的热导率k2更容易降低斑块脂质池中心温度,使得更多的热量向周围组织扩散,避免了高温累积从而抑制消融体积进一步扩大。综合上述结果,在仿真模型中σ2,σ1,k2可以设置为温度相关的函数,而其他参数对温度影响较小可设置为常数,这样既可以保证计算结果的精确度又可以减少模型计算的复杂程度。

Table 2. Taguchi L-27 orthogonal array
表2. 田口L-27正交阵列
4. 结论
本研究基于动脉粥样硬化斑块射频消融电–热–力多物理场耦合仿真模型,分析了不同电极和组织参数对温度场、热消融体积、热应力分布的影响。结论如下:1) 电极电压越大、间距越小,高温更容易集中在纤维层。为达到消融效果以及避免过热损伤,可以尽量让电极间距变大并适当增大电压。2) 热应力主要集中于双电极周围下的纤维层区域,随着斑块硬化程度的增大,斑块发生破裂的风险更大。需要调整电极位置在纤维层较厚的区域,避免应力过分集中于纤维层造成斑块破裂。3) 斑块的电导率σ2和血管电导率σ1以及斑块热导率k2对消融区域内各点的温度敏感性最为显著,其中σ2和σ1与温度呈正相关,

Figure 6. (a) Three representative temperature measurement point positions, (b)~(e) Main effect diagrams of each parameter on TC1, TC2, TC3, and ablation volume, (f)~(i) Analysis of variance of each parameter on TC1, TC2, TC3, and ablation volume, respectively
图6. (a) 三个代表性的温度测点位置,(b)~(e)各参数分别对TC1、TC2、TC3和消融体积的主效应图,(f)~(i)各参数分别对TC1、TC2、TC3和消融体积的方差分析
k2与温度呈负相关。影响消融体积的主要因素是σ2和k2,它们分别与消融体积呈负相关和正相关。这些结论将为未来建立针对个体化差异的,组织参数不确定的仿真平台提供科学依据。该仿真平台的搭建有助于临床医生快速高效地制定合理的诊疗方案,为手术中射频消融设备的参数调节提供理论指导。