1. 引言
秋葵(Abelmoschus esculentus (L.) Moench),是原产于非洲的一年生草本植物,隶属于锦葵科,主要分布于热带和亚热带地区。因其独特的口感和香气,秋葵被广泛栽培并作为美味的蔬菜享誉全球。20世纪初,秋葵被引入中国,迅速成为各地普遍栽培的蔬菜品种。因其所含的丰富多糖、黄酮、矿物质和纤维素等成分 [1] ,使它在健康领域展现出潜在的价值,尤其在糖尿病、抗癌、抗疲劳、抗氧化、免疫调节及心血管疾病预防方面的应用前景备受关注 [2] 。尽管秋葵具有诸多益处,但其采摘期较短,易造成采后腐烂和资源浪费问题 [3] 。针对这一挑战,深入探究秋葵的有效成分,特别是多酚类物质,不仅有助于解决这些问题,还能提升秋葵的综合利用价值。
秋葵种子富含多种营养素,特别是在脂肪和蛋白质的含量上表现突出,同时,这些种子也是铁、钾、钙及锰等关键矿物质的良好来源 [4] ,秋葵种子的含油率大约为20%,从而使其成为提取秋葵籽油的理想原料 [5] 。Ijarotimi [6] 等研究发现,秋葵种子蛋白具有较好的抗氧化应激、抗糖尿病和抗高血压的生物活性。目前,关于秋葵多酚的研究主要集中在秋葵荚多酚,游离酚中含有丰富的游离型酚酸、黄酮类、芪类、木脂素等 [7] ,而对于秋葵种子中的酚类物质提取方面的研究较少,且经常出现提取率低,抗氧化活性差等问题 [8] 。
基于上述背景,本研究旨在通过超声辅助醇提法提取秋葵种子游离酚,并利用正交优化法优化提取条件。提取所得的秋葵种子游离酚将通过DPPH、FRAP和ABTS方法评估其抗氧化性能,以期提高秋葵种子的生物利用率并为超声辅助醇提法提取秋葵种子游离酚的工业化生产提供理论支持和参考。
2. 实验部分
2.1. 材料与仪器
秋葵采购于中国福建省;1, 1-二苯基-2-三硝基苯肼(DPPH)、2, 2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、三吡啶基三嗪(TPTZ),上海麦克林生化科技有限公司;维生素C,上海阿拉丁试剂有限公司,其他试剂均为分析纯。TD5A离心机,湖南凯达科学仪器有限公司;DHG-9070A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;UV6000PC紫外可见分光光度计,上海元析仪器有限公司。
2.2. 实验方法
2.2.1. 秋葵的前处理
将新鲜秋葵的种子洗净、磨碎并在烘箱60℃干燥24 h,备用。
2.2.2. 秋葵种子游离酚提取
根据Wang等 [9] 的方法并稍作修改用提取秋葵种子中的游离酚。取一定量的秋葵种子粉末,以不同料液比加入不用浓度的乙醇溶液,在不同温度和时间下进行超声提取,得到的混合物离心10 min以去除沉淀。随后将提取液采用D101大孔树脂纯化,先用纯水洗脱,以达到去除糖、蛋白质等杂质的目的。最后用乙醇洗脱浓缩,得到秋葵种子游离酚(OSFP)。
2.2.3. 秋葵种子游离酚总酚(TPC)含量的测定
TPC采用福林法 [8] 测定,以没食子酸为校准曲线的参考化合物,TPC表示为每克秋葵种子干重的没食子酸当量(mg GAE/g dw)。
2.2.4. 秋葵种子游离酚总酚提取的单因素实验
1) 料液比对种子游离酚TPC提取的影响
称取1 g秋葵种子粉末,在60℃,超声功率144 W下,加入不同料液比(1:60、1:70、1:80、1:90)的70%乙醇,超声提取50 min。考察不同料液比对秋葵种子TPC提取的影响。
2) 乙醇浓度对种子游离酚TPC提取的影响
称取1 g秋葵种子粉末,在60℃,超声功率144 W下,以料液比1:70分别加入70 mL不同浓度的乙醇(50%、60%、70%、80%),144 W超声时间为50 min。考察不同乙醇浓度对秋葵种子游离酚TPC提取的影响。
3) 时间对种子游离酚TPC提取的影响
称取1 g秋葵种子粉末,在60℃下,超声功率144 W下,以料液比1:70加入70 mL 70%乙醇,随后考察不同超声时间(30 min、40 min、50 min、60 min)对秋葵种子TPC提取量的影响。
4) 温度对种子游离酚TPC含量的影响
称取1 g秋葵种子粉末,以料液比1:70加入70 mL 70%乙醇,在超声功率144W提取50 min,考察不同温度(30℃、40℃、50℃、60℃)对秋葵种子TPC提取量的影响。
2.2.5. 正交法优化秋葵种子游离酚的提取工艺

Table 1. The levels and factors of orthogonal test for okra seedfree phenolics
表1. 秋葵种子游离酚正交实验因素水平表
在单因素实验的基础上,以秋葵种子游离酚提取量为响应值(Y),选取料液比(A)、乙醇浓度(B)、时间(C)、温度(D)4个因素,每个因素设定3个水平。利用正交法优化确定秋葵种子游离酚的最佳提取条件,正交实验因素水平见表1。
2.2.6. 秋葵种子游离酚体外抗氧化活性的测定
1) DPPH 自由基清除率测定
参照Peanparkdee等 [10] 的方法测定OSFP的DPPH自由基清除率。配置0.2 mmol/L的DPPH无水乙醇溶液,摇匀后避光备用。向0.2 mL OSFP待测液中加入2 mL 0.2 mmol/L的DPPH溶液,充分混合后避光静置30 min,用紫外分光光度计在517 nm处测定吸光度。以去离子水为空白对照,以维生物素C为阳性对照。DPPH自由基清除率按照公式(1)计算:
(1)
式中:A0:2 mL DPPH溶液加2 mL无水乙醇的吸光度;Ai:2 mL OSFP待测液加2 mL DPPH的吸光度;Ai0:2 mL OSFP待测液加2 mL无水乙醇的吸光度。
2) 亚铁离子还原能力测定
根据Zhang等 [11] 的方法并稍作修改测定亚铁离子的还原能力。将醋酸缓冲液(30 mmol/L, pH 3.6)、TPTZ (10 mmol/L)和FeCl3 (20 mmol/L),以10:1:1的比例混合配置FRAP工作液。HCl (40 mmol/L)、TPTZ (10 mmol/L)和FeCl3 (20 mmol/L)同样以10:1:1的比例混合,配置FRAP空白液。两种溶液都放于37℃的水浴中备用。以Vc作为阳性对照,将0.1 mL OSFP样品和1.9mL FRAP试剂摇匀混合并避光反应30 min,然后用紫外可见分光光度计在593 nm处测定吸光度。以硫酸亚铁为参比化合物,采用标准曲线计算FRAP值。亚铁离子还原能力按照公式(2)计算,再将结果换算成μmol/L Fe2+表示。
(2)
式中:Ai = 0.1 mL OSFP待测液 + 1.9 mL FRAP工作液;Ai0 = 0.1 mL OSFP待测液 + 1.9 mL FRAP空白液;A0 = 0.1 mL蒸馏水 + 1.9 mL FRAP工作液。
3) ABTS =自由基清除率测定
ABTS自由基清除活性是根据Vinci等 [12] 的方法进行测定的,稍作修改。将ABTS (7 mmol/L)和K2S2O8 (2.4 mmol/L)等体积混合后静置在黑暗中12~14 h。然后将混合液用40 mmol/L磷酸盐缓冲液(PBS,pH = 7.4)稀释至吸光度为0.700 ± 0.019,制备标准ABTS溶液。取0.3 mL的OSFP待测液,加入2.7 mL的标准ABTS溶液混合,震荡均匀。在黑暗中孵育30 min后,用紫外可见分光光度计在735 nm处测定吸光度,以VC作为阳性对照。ABTS清除能力按照公式(3)计算:
(3)
式中:A0:2.7 mL ABTS标准溶液加0.3 mL蒸馏水的吸光度;Ai:2.7 mL ABTS标准溶液加0.3 mL OSFP待测液的吸光度。
2.3. 数据分析
每组试验设置3个平行试验,结果用平均值±标准差表示。采用Microsoft Excel 2019进行数据统计整理,采用Origin 2019进行图像处理。
3. 结果与讨论
3.1. 单因素实验结果
3.1.1. 料液比对种子游离酚TPC提取的影响
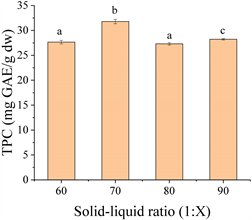
Figure 1. Effect of solid-liquid ratio on extraction of okra seed free phenolics
图1. 料液比对种子游离酚提取含量的影响
如图1所示,随着料液比的增加,总酚含量(TPC)呈现先上升后下降的趋势,当料液比为1:70时,秋葵种子游离酚的提取量最大,此时为32.09 GAE mg/g DW。这可能是由于种子游离酚与溶剂之间的浓度差随着料液比的增加而增大,从而加速了游离酚向细胞外扩散的速度。当料液比为1:70时,种子游离酚的扩散和溶解达到平衡状态。在此基础上进一步增加料液比反而会导致游离酚提取量的下降,这可能与色素和醇溶性的杂质在过大的料液比下加速溶出,从而影响游离酚的提取过程 [13] 。
3.1.2. 乙醇浓度对种子游离酚TPC提取的影响

Figure 2. Effect of ethanol concentration on extraction of okra seed free phenolics
图2. 乙醇浓度对种子游离酚提取含量的影响
乙醇是一种经济实惠且无毒的溶剂,具有优异的选择性和高极性,使其在溶解酚类化合物方面非常有效 [14] 。如图2所示,秋葵种子游离酚的TPC随着乙醇浓度的升高呈先增加后降低的趋势,到浓度为70%时提取效果最佳,TPC达32.61 GAE mg/g DW。而当乙醇浓度超过70%之后,提取量逐渐下降。这可能是由于乙醇浓度过高,导致其他亲脂物质的提取增加,同时降低了游离酚类化合物的溶解度,这与赵强 [15] 等从藜麦糠中超声提取游离酚的现象相似。
3.1.3. 温度对种子游离酚TPC提取的影响
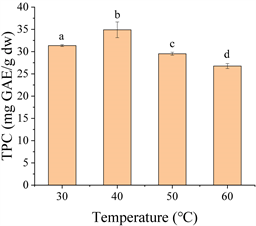
Figure 3. Effect of temperature on extraction of okra seed free phenolics
图3. 温度对种子游离酚提取含量的影响
由图3可知,秋葵种子游离酚的TPC提取受温度的影响显著,40℃时达到最大值(34.90 GAE mg/g DW),50℃后TPC显著降低。温度的升高除了增加生物活性化合物在溶剂中的溶解度和扩散速率外,还会破坏酚类物质与细胞成分(如多糖和蛋白质)的相互作用,进一步增加酚类物质的释放 [16] 。然而,高温使得酒精挥发量增多,也会导致生物活性化合物的热降解和分解,从而对提取效率产生不利影响 [17] 。
3.1.4. 时间对种子游离酚TPC提取的影响
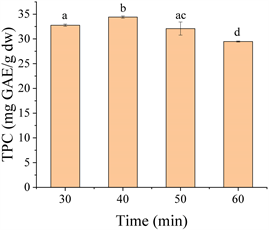
Figure 4. Effect of time on extraction of okra seed free phenolics
图4. 时间对种子游离酚提取含量的影响
如图4所示,当时间到达50 min时,秋葵种子的TPC提出率最大。然而,当时间超过50 min后,TPC出现下降趋势。这是可能由于延长提取时间增加了酚类化合物的分解以及蒸发时溶剂的损失,进一步减少了传质 [18] 。此外,持续加热可能导致其他非酚类化合物生成,这些化合物可能与酚类化合物发生反应,进一步降低其稳定性和提取效率。
3.2. 秋葵种子游离酚提取工艺的优化

Table 2. Orthogonal experiment design and results of the okra seed phenolics
表2. 秋葵种子游离酚正交实验设计及结果
由表2可知,影响秋葵种子TPC提取的因素依次为:A (料液比) > B (乙醇浓度) > C (时间) > D (温度)。本研究通过系统的实验设计与分析,确定了最优的提取条件:料液比为1:70、乙醇浓度70%、温度设定为40℃、时间为40 min。在这一组合条件下,秋葵种子游离酚的TPC达到36.57 mg GAE/g dw,数值高于Ong等 [19] 利用热水加压提取法得到的秋葵种子多酚,体现了超声辅助醇提法提取多酚操作简单、提取温度温和、提取率高且提取物结构破坏相对较少等优点。
3.3. 抗氧化活性
3.3.1. DPPH自由基清除能力
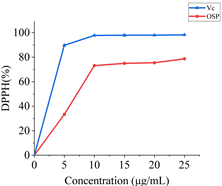
Figure 5. DPPH radical scavenging capacity of okra seed free phenolics
图5. 秋葵种子游离酚的 DPPH 自由基清除能力
DPPH自由基清除的机制是将样品中的羟基上的原子或电子转移给DPPH自由基,从而生成稳定的DPPH分子。如图5所示,秋葵种子游离酚表现出对DPPH自由基的清除能力,最高达到80%,优于华艳宏等 [9] 提取的藜麦种子游离酚,展现出较好的DPPH清除能力。
3.3.2. 亚铁离子还原能力
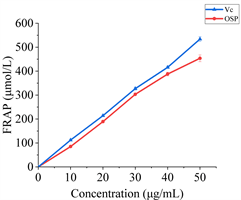
Figure 6. Ferric reducing antioxidant power of okra seed free phenolics
图6. 秋葵种子游离酚亚铁离子还原能力
FRAP是一种用于评估抗氧化能力的方法,它通过在酸性条件下将Fe3+-TPTZ还原为Fe2+-TPTZ过程中某个指标值来测定抗氧化剂的活性 [20] 。图6显示,OSFP的FRAP值呈剂量依赖性增加,其还原亚铁离子的能力与Vc相当。这一结果显著高于Xia等人 [8] 所报道的从秋葵荚中提取的游离酚的FRAP值。我们推测这可能是由于二者在化学结构上存在差异,导致其抗氧化活性不同,同时也证明了OSFP有较强的亚铁离子还原能力。
3.3.3. ABTS自由基清除能力
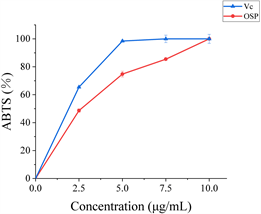
Figure 7. ABTS radical scavenging capacity of okra seed free phenolics
图7. 秋葵种子游离酚的ABTS自由基清除能力
ABTS是一种过氧化氢酶底物,在硫酸钾的作用下形成稳定的自由基ABTS。抗氧化反应会导致溶液颜色变浅,而在波长734 nm处的吸光度的变化可用来反映其抗氧化活性 [21] 。由图7可知,当浓度达到10 μg/mL时,OSFP对ABTS的清除率达到为100%,与Vc相当。OSFP的IC50为3.54 μg/mL,表明OSFP具有良好的清除ABTS的能力。
4. 结论
本研究基于秋葵种子游离酚的提取工艺优化,通过正交法确定了最佳提取条件为料液比1:70、乙醇浓度70%、温度60℃、时间60 min。在此条件下,提取量达到36.57 mg GAE/g dw。秋葵种子游离酚显示出较好的DPPH和ABTS清除能力及亚铁离子还原能力,且抗氧化能力与浓度呈明显剂量依赖性。与前人研究相比,本研究的提取条件更为温和,提取效率更高,且秋葵种子游离酚的抗氧化性能得到了进一步的证实,证明其作为天然抗氧化剂的潜力,为秋葵的进一步研究和工业化生产提供了重要的理论和实践价值。
致谢
感谢课题组的大力支持和帮助,使本人的实验能够快速展开并取得一定成果。