摘要: 目的:探讨行气消癥方对子宫肌瘤大鼠激素水平的影响及机制研究。方法:取40只SD大鼠,随机分为正常组、模型组、米非司酮组、行气消癥方低剂量和高剂量组。除正常组外采用雌孕激素联用法造模。治疗后计算子宫系数,HE染色检测子宫组织病理学变化;酶联免疫法检测定血清中的雌二醇(E2)、孕激素(P)、促卵泡素(FSH)、促黄体生成素(LH)水平;免疫组化法和Western-blot法检测子宫组织水通道蛋白1、2、3 (AQP1, 2, 3)的分布和表达水平。结果:模型组大鼠血清E2、P、FSH和LH水平显著升高,子宫系数高于正常组。与模型组相比,各给药组子宫系数降低,病理变化有不同程度改善,子宫AQP1、2、3表达水平显著降低(
P < 0.05)。行气消癥方高剂量组大鼠血清E2、P、FSH和LH水平显著下调(
P < 0.01)。结论:行气消癥方可下调血清性激素水平改善子宫肌瘤,其机制可能与下调子宫AQP1、2、3的表达相关。
Abstract:
Objective: To investigate the effect of Xingqi Xiaozheng prescription on hormone levels in rats with uterine fibroids and its mechanism. Methods: 40 SD rats were randomly divided into normal group, model group, Mifepristone group, low dose and high dose Xingqi Xiaozheng prescription groups. In addition to the normal group, the model was established by the combination of estrogen and progesterone. After treatment, uterine coefficient was calculated, and the histopathological changes of uterus were detected by HE staining. The levels of estradiol (E2), progesterone (P), follicle-stimulating hormone (FSH) and luteinizing hormonein (LH) serum were detected by enzyme-linked immunosorbent assay. The distribution and expression levels of aquaporin 1, 2 and 3 (AQP1, 2 and 3) in uterine tissue were detected by immunohistochemistry and Western-blot. Results: The levels of serum E2, P, FSH and LH in model group were significantly increased, and the uterine coefficient was higher than that in normal group. Compared with model group, the uterine coefficient was significantly decreased, the pathological changes were improved in different degrees, and the expression levels of AQP1, 2 and 3 in uterus were significantly decreased (P < 0.05). The serum levels of E2, P, FSH and LH in Xingqi Xiaozheng prescription group were significantly decreased (P < 0.01). Conclusion: Xingqi Xiaozheng prescription can improve uterine fibroids by down-regulating serum sex hormone levels, and its mechanism may be related to down-regulating the expression of uterine AQP1, 2 and 3.
1. 引言
子宫肌瘤(Uterine fibroids)是子宫平滑肌组织增生形成的良性肿瘤,常见于育龄女性,主要临床表现为月经异常、白带增多、腹部肿块、下腹坠胀、尿频尿急和尿潴留等,需根据肌瘤的大小和位置进行管理 [1] [2] 。米非司酮为目前子宫肌瘤临床治疗的首选激素类药物,治疗效果较好,但米非司酮作为抗孕酮药物,在机体内达到一定血药浓度后会出现抗皮质激素相关不良反应 [3] 。
祖国医学认为“妇人多气”,气机不畅不能健运血液,瘀血内停,结于胞中,聚结成块而成子宫肌瘤 [4] 。行气消癥方由经方桂枝茯苓丸加减化裁,以“行气活血、化瘀消癥”为根本,每获临床良效 [5] 。现代研究指出雌孕激素水平升高是影响子宫肌瘤发生发展的重要内分泌因素 [6] [7] 。雌激素和(或)孕激素可上调子宫组织AQP1、AQP2、和AQP3的表达 [8] [9] [10] 。本研究使用雌孕激素全程联用法建立子宫肌瘤大鼠模型,探讨行气消癥方对其治疗作用和机制,为临床治疗子宫肌瘤提供理论支持。
2. 材料与方法
2.1. 实验动物
SPF级雌性SD大鼠60只,体重200 g~220 g,购自长沙天勤生物技术有限公司,动物生产许可证号:SCXK (湘) 2014-0011。购入后饲养于贵州中医药大学实验动物研究所,环境许可证号SYXK (黔) 2021-0005,温度20℃~23℃,湿度50%~60%,12/12 h光照黑暗循环,自由摄食饮水,适应性饲养7天。本研究操作过程严格遵循动物伦理相关要求。
2.2. 主要试剂与仪器
行气消癥方中药饮片均购于北京同仁堂饮片有限责任公司,所有药材均符合2022版《中华人民共和国药典》标准。雌二醇注射液购于合肥千方动保科技有限公司,黄体酮注射液购于浙江仙琚制药股份有限公司,米非司酮片(国药准字H20000648,10 mg/片)购于浙江仙琚制药股份有限公司,大鼠促卵泡素(FSH)、促黄体生成素(LH)、孕酮(PROG)、雌二醇(E2) ELISA试剂盒购于江苏酶免实业有限公司。AQP1抗体、AQP2抗体、AQP3抗体和ECL底物液购于Affinity Biosciences公司,单抗β-actin购于武汉三鹰生物技术有限公司。吸入式小动物麻醉机购于北京众实迪创科技有限责任公司,酶标仪购于Thermo scientific公司。
2.3. 造模方法
采用雌孕激素全程联用造模法 [11] :连续30天每天腹腔注射苯甲酸雌二醇注射液(0.5 mg·kg−1·d−1),期间每周注射1次孕酮注射液(4 mg·kg−1·d−1);最后5 d两种激素同时注射。正常组大鼠腹腔注射同等剂量的生理盐水;期间每周称量一次大鼠体重并记录。以大鼠精神状态较差,子宫色泽较暗,宫体显著增大、子宫系数显著升高为造模成功。
2.4. 分组及药物干预
建模成功的32只大鼠,随机分为模型组、米非司酮组、行气消癥方低剂量组、行气消癥方高剂量组,每组8只。行气消癥方低剂量组和高剂量组按临床病人成人用药剂量的1、2倍换算,灌胃剂量分别为14.91 g·kg−1·d−1、29.82 g·kg−1·d−1。米非司酮组灌胃剂量为2.65 mg kg−1·d−1。模型组和正常组灌胃等体积生理盐水,连续给药4周。
2.5. 检测指标
2.5.1. 体重、子宫重量和子宫系数的检测
试验期间,记录各组大鼠每周体重变化和观察一般情况。采血后摘取子宫组织,称重并计算子宫系数(子宫重量mg/大鼠体质量g)。将一部分子宫组织置于中性甲醛溶液中固定,剩余的子宫组织放入−80℃冰箱保存备用。
2.5.2. HE染色体观察子宫组织病理变化
子宫组织经4%多聚甲醛固定24 h后,梯度酒精脱水,二甲苯透明,常规石蜡包埋,切片(厚度为4 μm),脱蜡水化,苏木素–伊红染色,脱水透明后,中性树胶封片,光学显微镜下观察各组子宫组织病理学变化。
2.5.3. ELISA法检测血清性激素
药物干预完成后,使用异氟烷麻醉大鼠。腹主动脉取血,3000转/分离心10 min,取血清,按照ELISA试剂盒说明书检测血清中的E2、P、FSH以及LH水平。
2.5.4. IHC法检测子宫组织中AQPs的分布
子宫切片经脱蜡后,使用柠檬酸抗原修复液修复抗原,放入3%双氧水溶液室温避光孵育,BSA室温封闭30 min后,一抗4℃孵育过夜;第2天滴加二抗,室温孵育50 min后,滴加DAB显色液,苏木素染细胞核3 min,清水冲洗,脱水封片,光学显微镜观察并拍照记录。
2.5.5. Western Blot法检测子宫组织AQPs蛋白表达水平
提取子宫组织蛋白,测定蛋白浓度后,进行凝胶电泳分离并转膜。封闭2 h后,添加一抗:AQP1 (1:1000)、AQP2 (1:2000)、AQP3 (1:500)、β-actin (1:30,000),4℃孵育过夜。次日加入二抗(1:1000),常温孵育2 h。ECL显影,置于凝胶成像系统进行曝光,采用Image J软件进行图像分析,以β-actin为内参,计算蛋白相对表达量。
2.6. 统计学分析
采用SPSS 20.0软件,以均数 ± 标准差(
)建立数据库。在两个组之间进行对比时,使用t检验,在多个组之间进行对比时,使用单因素方差(ANOVA)进行分析,在方差不齐的情况下,使用非参数检验中的独立样本秩和检验。以P < 0.05为具有统计学差异。
3. 结果
3.1. 造模对体重的影响
造模组大鼠体重在造模第4周时显著低于正常组(P < 0.01),见表1。

Table 1. Changes of body weight in each group after modeling (
)
表1. 造模后各组大鼠体重变化情况(
)
注:与正常组比较,**P < 0.01。
3.2. 灌胃给药后大鼠体重变化
与正常组相比,模型组大鼠的体重显著降低(P < 0.05);各给药治疗组体重较模型组逐渐升高,其中行气消癥方高剂量组大鼠体重第4周达到显著差异(P < 0.05),接近正常组体重,见表2。

Table 2. The changes of body weight, uterine weight and uterine coefficient in each group after intragastric administration (
, n = 8)
表2. 灌胃给药后各组大鼠体重、子宫重量、子宫系数变化情况(
, n = 8)
注:与正常组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05。
3.3. 各组大鼠子宫重量和子宫系数比较
如表2所示见,模型组大鼠的子宫重量和子宫系数与空白组相比有所增加,但没有显著差异。与模型组相比,米非司酮和行气消癥方组大鼠的子宫重量和系数均有所降低,也没有显著差异。
3.4. 各组大鼠子宫病理学切片比较
如图1所示,正常组大鼠子宫细平滑肌细胞排列工整,形态未有异常(图1(A));模型组大鼠子宫平滑肌排列紊乱,大小不等,腺体增生,炎性细胞浸润(图1(B));各治疗组改变介于正常组和模型组组之间,部分细胞排列紊乱,细胞核轻度增大,炎症细胞浸润减少(图1(C)~(E))。

Figure 1. The pathomorphological changes of uterine tissue in each group (HE, 200×)
图1. 各组大鼠子宫组织病理形态学变化(HE, 200×)
3.5. 各组大鼠血清性激素水平
与正常组相比,模型组血清中E2、P、FSH和LH的含量均显著升高(P < 0.05)。与模型组相比,高剂量行气消癥方能显著下调E2、P、FSH和LH水平(P < 0.05);低剂量行气消癥方能显著下调E2、P和FSH水平(P < 0.05),LH水平没有显著差异;米非司酮组血清E2和P水平显著降低(P < 0.01),FSH和LH水平没有显著差异,见表3。

Table 3. The level of serum sex hormone in each group (
, n = 8)
表3. 各组大鼠血清性激素水平(
, n = 8)
注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。
3.6. 各组大鼠子宫组织AQP1分布表达情况
AQP1在子宫内膜间质中的毛细血管和小血管内皮细胞中表达,AQP2在子宫内膜腺上皮表达,而AQP3在腔上皮细胞、子宫肌层和腺上皮表达。AQP1、AQP2及AQP3模型组染色要深于正常组,与模型组相比,米非司酮、行气消癥方低剂量和高剂量组染色更浅,见图2。
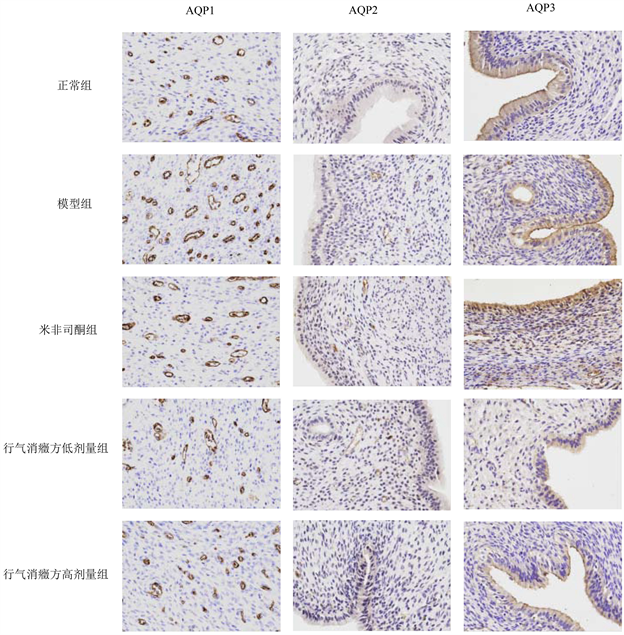
Figure 2. The expression of AQP1, AQP2 and AQP3 in the uterine tissues of rats in each group (immunohistochemical staining, ×400)
图2. 各组大鼠子宫组织中AQP1、AQP2和AQP3的表达(免疫组化染色,×400)
3.7. 各组大鼠子宫组织AQPs表达水平
与正常组相比,模型组子宫AQP1、2、3表达水平均显著升高(P < 0.05)。与模型组相比,米非司酮组、行气消癥方低剂量和高剂量组AQP1、2、3表达水平均显著降低(P < 0.05),见图3。
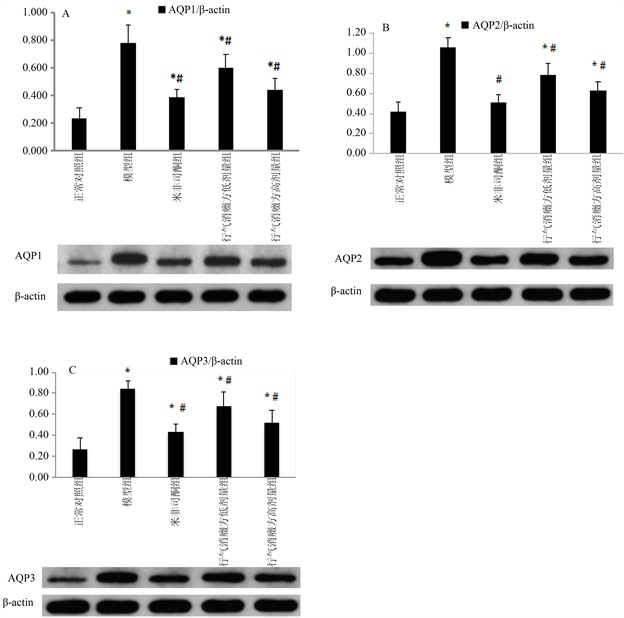 与正常组比较*P < 0.05;与模型组比较#P < 0.05
与正常组比较*P < 0.05;与模型组比较#P < 0.05
Figure 3. The expression of AQP1 (A), AQP2 (B), AQP3 (C) and β-actin in uterine tissues were detected by Western blot
图3. Western blot检测子宫组织AQP1 (A)、AQP2 (B)、AQP3 (C)和β-actin表达含量
4. 讨论
子宫肌瘤是女性最常见的疾病之一,约30%的女性会出现包括子宫异常出血、贫血、盆腔疼痛和压力、背痛、尿频、便秘、不孕或不良妊娠等症状。目前治疗症状性子宫肌瘤的方法有内科、外科和介入放射治疗等 [1] [12] [13] 。其中激素类药物治疗面临着复发率较高、副作用明显等弊端,而手术切除方式又给患者的身体造成创伤和疼痛 [1] ,故临床仍然需要更安全有效的治疗药物。本研究采用的经验方“行气消癥方”治疗子宫肌瘤,可缩小子宫肌瘤体积,改善月经量多、周期延长等伴症状,且无不良反应及毒副作用 [5] 。
本研究使用雌孕激素联用法建立子宫肌瘤大鼠模型,造模大鼠体重显著降低,子宫系数、子宫平滑肌厚度增大,血清E2、P、FSH和LH水平显著升高,与已有研究结果一致 [14] 。给药治疗后,行气消癥方高剂量组大鼠体重升高与正常组接近,子宫重量与子宫系数与模型组比较有所下降;高剂量行气消癥方大鼠血清E2、P、FSH和LH均呈降低趋势。HE染色显示,行气消癥方低剂量和高剂量组大鼠子宫平滑肌层略厚言行细胞浸润的程度、范围较模型组有部分减轻。说明行气消癥方对子宫肌瘤大鼠子宫形态、血清性激素水平具有改善作用。
水通道蛋白(AQPs)是水分和特定小分子物质进行跨细胞膜转运的通道蛋白。AQP1、2、3表达情况随着子宫的不同周期阶段发生变化,在分泌期表达更明显 [9] [15] 。并且受到卵巢类固醇激素的调控,不仅在子宫中水液转运中发挥重要作用,还可能增强子宫内膜的容受性 [15] 。本研究免疫组化结果显示AQP1在子宫毛细血管和小血管内皮中表达,AQP2主要表达在女性子宫腔上皮和腺上皮,而AQP3表达于子宫上皮细胞、平滑肌、子宫内膜腺体和子宫肌层组织,与已有研究结果一致 [16] [17] 。研究表明AQP1在绝经前妇女子宫肌瘤中的表达高于正常子宫内膜,可能通过促进血管生成参与子宫肌瘤的生长 [18] 。AQP2表达量随月经周期而变化,雌激素可能通过AQP2增加子宫内膜上皮细胞对水的渗透性,从而维持子宫内液体平衡 [19] 。AQP3可影响肌动蛋白细胞骨架的重组,从而增加子宫内膜细胞迁移和侵袭能力 [15] 。本研究Western blot结果显示,模型组大鼠子宫AQP1、2、3的表达水平显著高于正常组。表明雌孕激素水平的升高上调了子宫AQP1、2、3的表达水平,提示AQP1、2、3可能参与子宫肌瘤的增殖生长。与模型组相比,行气消癥方治疗组和米非司酮组大鼠子宫AQP1、2、3表达水平明显降低。提示米非司酮和行气消癥方可能通过降低子宫组织AQPs的表达水平,来抑制子宫肌瘤的进一步形成和分化。
综上所述,行气消癥方治疗子宫肌瘤的机制是调节血清性激素水平,下调子宫组织AQPs的表达水平使子宫肌瘤血管生成减少,肌瘤逐渐停止增长或收缩,子宫病理改变得到改善,从而达到治疗效果。
基金项目
贵州中医药大学大学生创新创业训练计划省级立项项目贵中医大创合字(2021)99号。
NOTES
*通讯作者。