1. 引言
再生障碍性贫血(aplastic anaemia, AA)是由多种原因导致的以全血细胞降低为特征的骨髓衰竭性疾病,主要临床表现为出血、贫血、感染 [1] 。异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)和免疫抑制疗法(IST)是AA患者的主要治疗方式。allo-HSCT治疗重型再生障碍性贫血(SAA)已经取得了卓越的疗效,并且是明显优于IST的 [2] [3] 。
移植物抗宿主病(graft-versus-host disease, GVHD)、植入功能不良(poor graft function, PGF)、可逆性后部脑病综合征(posterior reversible encephalopathy syndrome, PRES)等都是移植后常见的并发症,与移植疗效密切相关 [4] 。AA属于血液系统良性疾病,移植后的AA患者往往不是因为疾病复发死亡,而是死于移植后的严重并发症 [5] 。目前不断有研究在探索移植后并发症的危险因素,且各个移植中心的结论有差异,以及分析AA儿童移植并发症特点的研究相对较少。所以我们总结了在2017.09~2023.05在我们中心接受allo-HSCT的儿童SAA患者的临床资料分析儿童SAA患者接受移植后并发症的临床特征,以期指导临床治疗,提高预后。
2. 方法
2.1. 对象
收集2017.09~2023.05在新疆维吾尔自治区人民医院接受allo-HSCT的儿童(≤14岁) SAA患者临床资料。所有患者均符合再生障碍性贫血诊断标准 [6] 。
2.2. 移植相关处理
预处理方案:① 获得性SAA患儿HID-HSCT采用改良Bu/Cy + ATG方案:白消安(Bu):0.8 mg/kg 6小时1次−7~−6d;环磷酰胺(Cy):50 mg/kg/d −5~−2d;抗胸腺细胞球蛋白(ATG):2.5 mg/kg/d −5~−2d。② 获得性SAA患儿MSD-HSCT采用Cy + ATG方案:Cy:50 mg/kg/d −5~−2d;ATG:2.5 mg/kg/d −5~−2d。③ 范可尼贫血患儿HID-HSCT采用FLU/Cy + ATG方案:氟达拉滨(FLU):30 mg/m2/d −6~−2d;Cy:15 mg/kg/d −5~−2d;ATG:2.5 mg/kg/d −5~−2d。④ 范可尼贫血和先天角化不良患儿MSD-HSCT采用FLU/Cy + ATG方案:氟达拉滨:30 mg/m2/d −6~−2d;Cy:10 mg/kg/d −5~−2d;ATG:2.5 mg/kg/d −5~−2d。
干细胞动员和采集:所有患者均接受骨髓(BM)和外周血干细胞(PBSC)移植。供者接受粒细胞集落刺激因子(G-CSF) 5 μg/kg,12小时1次,连续5天。G-CSF动员后的第4天收集骨髓干细胞,第5天收集PBSC,所有采集物在采集当天输注患者体内。
2.3. 并发症预防方案
采用环孢素A (CsA)、吗替麦考酚酯、短疗程甲氨蝶呤预防GVHD。复方磺胺甲恶唑预防卡氏肺孢子虫肺炎,卡泊芬净或伏立康唑预防真菌感染;阿昔洛韦预防病毒感染,如果患者出现了病毒感染,换更昔洛韦抗病毒治疗。前列地尔预防肝窦静脉阻塞综合征。
2.4. 常见并发症定义
移植物抗宿主病(GVHD):移植后100天内发生定义为急性GVHD,主要为临床诊断,主要靶器官为皮肤、肝脏、肠道。100天以后定义为慢性GVHD,主要为临床诊断,可以仅为单器官症状,也可以广泛累计各器官 [7] 。
植入功能不良(PGF):至少两系细胞减少(中性粒细胞减少 < 0.5 × 109/L、Hb < 70 g/L、持续性血小板 < 20 × 109/L),患者细胞为完全供者嵌合。移植后第28天时患者仍未达到造血重建标准被称为原发性PGF。已获得造血重建的患者再次出现造血功能不良被称为继发性PGF [8] 。
可逆性后部脑病综合征(PRES):是一组以头痛、抽搐、视力障碍以及精神异常等神经系统症状为主要表现的临床综合征,影像主要表现为大脑后部白质的可逆性变化为特征 [9] 。
出血性膀胱炎(hemorrhagic cystitis, HC):主要为镜下或肉眼血尿,伴或不伴尿频、尿急、尿痛等膀胱刺激症 [10] 。
2.5. 相关定义
中性粒细胞植入:移植后中性粒细胞连续3天 ≥ 0.5 × 109/L的第1天为中性粒细胞植入时间。血小板植入:在不依赖输血的前提下,连续7天血小板计数 ≥ 20 × 109/L的第1天为血小板植入时间。
2.6. 统计学分析
采用SPSS 24.0软件对数据进行统计分析。计量资料采用中位数描述,分类资料采用频数描述,采用单因素Logistic回归分析移植后并发症的影响因素。采用Log-Rank检验比较不同移植类型的生存结局。P < 0.05为差异有统计学意义。
3. 结果
3.1. 患者一般资料
总共纳入52名患者,男性28名,女性24例。其中获得性SAA 45例,2例伴有阵发性睡眠性血红蛋白尿;先天性SAA共计7例,包括5例范可尼贫血和2例先天角化不良。35名患者接受HID-HSCT,17名患者接受同胞全相合造血干细胞移植(MSD-HSCT),详细资料见表1。

Table 1. Clinical data of the transplanted patients
表1. 移植患者的临床资料
*:有3例患儿在移植后早期死亡,故按n = 49计算cGVHD累计发病率。
3.2. 移植疗效分析
52例患者均成功植入中性粒细胞和血小板。中性粒细胞和血小板中位植入时间分别是12 (9~32)天和14 (11~181)天。
截止2023年11月1日,所有患者的中位随访时间为22.75 (1~73)个月。其中4例患者死亡,4例患者均接受HID-HSCT。1例患者 + 25天死于IV度aGVHD (累计肠道IV级,肝脏IV级、皮肤II级)。1例患者移植后发生了严重的感染,同时合并有严重的IV度GVHD,最终 + 102天死于感染相关的肺泡弥漫性出血。1例患者 + 84天死于颅内感染和脑出血,同时合并有严重的IV度GVHD。1例患者 + 256天死于严重的感染。
通过Log-Rank检验,我们发现HID-HSCT和MSD-HSCT两种不同的移植类型的总生存率没有统计学差异(88.6% vs 100.0%, P = 0.154),见图1。我们通过单因素Cox回归分析发现中性粒细胞的中位植入时间是患者存活的保护因素(P < 0.05, HR = 0.284),其他指标对患儿生存结局无显著影响(P > 0.05),见表2。
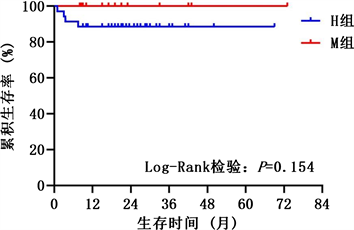
Figure 1. Comparison of OS in the HID and MSD groups
图1. HID组和MSD组患者的生存曲线图比较

Table 2. Univariate COX regression analyses of survival outcomes
表2. 生存结局的单因素COX回归分析
续表
*:aGVHD、cGVHD由于不同生存结局间发生率差异悬殊,加之病例数少,导致HR及95% CI数值异常,不列入分析。
3.3. 并发症分析
3.3.1. 移植物抗宿主病
在+100天时,分别有14 (26.9%)例和9例(17.3%)患者发生II-IV度和III-IV度aGVHD。在II-IV度aGVHD的患者中,其中12例患者接受HID-HSCT,2例接受MSD-HSCT。在III-IV度aGVHD的患者中,其中8例患者接受HID-HSCT,1例接受MSD-HSCT。去除移植后早期死亡的3例患者,共计49例患者纳入cGVHD的分析中,累计4 (8.1%)例患者发生cGVHD,其中广泛型和局限型GVHD各2例。
在死亡的4例患者中,其中3例都合并有III-IV度aGVHD。我们通过单因素分析没有发现III-IV度aGVHD的危险因素,见表3。

Table 3. Univariate analysis of the cumulative incidence of grades III~IV aGVHD
表3. III~IV度aGVHD累计发病率的单因素分析
3.3.2. 植入功能不良
2例患者发生了原发性PGF,没有患者发生继发性PGF。1例患者直到+32天才实现中性粒细胞和血小板植入。另外1例患者在+29天完成中性粒细胞植入,但该患者血小板水平恢复欠佳,不能脱离输血。期间给予激素、艾曲波帕及血小板等对症支持治疗,直到+181天才完善脱离输血,实现血小板植入。目前2例患者均无病长期生存。
3.3.4. 可逆性后部脑病综合征(PRES)
所有患者接受移植后均接受CsA、短疗程甲氨蝶呤和吗替麦考酚酯方案预防GVHD的发生。3例患者出现PRES,累计发生率为5.8%。1例患者+5天以头痛、恶心、呕吐、视物模糊为临床表现,结合患者CsA血药浓度过高,诊断为PRES。1例患者在+67天以头痛和抽搐为临床表现,完善头颅CT提示双侧颞叶可见斑片状低密度影,以及患者近期调整CsA剂量导致的血药浓度过高,诊断为PRES。1例患者+114天出现抽搐,完善MRI提示双侧额顶颞枕叶及小脑半球、胼胝体多发异常信号,部分软脑膜强化,考虑PRES并血管源性水肿。在发现PRES后所有患者在第一时间减低CsA剂量,同时给予氨氯地平控制血压,必要时给予镇静。目前3例患者均好转并长期无病生存且无神经系统后遗症。
3.3.5. 出血性膀胱炎
总计7名患者发生HC,包括6例早发性HC (其中I度1例、II度2例、III度2例、IV度1例)和病毒相关性迟发性II度HC 1例。所有患者的主要临床表现是尿路刺激征和肉眼血尿,除了I度HC患者表现为镜下血尿。IV度HC患者除了上述症状外还伴有尿路不全梗阻的发生。所有患者在及时给予水化、碱化的治疗下病情逐渐好转,对于病毒相关的迟发性HC调整抗病毒方案为更昔洛韦后病毒转阴且症状缓解。
3.4. 病毒感染情况
最常见的病毒感染是巨细胞病毒(CMV)感染,总计12名(23.8%)患者发生CMV感染,且12名患者均是接受HID-HSCT。其中4名患者进展为CMV肠炎,在调整为更昔洛韦或膦甲酸钠抗病毒治疗后CMV均成功转阴。但是1名患者在CMV转阴后25天再次出现了CMV感染,通过加强抗病毒治疗后再次成功转阴。在4例进展为CMV肠炎患者中,其中2名患者死亡。通过单因素分析,我们发现II-IV级和III级aGVHD是CMV感染的危险因素,见表4。可能是由于样本量不足或者MSD-HSCT没有CMV感染出现的原因,在单因素分析时,不同移植类型因素的OR值的95%可信区间显示异常。但是HID-HSCT和MSD-HSCT的CMV发生率是有统计学差异的(34.3% vs 0%, P = 0.006)。

Table 4. Univariate analysis of CMV infection
表4. CMV感染的单因素分析
3名接受HID-HSCT的患者发生了EB病毒感染,但没有EB病毒相关的移植后淋巴细胞增生性疾病的发生。其中1名患者因为远端肌力下降完善腰椎穿刺发现EB病毒,考虑EB病毒相关的病毒性脑炎,给予更昔洛韦抗病毒治疗后症状好转,但患者监护人后续拒绝腰椎穿刺复查。
3.5. 其余并发症
1名接受HID-HSCT的患者在+301天因牙龈肿胀和长期反复腹痛和便血入院,体格检查发现患者双下肢皮肤表面有两个黄豆大小的棕色结节。完善胃肠镜及皮肤活检,同时在二代高通量测序的协助下迅速确诊为HHV-8相关卡波西肉瘤(累计皮肤和肠道),在逐渐减停免疫抑制剂后病灶得到控制并且之后连续监测HHV-8病毒均是阴性。
4. 讨论
目前国内外的研究显示,接受allo-HSCT的患者的总生存率能达到80%以上,并且HID-HSCT与MSD-HSCT相比,两者拥有类似的治疗效果 [11] [12] 。同样有研究已经证实HID-HSCT的临床疗效明显优于IST [2] ,故在缺乏同胞全相合供者时,单倍体移植不失为一种可行的替代治疗方案。该研究与之前的研究结果一致,HID-HSCT和MSD-HSCT的总生存率分别为88.6%和100.0% (P = 0.154)。
GVHD的主要机制是由于宿主的组织抗原导致供者T细胞的活化、表达以及增强免疫反应 [13] 。综合国内外研究,GVHD的累计发病率发生与患者年龄、供受者性别及亲缘关系、供受者血型、移植类型、造血干细胞来源、预处理方案等因素相关 [4] [13] 。PBSC作为移植物来源能促进免疫重建并且获取容易,但由于存在过多的T细胞可能会加重GVHD [14] 。我们的研究中,所有患者均接受BM和PBSC移植,在促进免疫重建的同时尽可能避免GVHD的发生。GVHD不仅影响移植患者的存活情况,同时与患者的长期生存质量密切相关。一项研究证实长期遭受cGVHD的患者通常面临更差的生存质量 [15] 。在我们的研究中4例死亡患者,其中3例被诊断为IV度aGVHD。严重的aGVHD会极大的威胁患者的生命,为了分析III-IV度aGVHD的危险因素,我们纳入了十项指标进行单因素分析,然后并没有发现GVHD的危险因素,这可能与数据样本量不足、纳入分析因素不全面有关系。
PGF是移植后严重危及患者生命的并发症之一,发生PGF的患者面临更高的感染和出血风险 [16] 。之前的研究发现PGF的发生率在5%~27%之间 [17] [18] [19] 。我们的研究仅有2例患者出现PGF,发生率为3.8%,这可能和我们选用BM + PBSC作为移植物来源以及输注足够的CD34+细胞有关系。既往研究已经证明了PBSC和高CD34+计数能够促进免疫重建 [14] [20] 。Zhao等人发现CD34+细胞剂量 < 5 × 106/kg、血清铁蛋白 > 2000 ng/ml和巨脾是原发性PGF的独立危险因素 [19] 。另一项前瞻性研究也证实了铁过载会影响免疫重建 [21] 。对于铁过载的患者来说,通过去铁治疗可能会促进造血重建。目前临床上常用去铁酮和地拉罗司治疗患者的铁过载 [22] 。本研究中仅有2例患者出现原发性PGF,考虑样本量过小,所以未分析相关危险因素。
PRES是一组以神经系统症状为主要表现的临床综合征,影像主要表现为大脑后部白质的可逆性变化为特征。在该研究中一共3例患者发生PRES,发生率为5.8%。目前的研究认为钙调磷酸酶抑制剂和高血压与PRES的发生密切相关 [23] [24] 。在3位患者被诊断PRES时,他们都存在CsA血药浓度升高以及高血压。在我们通过降低环孢素和给予氨氯地平控制血压,3位患者均很快的好转,且没有遗留任何神经系统后遗症。定期监测移植后患者的CsA血药浓度和血压水平,对于PRES预防和诊治有很大的帮助。部分患者在发生PRES是影像学可能出现大脑后部白质的可逆性变化,尽快完善头颅CT或MRI也是有极大帮助的。
HC是主要临床表现为肉眼或镜下血尿,伴或不伴尿频、尿急、尿痛等尿路刺激症 [25] 。在本研究发生HC的7例患者中,均伴有不同程度的镜下或肉眼血尿以及尿路症状。所有患者在加强水化、碱化的治疗下均好转。结合患者的临床和辅助检查可见能够使我们及时明确诊治。早发性HC的发生主要与预处理使用Cy相关且与剂量成正比 [26] ,迟发性HC与各种病毒的感染相关,最常见的是BK病毒感染 [27] 。
CMV病毒是移植后最常见的病毒感染,同时也是非复发死亡主要原因之一。尽管近年来预防和抢先治疗的广泛应用,CMV致病率已降至10%以下,但病死率仍高达20%~60% [4] 。在我们的研究中,4例进展为CMV肠炎的患者中有2名患者死亡,即使他们在通过加强抗病毒治疗后血清CMV转阴。Uppuluri等人发现接受MSD-HSCT、非亲缘HSCT、脐带血和HID-HSCT患者移植后的CMV感染发生率分别为3.0%、33.3%、17.4%和36.5%。我们发现HID和MSD-HSCT的CMV感染发生率有显著差异(34.3% vs 0%, P = 0.006)。通过单因素分析我们发现II-IV和III-IV级aGVHD是CMV感染的危险因素。准确认识CMV病毒感染的危险因素能让我们提前警惕并做好准备,改善患者的预后。现有的研究普遍认为高龄、免疫重建延迟、HID-HSCT、大剂量的免疫抑制剂、严重的GVHD及激素的大量使用等等都是CMV感染的危险因素 [28] [29] [30] 。
目前,allo-HSCT是再生障碍性贫血的有效方法,无论是HID-HSCT还是MSD-HSCT都能取得卓越的疗效。在我们的研究中,几乎所有的患儿都死于移植后并发症。所以探究儿童SAA移植后的并发症的临床特征以及危险因素,能让我们更有针对性的提前做出应对方案。我们发现II-IV和III-IV级aGVHD与CMV感染高发生率密切相关,但我们没有发现III-IV度aGVHD的危险因素。我们的研究存在样本量小、回顾性等缺点。未来需要更大样本的多中心的前瞻性研究去探索移植后并发症的临床特征及危险因素。
参考文献
NOTES
*通讯作者。