1. 引言
早期神经功能恶化(Early neurological deterioration, END)在急性缺血性卒中(ischemic stroke, IS)患者中发生率高,并与死亡率和功能预后密切相关 [1] [2] [3]。因此,预防急性IS患者END的发生十分重要。血小板活化在IS的发病中起着关键作用 [4]。因此,目前指南推荐IS患者使用抗血小板治疗,如氯吡格雷和阿司匹林 [5] [6] [7]。我们既往的研究表明,在卒中后的前30天,阿司匹林联合氯吡格雷治疗在减少缺血性卒中复发方面更有效 [8] [9]。有研究表明,接受氯吡格雷治疗的IS患者中,CYP2C19*2功能降低等位基因携带者与非携带者相比,对氯吡格雷的反应性差,脑梗死复发风险较高 [10] [11] [12]。但CYP2C19*2基因型、双联抗血小板治疗和END之间的关系尚不清楚。本研究旨在探讨CYP2C19*2基因多态性与END之间的关系,并分层分析评估对携带CYP2C19*2功能降低等位基因的急性IS患者阿司匹林联合氯吡格雷是否比单独使用阿司匹林更有效地降低END风险 [8],以指导临床更好预防END的发生。
2. 对象和方法
2.1. 研究对象
为2009年8月至2011年12月首次发病、NIHSS评分 < 15分、发病48小时内入住温州医科大学第三附属医院和德阳市人民医院、新TOAST分型为动脉粥样硬化型脑梗死患者。具体纳入标准和排除标准参见我们之前的文献描述 [8]。共纳入符合标准患者570例。
2.2. 方法
1) 资料收集:对于每个患者,入院时及入院后10天内每天由经过标准化培训的临床医师使用美国国立卫生研究院的卒中量表(National Institutes of Health Stroke Scale,NIHSS)对患者进行评分 [13] [14]。病情恶化时进行额外的NIHSS评分。将入组患者采用随机数码表的单纯随机方法随机分为阿司匹林联合氯吡格雷治疗组(双抗治疗组;n = 284)或阿司匹林治疗组(单抗治疗组;n = 286)。单抗治疗组的患者入院当天至第30天服用阿司匹林每天200毫克,之后每天100毫克。双抗治疗组患者入院当天至第30天每天服用200毫克阿司匹林和75毫克氯吡格雷,此后每天服用75毫克氯吡格雷。两组之间的基线特征和其他治疗方法没有显著差异。此外,两组症状性颈动脉狭窄(狭窄 ≥ 50%)的发生率也没有显著差异[单抗治疗组为17.8% (51/286),双抗治疗组为18.7% (53/284),P = 0.82]。对入组患者各种危险因素的数据进行记录。
2) CYP2C19*2单核苷酸多态性(SNPs)检测:用质谱法检测CYP2C19*2基因型 [11]。
3) 血小板活化指标检测:入院时和治疗7~10天后,使用FC 500 MPC流式细胞仪直接荧光标记测量血小板–白细胞聚集率(Beckman Coulter Ltd., Krefeld, Germany)。用光学比浊法测定血小板聚集率。具体检测程序和方法参见我们以前文献描述 [3] [8]。
2.3. 终点指标
1) 原发终点:END,END定义为入院后10天内NIHSS评分增加 ≥ 2分,排除出血转化、另一血管区域的新梗塞、颅内出血(ICH)、低血压、低血糖、心脏并发症、发热或感染所致的加重 [1] [3]。
2) 次要终点:入院后10天内新发心肌梗塞、新发脑梗死和因心血管事件死亡等。
3) 安全终点:入院后10天内发生的颅内外出血事件。
终点事件采用盲法评估,即评估者对分组和CYP2C19*2 SNPs的结果不知情。
2.4. 统计学方法
采用SPSS 16.0统计软件进行统计分析,单抗和双抗治疗组之间、有无END患者之间基线特征的差异采用单变量方法分析,计数资料用百分比表示,组间比较采用χ2检验;连续变量用
表示,组间比较的正态分布资料用t检验,否则使用秩和检验。
根据单抗和双抗治疗组患者的基因型对END的生存分析用Kaplan-Meier曲线表述。采用Cox比例风险模型评价单抗和双抗治疗组CYP2C19*2基因型对END的影响。进入Cox模型以调整的协变量有:1) 单因素分析中,两组比较P < 0.2的变量;2) 传统卒中危险因素。Cox比例风险模型的结果用风险比(hazard ratio, HR)和95%CI (置信区间)表示。所有检验均为双侧分析,P值 < 0.05具有统计学意义。
3. 结果
3.1. 终点事件
121例(21.2%)患者发生END,其中78.5%的患者(95/121)发生在入院后48小时内,NIHSS评分增加的中位数(四分位距)为4 (2~8)。16例(2.8%)出现次要终点事件:10例新发梗死,2例死亡,4例心肌梗塞。21例(3.7%)出现安全终点事件:15例无症状性出血转化,1例无症状性脑出血,5例颅外出血。与未发生END的患者相比,发生END患者年龄更大、糖尿病比例高、入院时血小板聚集率和血小板白细胞聚集率更高(表1)。双抗治疗组50例(17.6%)患者发生END,单抗治疗组71例(24.8%)患者发生END。双抗治疗组的END发生率低于单抗治疗组(P = 0.032,表2)。

Table 1. Comparison of baseline characteristics and platelet aggregation in patients with or without END
表1. 有或无END患者的基线特征及血小板聚集率比较
注:END,早期神经功能恶化;NIHSS,美国国立卫生研究院卒中量表;AA,花生四烯酸;ADP,腺苷酸5’-二磷酸。
3.2. CYP2C19*2基因型、血小板聚集率和终点指标的关系
CYP2C19*2基因型频率分布符合Hardy-Weinberg平衡(P > 0.05)。单抗和双抗治疗组CYP2C19*2基因型分布比较无统计学意义(表2)。携带CYP2C19*2 AG/AA (功能降低等位基因)和携带CYP2C19*2 GG (野生型)的患者,END发生率分别为26.8% (69/257)和16.6% (52/313) (P = 0.004,表1),两组间次要终点和安全终点无显著性差异(P > 0.05,表3)。无论是双抗治疗组还是单抗治疗组,CYP2C19*2功能降低等位基因携带者的血小板聚集率和血小板–白细胞聚集率均显著高于非携带者(表3)。

Table 2. Clinical outcomes and CYP2C19*2 genotype distribution of patients in the dual therapy and monotherapy groups
表2. 双抗治疗组和单抗治疗组患者的终点事件和CYP2C19*2基因型分布
注:HT,出血转化;ICH,颅内出血。

Table 3. Effect of CYP2C19*2 genotype on END and platelet activation in the dual therapy group and monotherapy group
表3. CYP2C19*2基因型对单抗和双抗治疗组END和血小板活化的影响
注:END,早期神经功能恶化;AA,花生四烯酸;ADP,二磷酸腺苷采用t检验,与单抗组CYP2C19*2 AG/AA患者相比,P < 0.05。
3.3. CYP2C19*2基因型、抗血小板治疗和终点指标的关系
分层分析显示,非功能降低等位基因携带者双抗和单抗治疗组之间的END发生率没有显著差异[16.7% (26/156)比16.6% (26/157),P = 0.998] (表3),入院时或治疗7~10天后,两组间血小板聚集率和血小板–白细胞聚集率也没有显着差异(均P > 0.05,表3);功能降低等位基因携带者双抗治疗组END发生率明显低于单抗治疗组[18.8% (24/128)比34.9% (45/129),P = 0.006) (表3),两组患者入院时血小板聚集率和血小板–白细胞聚集率无显著差异,但双抗治疗组在治疗7~10天后血小板聚集率和血小板–白细胞聚集率显著低于单抗治疗组(均P < 0.05,表3),提示对于CYP2C19*2功能降低等位基因携带者,阿司匹林联合氯吡格雷治疗比单用阿司匹林更能有效地减少END和抑制血小板活化。
Cox比例风险模型显示,在校正协变量后,双抗治疗与携带至少一个CYP2C19*2功能降低等位基因IS患者的END低风险独立相关(HR:0.78;95%CI:0.58~0.96;P = 0.013) (图1(A);表4),但不影响非携带者的END风险(HR:1.01;95%CI:0.83~2.03;P = 0.532) (图1(B);表4)。
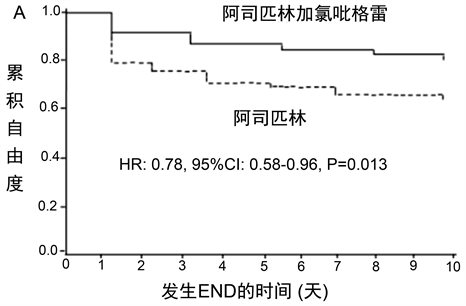
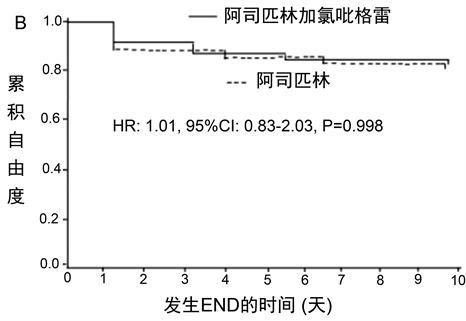
Figure 1. Kaplan-Meier analysis of cumulative freedom from END ssociated with antiplatelet treatment for carriers of CYP2C19*2 reduced-function allele (a) and noncarriers of CYP2C19*2 reduced-function allele (b). END, early neurological deterioration; HR, hazard ratio; CI, confidence interval
图1. (A) 携带CYP2C19*2功能降低等位基因者抗血小板治疗相关终点累积自由度的Kaplan-Meier分析;(B) 非携带者抗血小板治疗相关终点累积自由度的Kaplan-Meier分析。END,早期神经功能恶化;HR,危险比;CI,置信区间

Table 4. Multivariate Cox proportional hazards model assessing the risk of END with respect to the CYP2C19*2 genotype and use of aspirin or clopidogrel plus aspirin
表4. 多变量Cox比例风险模型评估与CYP2C19*2基因型和使用阿司匹林或阿司匹林联合氯吡格雷相关的END风险
注:END,早期神经功能恶化;HR,危险比;CI,置信区间。
4. 讨论
本研究中,21.2%的急性IS患者发生END,CYP2C19*2功能降低等位基因携带者与血小板活化和END的发生相关,阿司匹林联合氯吡格雷可以降低CYP2C19*2功能降低等位基因携带者END的发生率,但双抗治疗不影响非携带者END发生率。
氯吡格雷是一种无活性前体,需要通过细胞色素P450 (CYP)转化为活性代谢物才能发挥抗血小板作用。CYP2C19*2编码CYP酶,可能影响氯吡格雷转化为其活性代谢物 [15] [16] [17]。我们既往研究表明,CYP基因的变异与氯吡格雷的反应及预后密切相关。因此,对这些患者应该调整抗血小板治疗方案。本研究分层分析显示,对于CYP2C19*2功能降低等位基因的携带者,阿司匹林加氯吡格雷在降低END风险和抑制血小板活化方面优于单独使用阿司匹林者。然而,双重抗血小板治疗并不影响非CYP2C19*2功能降低等位基因的携带者END发生率和血小板活化。这表明抗血小板治疗预防END的有效性可能与CYP2C19*2单核苷酸多态性有关。
阿司匹林和氯吡格雷有不同的药理机制,可以协同抑制血小板活化 [18]。CYP2C19*2不参与阿司匹林的药理学机制,不影响阿司匹林反应性和临床结局。因此,阿司匹林联合氯吡格雷可能预防携带CYP2C19功能降低等位基因的IS患者END发生。
本研究局限:1) 样本量偏小、随访时间短、两中心研究,因此,我们的发现有待于将来大样本和多中心研究证实。2) CYP2C19*2 SNPs对血浆氯吡格雷及其活性代谢物水平有影响 [16],但本研究没有检测血浆氯吡格雷及其活性代谢物水平;3) 阿司匹林相关的基因多态性和氯吡格雷其他相关的基因多态性在本研究中未进行检测,不能排除这些基因多态性对END发生率的影响。
5. 结论
综上所述,急性动脉粥样硬化型脑梗死END发生率高。CYP2C19*2功能降低等位基因的携带者与END的风险增高有关。阿司匹林联合氯吡格雷能更有效地降低CYP2C19功能降低等位基因携带者的END风险。我们的发现可能有助于指导精确和个性化的抗血小板治疗,降低END的风险。
6. 道德标准
研究方案由参与医院的伦理委员会根据赫尔辛基宣言规定的原则批准。获得了所有参与者的书面知情同意。
致谢
感谢德阳市科学技术研究基金会(批准号2014SZ035)和成都中医药大学科学研究基金会(批准号YYZX1510)对本研究的部分资助。
基金项目
德阳市2014年度重点科学技术研究项目(2014SZ035);四川省卫生和计划生育委员会科研课题(140025)。
NOTES
*通讯作者。