1. 引言
草莓果实因其味道酸甜、香气浓郁以及外形美观、颜色艳丽,而深受广大消费者喜爱;是一种经济价值和营养价值都比较高的小浆果。风味是果实优良品质的一个重要方面,包括甜味、酸味和气味等。甜味主要由葡萄糖、果糖、蔗糖等的含量决定;酸味主要由有机酸含量和种类决定(苹果酸和柠檬酸等),其多为呼吸产物。草莓属于柠檬酸型果实,此型还有柑橘、芒果、猕猴桃和菠萝的果实 [1] [2]。其它如苹果、桃、梨和枇杷等则属于苹果酸型果实,相对较少的是酒石酸型果实,典型的代表为葡萄。
有机酸含量在果实生长发育过程中也发生着变化。刘士华等 [3] 得出结论:草莓果实中有机酸含量先随着果实生长发育而积累,转入成熟期后有机酸的含量也随之下降。杨雷 [4] 研究了草莓可滴定酸的变化规律,果实中的酸主要为有机酸,其中柠檬酸占到总酸量的80%~90%,4个品种的含酸量变化趋势基本一致,果实白果前可滴定酸呈增长趋势,白果期后开始下降,整个变化过程类似抛物线。倪溢楠 [2] 检测了15种国内外栽培草莓品种,总酸含量在3.99 mg/g~7.89 mg/g之间,其中柠檬酸为主要有机酸(占比49%~75%)。邵晓庆 [5] 认为草莓栽培种和野生种的主要有机酸均为柠檬酸。
呼吸作用是受控状态下对体内大分子的氧化分解过程,而酶是调控这一过程的关键因素之一,其中一个代表性的酶就是柠檬酸合酶(Citrate Synthase),它是三羧酸循环以及乙醛酸循环中的关键酶。这两个循环分别在线粒体和乙醛酸循环体中进行。在线粒体中柠檬酸合酶催化来自糖酵解或其它异化反应的乙酰CoA与草酰乙酸缩合合成柠檬酸,它是进入三羧酸循环的第一个酶。三羧酸循环是糖、脂肪、蛋白质三大类物质的共同氧化途径,它的中间产物也是生物合成中构件分子的主要供给源。在乙醛酸循环体中,脂肪酸经过β-氧化分解为乙酰CoA,在柠檬酸合成酶的作用下乙酰CoA与草酰乙酸缩合为柠檬酸,再经系列的酶促反应和中间产物形成草酰乙酸,可以再与乙酰CoA缩合为柠檬酸,于是构成了乙醛酸循环。植物细胞的过氧化物酶体(peroxisome)又称乙醛酸循环体(glyoxysome)。
在模式植物拟南芥的基因组中,柠檬酸合酶基因有5个成员,根据它们的序列同源性分析可分为两类:I类线粒体CS有2个成员(AtCS4和AtCS5),它们的序列同源性86%,其蛋白N端有定位于线粒体的信号肽;II类乙醛酸循环体CS有3个成员,AtCS1、AtCS2和AtCS3,它们的序列同源性80%~87%,其中AtCS1和AtCS2在3号染色体上串联分布,它们的蛋白定位于乙醛酸循环体,具有PTS2 (Peroxisomal Targeting Signal type 2)信号序列。两类蛋白之间的序列同源性只有22%。这些为草莓的柠檬酸合酶基因研究提供背景参考。
森林草莓(Fragaria vesca)属于蔷薇科草莓属的重要二倍体野生资源,其基因组测序已经完成 [6],其相对于广泛栽培的八倍体凤梨草莓(Fragaria ananassa)而言具有遗传背景简单,生育周期短、基因组较小和遗传转化相对容易等优点,因而成为蔷薇科果树用于基因功能验证和基因组研究的模式植物。
因此,我们从森林草莓的柠檬酸合酶基因入手,解析其成员数量、基因结构特点,揭示其在不同组织和果实不同发育时期的表达情况,为草莓品质改良奠定基础。
2. 材料与方法
2.1. 植物材料
本研究所用植物材料为不走茎、红果型森林草莓,种植在本课题组的人工气候室,生长温度为23℃ ± 2℃,光照周期为16 h光照/8 h黑暗,基因表达分析中根、茎和叶取自1~2个月大小的森林草莓苗,均为各部位的混合样,花和不同时期的果实选自盛果期的草莓,均为混合取样,试验进行3次重复。
2.2. 引物
特异性扩增的引物设计,根据GenBank中NC_001725的基因序列设计和合成针对草莓肌动蛋白基因Actin的引物:Actin-F:GGGTTTGCTGGAGATGATGC,Actin-R:TCTCCTTGCTCATCCTATCAGC,用来验证反转录的质量和调节模板量相对一致 [7]。基因表达半定量引物,根据XM_004306439 (LOC101306555)序列设计引物对:FvmCSf:GTGGGAATGTCAGTGCTCATAC和FvmCSr:CCTTTCAAGAGGCAAACCAAGA (扩增产物大小545 bp);根据XM_004306235 (LOC101299699)序列设计引物对:FvgCSf:GGTGGAGCAAATGAGGCTGT和FvgCSr:AGACAAACGACGCTTAGAGGC (扩增产物大小549 bp);研究中所用引物均由上海生工生物技术公司合成。
2.3. RNA的制备和反转录
总RNA的提取根据试剂盒的说明进行,所用试剂盒为FastPure® Plant Totol RNA Isolation Kit (Polysaccharides/Polyphenolics-rich)多糖多酚植物RNA提取试剂盒(南京诺唯赞生物科技股份有限公司)。按照HiScript® II 1st Strand cDNA Synthesis Kit (+gDNA wiper)反转录试剂盒(南京诺唯赞生物科技股份有限公司)说明书进行cDNA 第一链合成,置于−20℃冰箱保存备用 [7]。
2.4. 基因表达半定量分析
将反转录产物作为PCR扩增的模板,对每一样品先进行Actin的扩增,确定反转录质量良好和模板量相对一致后,再分别进行2条基因的特异扩增。30 μL RT-PCR反应体系:dd H2O 12 μL、cDNA 1 μL、10 μmol/L正、反向引物各1 μL、Taq mix 15 μL。反应程序:预变性94℃ 2 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃延伸5 min。用1.5%琼脂糖凝胶电泳检测扩增产物。EB染色,凝胶成像仪观察。
2.5. 生物信息分析
基因搜索通过NCBI (https://www.ncbi.nlm.nih.gov/)和GDR (http://www.rosaceae.org/)。序列比对通过在线Blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行。生物信息学分析主要采用https://web.expasy.org/protparam/对目的基因编码蛋白的理化性质进行预测,使用https://www.genscript.com/tools/psort等链接的网上软件进行蛋白亚细胞定位。通过DNAMAN软件进行引物设计和本地序列比对等。
3. 结果与分析
3.1. 森林草莓柠檬酸合酶基因的成员
通过基因搜索和序列比对,从森林草莓数据库中搜寻到2个柠檬酸合酶基因序列,1个是线粒体柠檬酸合酶基因(citrate synthase mitochondrial),命名为Fvmcs;另1个是乙醛酸循环体柠檬酸合酶基因(citrate synthase glyoxysomal),命名为Fvgcs。Fvmcs的cDNA长1859 bp,编码区CDS长1410 bp,编码469个氨基酸;对应DNA长度6983 bp,由19个外显子和18个内含子组成。Fvgcs的cDNA长1826 bp,编码区CDS长1524 bp,编码507个氨基酸;对应DNA长度3827 bp,由13个外显子和12个内含子组成。2类基因的外显子数目与拟南芥的非常接近,如图1所示,黑框为外显子、线条为内含子,线粒体柠檬酸合酶基因的外显子19或20个,乙醛酸循环体柠檬酸合酶基因的外显子12或13个。
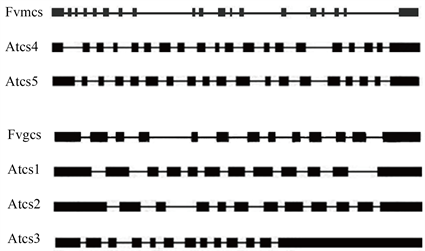
Figure 1. Gene structure map of Citrate Synthase
图1. 柠檬酸合酶基因结构图
3.2. 森林草莓柠檬酸合酶蛋白序列的特性
在线打开网上相关的分析软件,分别输入我们的目的基因或蛋白序列,经过运行后得到相应的结果。用Protparam分析,FvmCS蛋白的分子量:52.014 kD,理论等电点pI:8.13,用Psort进行亚细胞定位预测为线粒体(69.6%)。FvgCS蛋白的分子量:55.610 kD,理论等电点pI:8.75,N-端12至20位氨基酸含有乙醛酸循环体特有的定位序列PTS2-RLAVLTAHL (RLx5HL,x5 = 5个任意氨基酸)。
通过https://blast.ncbi.nlm.nih.gov/Blast.cgi进行Protein BLAST,输入FvmCS蛋白序列,比对结果显示100条,其中1条是它自己,剩余99条则是其它植物的线粒体柠檬酸合酶蛋白,序列相似度94.04%~84.96%。其中有少数几条hypothetical protein或者unnamed protein,如果把它们分别进行BLAST,结果也是其它植物的线粒体柠檬酸合酶蛋白。同样,FvgCS的比对结果:99条是其它植物的乙醛酸循环体柠檬酸合酶蛋白,序列相似度95.66%~85.58%。
把FvmCS蛋白(A)和FvgCS蛋白(B)分别和拟南芥的2条线粒体柠檬酸合酶蛋白和3条乙醛酸循环体柠檬酸合酶蛋白比对,如图2所示部分序列的结果,黑色区域部位的氨基酸序列是多序列一样的,其它颜色区域部位同源性则较高或者不一样。
把FvmCS和FvgCS蛋白与其它植物的柠檬酸合酶蛋白进行聚类分析,如图3所示,整体分为2支,1支为线粒体柠檬酸合酶,另1支为乙醛酸循环体柠檬酸合酶。亲缘关系近的则聚在一块,草莓和月季等较近,同为蔷薇科;拟南芥和油菜较近,同为十字花科。
3.3. 森林草莓柠檬酸合酶基因的表达分析
取各种材料的cDNA,经Actin引物扩增调整模板浓度一致后,再以草莓2种柠檬酸合酶的特异引物来扩增进行半定量PCR检测。柠檬酸合酶的表达经半定量RT-PCR检测结果如图4所示,在不同组织(根、短缩茎、叶、花序和果实)以及果实的不同发育阶段都有相近强度的表达,为组成型。
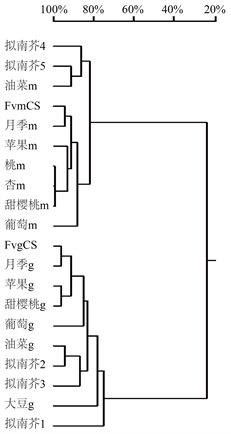
Figure 3. Cluster analysis of citrate synthase protein sequences in different plants
图3. 不同植物的柠檬酸合酶蛋白序列聚类分析
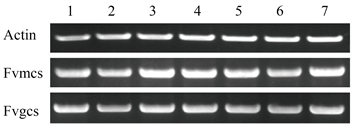
Figure 4. Expression of the citrate synthase gene
图4. 柠檬酸合酶基因的表达
4. 讨论
从森林草莓基因数据库找寻到2个柠檬酸合酶基因,它们具有植物柠檬酸合酶基因的特征和结构域,并分别与其他植物来源的线粒体柠檬酸合酶和乙醛酸循环体的柠檬酸合酶具有很高的序列相似性,参与重要的生理代谢途径:mCS是线粒体中TCA循环起始的关键酶,参与细胞内主要的能量代谢;gCS是植物乙醛酸循环体中的重要酶,通过乙醛酸循环途径参与脂肪的代谢。
在果实的成熟过程中,有机酸的积累与柠檬酸合酶以及后续的系列关键酶的表达有关。王滕旭等 [8] 从甜橙中克隆了1个线粒体柠檬酸合酶基因,在果肉和果皮中的表达变化较小,基本呈稳定的组成型表达,这与我们发现的柠檬酸合酶基因的表达模式类似。Iannetta等 [9] 制备艾尔桑塔草莓果实盐提取物,经双向凝胶电泳和蛋白N端测序鉴定了7个蛋白,其中1个是线粒体柠檬酸合酶;设计简并引物扩增了其cDNA序列(Famcs)。Southern杂交显示其是单一核基因编码;Northern杂交显示其在花和小绿果中高表达;Western杂交显示其蛋白在果实发育后期含量较高;可见其RNA水平和蛋白水平结果不一致。可见,果实有机酸含量是数量性状,遗传较为复杂。
有机酸是果实品质的一个重要部分,与糖一起形成果实的风味,导致果实酸甜可口。果实酸含量的变化受多种因素的协同影响,有遗传的也有环境的,如光照和肥水控制等。基因表达与果实酸含量变化趋势不一致的原因,可能与这些基因转录后或者翻译后的调节有关,也可能与有机酸代谢相关酶基因呈现明显的空间表达有关。还需揭示果实有机酸的跨膜运输以及果实有机酸代谢的调控网络等。
柠檬酸合酶参与多种生理过程,如种子萌发和抗逆等 [10]。另外,迟光红等 [11] 克隆了香蕉乙醛酸循环体的柠檬酸合酶MagCS,从其在采后成熟前期的表达差异,推测其可能还参与香蕉采后成熟的生理过程。柠檬酸等有机酸可与Al3+络合形成稳定的复合物,这些复合物对植物的毒性较低或者无毒,所以提高柠檬酸合酶的表达能提高植物对铝毒害的抗性 [12] [13]。还有研究表明植物可以通过分泌柠檬酸活化土壤中难溶性磷来提高土壤磷的可利用性 [14]。本研究为提高草莓果实品质和植物抗逆性,提供科学依据。
5. 结论
我们首次解析了森林草莓的2个柠檬酸合酶基因:线粒体柠檬酸合酶基因(Fvmcs)和乙醛酸循环体柠檬酸合酶基因(Fvgcs);它们具有柠檬酸合酶基因特有的结构和功能域,并且与其它植物的柠檬酸合酶有很高的序列同源性;在根、短缩茎、叶、花序和果实等组织以及果实的不同发育阶段,2个柠檬酸合酶基因都是组成型的表达。此结果与栽培草莓的1个线粒体柠檬酸合酶基因的表达略有不同,但与甜橙的结果类似,乙醛酸循环体柠檬酸合酶基因的研究报道则是草莓属的首次。今后可通过分子生物学手段与栽培措施相结合,调控糖的代谢以及有机酸的水平,以期达到改善草莓风味、提高果实品质的目的。
基金项目
山东省农业科学院农业科技创新工程项目(CXGC2021A28、CXGC2022E08)资助。
NOTES
*通讯作者。