1. 引言
目前,在表活剂驱(或聚表二元驱)采出污水处理工艺方面,减少COD (化学需氧量)的常用方法主要有絮凝法 [1],氧化法 [2],催化法 [3] 和生物处理法 [4] [5] 等。通过化学法或生物法氧化降解污水中的聚合物和表面活性剂,效果虽好但存在处理周期长等问题。物理吸附法能快速地富集处理污染物并且后续处理十分简便。类沸石咪唑酯骨架结构材料(Zeolitic Imidazole Frameworks简称ZIFs)因高比表面积,孔隙度高等优点,作为吸附材料用于水处理的研究已相当广泛 [6] [7]。但目前为止,众多文献报道是关于ZIFs对于吸附气体、重金属、染料、抗生素等污染物的吸附,并没有文献探讨ZIFs对表活剂污染物如常见表活剂十二烷基磺酸钠(SDS)等的吸附性质。本文主要通过吸附热力学、吸附动力学和ZIF-8吸附SDS前后表面性质的研究,揭示了ZIF-8吸附SDS机理。
2. 实验部分
2.1. 主要试剂及仪器
六水硝酸锌、2-甲基咪唑:分析纯、阿拉丁试剂(上海)有限公司;十二烷基磺酸钠、活性炭、氯化钠、甲醇、氨水:分析纯,成都科龙化工试剂厂;DSA30界面参数一体测量仪:德国Krüss GmbH CO;X射线光电子能谱仪:美国赛默飞世尔科技公司;电热鼓风干燥箱,德国Binder公司。
2.2. ZIF-8的制备
根据制备时所用溶剂的不同,本文制备了三种类型ZIF-8,包括ZIF-8 (甲醇)、ZIF-8 (纯水)和ZIF-8 (氨水),以制备ZIF-8 (甲醇)为例,具体过程如下:在烧杯中准确称量1.34 g Zn(NO3)2∙6H2O,加入40 mL甲醇搅拌均匀后备用,另取一个烧杯准确称量0.334 g 2-甲基咪唑,加入40 mL甲醇搅拌均匀;将2-甲基咪唑甲醇溶液倒入先前准备好的Zn(NO3)2∙6H2O甲醇溶液,混合均匀后,静置1 d;将得到的乳白色悬浊液转移至离心机,以5000 rpm转速离心10 min,倒掉上清液后用甲醇洗涤,重复5次;将离心后的白色粉末放入真空烘箱,40℃下干燥过夜。
2.3. SDS溶液的配制及其浓度检测方法
用纯水准确配制1000 mg/L的SDS作为母液备用,根据Ingram和Luckhurst的理论,即当表面活性剂浓度低于其临界胶束浓度(cmc)浓度范围时,溶液的表面张力τ和表面活性剂浓度存在下列关系:
采用DSA30界面参数一体测量仪来检测溶液表面张力并计算SDS的浓度。具体步骤如下:用1000 mg/L的SDS溶液配制10、50、100、150、200 mg/L共6组不同浓度梯度的SDS溶液,加入NaCl使每组NaCl浓度为0%、0.1%、0.5%、1%、1.5%。用注射器装入SDS溶液,通过软件控制,调节注射量直至液滴滴落前,利用CCD相机进行拍照记录,通过仪器自带的软件对获得的图像进行分析得到表面张力。将采集到的表面张力数据与SDS浓度的对数作图得到了不同盐浓度下SDS浓度–表面张力关系的标准曲线,如图1所示。通过拟合可知,每根曲线的R2均大于0.99,线性关系良好。

Figure 1. Standard curve for SDS concentration detection under different salt concentrations
图1. 不同盐浓度下SDS浓度检测用标准曲线
2.4. ZIF-8静态吸附SDS的实验
在干净锥形瓶中以NaCl溶液为溶剂配制8组SDS溶液,向每组SDS溶液中加入0.05 g ZIF-8,密封好后将锥形瓶放入摇床,在一定温度下、300 rpm条件下振荡30 min,然后立即用滤纸过滤悬浊液,测定滤液表面张力,利用图1中线性关系表达式计算出其中SDS的浓度。结合吸附前后SDS浓度的变化,得到ZIF-8对SDS的吸附量。ZIF-8对于SDS的吸附量(
,mg/g)根据式(1)计算得到:
(1)
式中,
(mg/L)代表吸附前SDS浓度,
(mg/L)代表吸附后SDS浓度,
(L)代表SDS溶液体积,W (g)代表加入的ZIF-8质量。采用经典的Langmuir等温吸附模型和Freundlich等温吸附模型对吸附过程进行拟合分析,两种模型的公式见式(2)和式(3):
Langmuir:
(2)
Freundlich:
(3)
式中,KL和KF分别代表Langmuir等温线常数和Freundlich等温线常数,
是非均一性因子代表了吸附强度的大小,
(mg/g)代表了最大吸附量。
2.5. ZIF-8动态吸附SDS的实验
利用动态吸附装置进行实验。在过滤柱内填充一定质量的ZIF-8作为吸附剂,用两片砂芯片固定。过滤柱外边套有玻璃保温套,通过与恒温水箱连接进行水循环达到保温的作用。过滤柱与外层玻璃保温套之间加入棉花起到加强保温和固定的作用。泵入20 mL盐水润洗ZIF-8并在一定温度下保温10 min。将一定浓度的SDS溶液通过注射泵以一定流速泵入过滤柱。收集一定体积滤液后测量表面张力,获取SDS浓度。采用Thomas模型对结果进行拟合计算,Thomas模型见公式(4):
(4)
为了便于计算将其线性化得到公式(5):
(5)
式中
(mL/(min·mg))代表了Thomas速率常数,反映了动态吸附效率。
(mg/g)代表了单位质量ZIF-8对SDS的动态吸附量,
(mg/L)和
(mg/L)分别代表了SDS起始浓度和t时刻滤液中SDS的浓度,
(g)代表ZIF-8的质量,
(mL/min)代表SDS溶液的注射速率。
2.6. ZIF-8吸附SDS前后表面化学研究实验
使用XPS检测吸附HPAM前后ZIF-8中氧元素和氮元素所处的化学环境。XPS的测试条件如下:单色Al Ka (h = 1486.6 eV),功率150 W,50 m束斑;结合能以C1s 284.8 eV校准。
3. 结果与讨论
3.1. ZIF-8吸附SDS的机理研究
3.1.1. ZIF-8 (氨水)吸附SDS热力学研究
固定水中SDS浓度为100 mg/L,NaCl浓度为1 wt%,改变温度进行ZIF-8 (氨水)静态吸附SDS实验,结果见图2。由图2可知,温度越高,ZIF-8 (氨水)的吸附量越大,50℃时吸附量为53 mg/g。采用Freundlich模型拟合不同温度下ZIF-8静态吸附SDS的数据,获得30℃、40℃和50℃下吸附指数n分别为1.325、1.379和1.432。三种温度下
值均大于1且随温度升高而变大,说明该吸附过程容易发生,升温有助于提高吸附效率。
利用不同温度下的吸附平衡常数KF,计算吸附过程中的吉布斯自由能变(
),焓变(
)以及熵变(
),计算结果如表1所示。由表1可以看出,
< 0且绝对值小于40 kJ/mol,表面ZIF-8 (氨水)吸附SDS是物理吸附过程;
> 0说明该吸附过程是吸热反应,故升温能够增加ZIF-8的吸附能力;
< 0是因为SDS的吸附伴随着水分子的脱附,对于整个体系而言,SDS吸附是熵减过程,而水分子脱附是熵增过程,当熵增过程的绝对值大于熵减过程的绝对值时,导致整个体系处于熵增的状态。结果表明ZIF-8 (氨水)吸附SDS是一个自发的吸热物理吸附过程,进一步解释了升温能够增加ZIF-8的吸附能力。
3.1.2. ZIF-8 (氨水)吸附SDS动力学研究
固定水中SDS浓度为100 mg/L,NaCl浓度为1 wt%,50℃下开展ZIF-8 (氨水)静态吸附实验,并在不同时间取样测定吸附量,实验结果见图3。如图可知,ZIF-8 (氨水)进入水体后开始吸附,随时间变化吸附量增加直到10 min后达到吸附平衡。用准一级速率方程以及准二级速率方程对结果进行拟合得到表2。

Figure 2. Static adsorption curve of ZIF-8 (ammonia water) to SDS at different temperatures
图2. 不同温度下ZIF-8 (氨水)对SDS的静态吸附曲线

Table 1. Thermodynamic parameters of ZIF-8 adsorption SDS
表1. ZIF-8吸附SDS的热力学参数
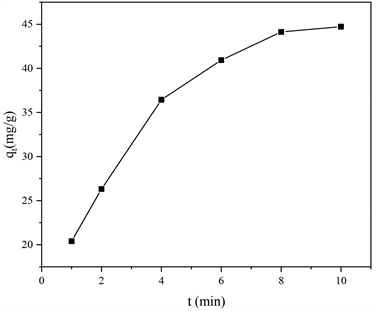
Figure 3. Adsorption kinetic curve of ZIF-8 (Ammonia)
图3. ZIF-8 (氨水)吸附动力学曲线
由表2可知,ZIF-8 (氨水)吸附SDS的过程更加符合准二级动力学方程,说明了吸附速率与SDS浓度的平方呈线性关系,并且拟合出的饱和吸附量也与实验结果相符为53.19 mg/g。

Table 2. Fitting results of the kinetic equation of the adsorption of HPAM by ZIF-8 (Ammonia)
表2. ZIF-8 (氨水)吸附HPAM的动力学方程拟合结果
3.1.3. ZIF-8 (氨水)吸附SDS前后表面性质研究
根据ZIF-8 (氨水)和SDS的分子结构特点,推测主要有以下两种作用力使得SDS吸附在ZIF-8 (氨水)的表面。第一种是ZIF-8 (氨水)上的Zn原子和SDS上的SO3−的螯合作用,因为Zn原子表面存在空轨道而SDS的磺酸根能够提供一对孤对电子,故能形成螯合键,该作用能通过观察XPS谱图O 1s拟合验证(见图4(a))。图中532 eV和531.1 eV是O的在Zn-OH和H2O中的电子结合能,吸附SDS后的ZIF-8 (氨水)发生水化,Zn-OH的比例增加,因此Zn-OH的峰面积上升,导致水分子中O的结合能下降,峰面积下降。在534 eV是所吸附SDS上磺酸根的结合能,说明ZIF-8 (氨水)吸附了SDS。第二种是ZIF-8 (氨水)水化后咪唑环的上C=N-C会通过质子化形成C=NH+-C和C-NH2+-C,而NH+能和SDS上的
产生静电吸引作用,该作用能通过观察XPS谱图N 1s拟合验证(见图4(b))。图4中398.3 eV,398.8 eV和399.2 eV分别是咪唑环上-N=,-C=NH+-和
的N的结合能,在吸附SDS后,ZIF-8 (氨水)在400.7 eV处出现了-N-O-SO2-R的电子结合能,说明了ZIF-8 (氨水)通过NH+和SDS通过螯合作用产生吸附。

Figure 4. XPS scanning spectrum of O1s and N1s on ZIF-8 (ammonia water) before and after adsorption
图4. 吸附前后ZIF-8 (氨水)上O1s和N1s的XPS扫描谱图
4. 结论
通过对ZIF-8 (氨水)吸附SDS的吸附机理研究可知,与Langmuir吸附模型相比,ZIF-8 (氨水)吸附SDS的过程更符合Freundlich吸附模型,n大于1说明容易发生吸附。ZIF-8 (氨水)吸附SDS的过程是自发吸热的物理吸附过程,动力学上符合准二级动力学模型。ZIF-8通过静电作用,
和SDS磺酸根的螯合作用两种作用力起到吸附SDS的效果。
NOTES
*第一作者。
#通讯作者。