1. 引言
本氏烟草(N. benthamiana)是一种原产于澳大利亚北部地区的一种茄科烟草属的植物,于1837年首次被Benjamin Bynoe发现并采集。自发现以来,本氏烟草因其叶片的易感染性与免疫和防御信号功能,被作为植物病毒学中的典型物种 [1] ,同时它也是病毒诱导的基因沉默(virus-induced gene silencing, VIGS)实验的植物生物反应器。在Gene Bank中可获得16,000个本氏烟草的单个基因序列,通过序列对比分析发现烟草与其他物种在24个基因上具有直系同源性 [2] 。
目前植物瞬时表达技术已经被广泛利用,该体系具有操作简便,安全性更高的特点,是迄今为止分子生物学研究中应用最广泛的方法 [3] ,主要用于研究外源基因的表达、蛋白质间的互作、转录因子与顺式作用元件的互作、启动子功能分析、蛋白的亚细胞定位等方面 [4] 。但是仍有一些技术问题尚未解决,如目前大部分研究仅处在叶片组织层面,农杆菌本身对植物抗病性有一定影响 [5] ;在体外表达蛋白质过程中,并非所有的核糖体都能翻译表达全长蛋白,此过程可能影响抗体与蛋白的结合,甚至难以筛选到结合的抗体 [6] 。
β-葡萄糖苷酸酶(GUS)是一种以β-葡萄糖苷酸酯类物质为底物的水解酶,其产物可通过组织化学法、分光光度法和荧光法等多种方法检测 [7] 。多数植物体内无内源的GUS,而通过外源导入GUS基因所表达出的GUS在植物体中可保持稳定和良好的活性。
MADS-box转录因子RIN是番茄果实成熟的主要调控因子。通过染色质免疫沉淀法,现已证明RIN在番茄果实的成熟过程中与大量启动子结合调控基因的表达 [8] ,而且RIN基因控制单隐性遗传性状 [9] 。近几年,rin突变体逐渐发展为研究果实成熟机理的重要材料。rin突变体果实在室温下可贮藏两个多月,果实在转色期采下贮藏,品质与正常番茄相近,但是最终果实仍然呈现绿色,这就要求在今后的育种过程中要改善rin突变体果实颜色缺陷,提高其商品性 [10] 。
以农杆菌介导的烟草瞬时表达体系主要是利用农杆菌Ti质粒上的T-DNA(transfer DNA)的复制转移并整合到植物细胞的基因组中的特性,通过构建含有T-DNA片段中带有外源基因的载体,进而通过农杆菌介导,瞬时表达T-DNA中编码的基因,进行植物细胞的转化。通常2~3天后即可检测到外源基因的表达。目前常用载体有pMOG800、pBI121等,常用的农杆菌主要有GV3101、LBA4404、EHA105、AGL1等。目前,瞬时表达体系已在多个物种间逐渐建立 [11] ,并已成功应用于多种植物,如草莓 [12] 、拟南芥、莴苣 [13] 、玉米 [14] 和黄瓜 [15] 等,更适用于基因–蛋白的相关细胞生物学研究。有实验表明,将LB培养基上活化后的农杆菌以10%接种量重新接种到新的培养基上有利于提高蛋白的表达量 [16] 。本研究以pCAMBIA-35S-35S-FMF-GUS和pCAMBIA-35S-35S-FMF-RIN为载体,采用农杆菌注射侵染的方法,以GUS基因和RIN基因作为报告基因,检测了不同农杆菌侵染浓度对瞬时表达效率的影响,优化了烟草叶片中的基因瞬时表达体系,高效表达了GUS基因及RIN基因。
2. 材料与方法
2.1. 烟草材料
本氏烟草(Nicotiana benthamiana)种子。
2.2. 菌株与载体
农杆菌(Agrobacterium tumefaciens)菌株GV3101,植物表达载体pCAMBIA-35S-35S-FMF-GUS (图1)、pCAMBIA-35S-35S-FMF-RIN (图2)。
2.3. 主要生化试剂
吗啉乙磺酸MES、乙酰丁香酮ASG、卡那霉素(Kanamycin) (50 mg/ml)、庆大霉素(Gentamicin) (50 mg/ml)、利福平(Rifampicin) (50 mg/ml)、一抗Anti-c-myc Rabbit、Anti-Plant-Actin Rabbit Polyclonal Antibody、二抗Anti-Rabbit IgG HRP均购于Sigma公司,PVDF膜购于Millipore公司,ECL发光液购于普利莱公司。MgCl2为国产化学纯。
2.4. 仪器
Trans-Blot SD半干转印槽购于BIO-RAD公司,P4蛋白垂直电泳仪DYCZ-25E型购于北京市六一仪器厂,X-OMAT BT医用X-光片购于柯达公司,X射线摄影暗夹购于粤华公司,易杰膜购于EASYBIO公司。
2.5. 方法
选取饱满烟草种子,4℃用水浸泡48 h,播种于土壤中,在(26 ± 1)℃、16 h/d光照的培养箱中培养。约25天后待其为五叶或六叶期时取其植株中较宽大平坦的叶片用于实验。
分别将含有pCAMBIA-35S-35S-FMF-GUS、pCAMBIA-35S-35S-FMF-RIN质粒的GV3101农杆菌进行活化。用已灭菌的1 ml枪头挑取农杆菌加入LB培养基(含50 mg/L卡那霉素,100 mg/L利福平,100 mg/L庆大霉素)中,28℃下,200 rpm培养过夜。吸取60 μl菌液加入3 ml LB液体中,按比例加入2-(N-吗啡啉)-乙磺酸(MES,工作浓度10 mM)、乙酰丁香酮(ASG,工作浓度20 μM)、卡那霉素(工作浓度50 mg/L),利福平(工作浓度100 mg/L)和庆大霉素(工作浓度100 mg/L) (表1)。于28℃,200 rpm培养过夜。第二天收集菌体,4℃下,5000 ×g离心5 min,去除上清液,留菌体。将不同量的菌体悬沉在侵染液(10 mM的MES,200 μM乙酰丁香酮,10 mM氯化镁)中,配制3种不同浓度梯度的农杆菌菌液(OD600 = 0.2,1.0,2.0),室温下静置培养3 h后待用。
用已消毒的1 ml注射器,取其针头,在烟草植株叶片背面扎2~3个孔,用无针头的针管注射叶片,依靠压力将菌液注入叶片的叶脉之间。注射完毕后,置于22℃人工培养室中培养两天。
收集不同农杆菌浓度(OD600 = 0.2,1.0,2.0)下注射的烟草样本,各取300 mg烟草叶,低温(液氮)下研磨成粉末状,用等体积4 × Protein SDS extracting Buffer溶解,95℃加热10 min,6000×g离心3 min,
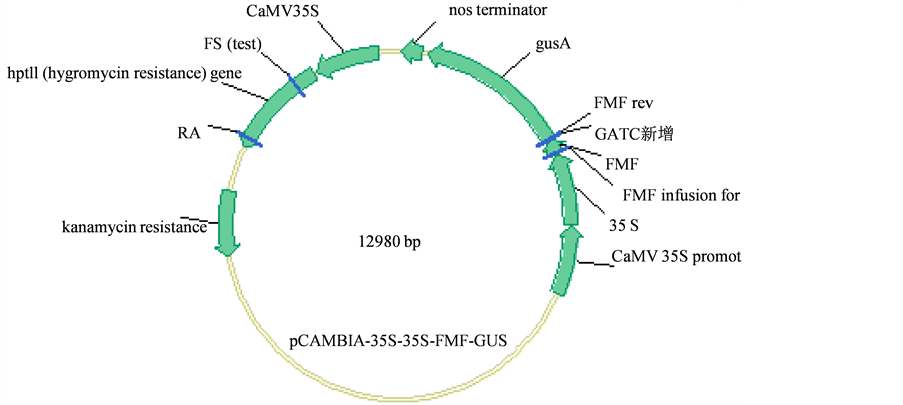
Figure 1. Construction of pCAMBIA-35S-35S-FMF-GUS
图1. pCAMBIA-35S-35S-FMF-GUS构建示意图

Figure 2. Construction of pCAMBIA-35S-35S-FMF-RIN
图2. pCAMBIA-35S-35S-FMF-RIN构建示意图
表1. 各试剂浓度
取上清液,置于−20℃保存。
按照分离胶12%,浓缩胶4%的浓度配制电泳胶,加入浓缩胶后插入梳齿,待胶凝固后放入电泳仪中,加入蛋白电泳缓冲液,拔出梳齿,以120 V电泳90 min。
电泳结束后,切去浓缩胶,量取剩余电泳凝胶胶部分的长宽,按照比电泳凝胶面积略大的尺寸剪裁PVDF膜及滤纸,按照四层滤纸–PVDF膜–胶–四层滤纸的顺序铺好,用半干式转移装置将蛋白质转移到PVDF膜上,根据凝胶面积按0.7 mA/cm2电流转移70 min。将脱脂奶粉与washing buffer按照1:20 (m/V)配制封闭液(TBST),将PVDF膜转移至装有封闭液的盒子中,置于室温下脱色摇床振荡封闭2 h,之后将封闭液倒掉。将一抗(anti-c-myc)用(washing buffer)稀释(1:5000 V/V)之后,加入装有PVDF膜中的盒子中,摇床常温振荡2 h。倒出一抗液,加入washing buffer,洗膜10分钟,重复洗膜三次。配制二抗(anti-Rabbit)稀释液(1:5000 V/V)并加入封闭盒中,重复上述振摇及洗涤步骤。
将ECL发光液加到PVDF膜上,放入压片夹中,静置3 min。将压片夹移入暗室,把医学X胶片放在PVDF膜上,关上压片夹,曝光3 min。结束后,将胶片取出放入显影液中静泡15 s,之后放入定影液中静泡15 s,取出X胶片观察显色情况。用扫描仪扫描X胶片,并分析目标带是否出现。
3. 结果与分析
3.1. RIN基因瞬时表达结果
蛋白印记结果(图3)表明,注射3种菌液浓度的烟草叶片均能表达出RIN蛋白,但不同浓度的农杆菌诱导基因瞬时表达的水平不同;总体上,RIN蛋白表达量随农杆菌菌液浓度增大而呈增强趋势。在内参蛋白Actin基本表达一致的情况下,当OD值分别为1.0和2.0浓度时,RIN瞬时表达水平明显高于农杆菌浓度为0.2时的表达水平。但是,1.0与2.0浓度下,RIN蛋白表达量相差不大(图3)。
3.2. GUS基因瞬时表达结果
同样,对于GUS基因,图4表明菌液浓度为1.0和2.0的瞬时表达水平高于侵染浓度为0.2,而且,1.0时的表达效果比2.0的更佳,表明高浓度农杆菌可能会影响基因瞬时表达。
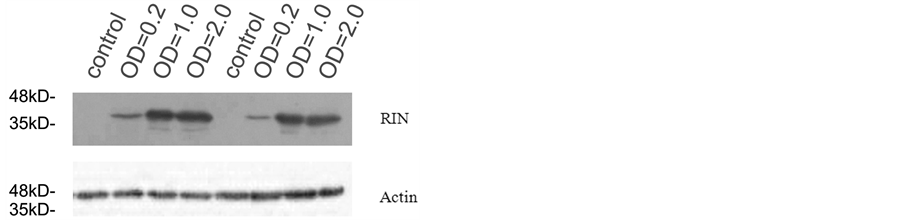 anti-c-myc抗体检测RIN基因,以Actin蛋白作为内参。
anti-c-myc抗体检测RIN基因,以Actin蛋白作为内参。
Figure 3. Effects of optical density of Agrobacterium to RIN expression
图3. 烟草中不同农杆菌侵染浓度对RIN瞬时表达的影响
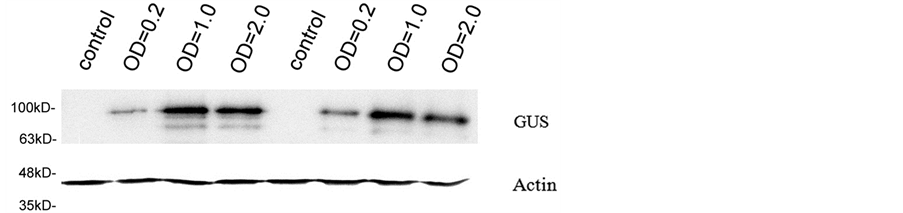 anti-c-myc抗体检测RIN基因,以Actin蛋白作为内参。
anti-c-myc抗体检测RIN基因,以Actin蛋白作为内参。
Figure 4. Effects of optical density of Agrobacterium to GUS expression
图4. 烟草中不同农杆菌侵染浓度对GUS瞬时表达的影响
综上所述,本实验设置了3个农杆菌菌液浓度(OD600 = 0.2、1.0、2.0),分别表达了GUS、RIN两种基因,检测了不同菌液浓度下蛋白表达量的大小。研究结果表明,GUS以及RIN的最佳顺时表达水平的农杆菌菌液浓度为OD6001.0。
4. 讨论
本实验以农杆菌为介导,以GUS和RIN为报告基因,通过检测蛋白表达量,探索了烟草叶片中农杆菌菌液浓度对基因瞬时表达的影响及最佳诱导菌液浓度。如图3和图4,菌液浓度过低时,农杆菌数目偏少,会使瞬时表达率降低;而农杆菌密度过大时,叶片细胞中农杆菌的结合位点是有限的,农杆菌之间过于激烈的竞争不利于菌体与植物细胞的结合,同时过高的菌液浓度会对烟草造成较大的毒性伤害,影响基因瞬时表达率 [17] 。因此寻找适合的侵染条件是十分必要的。我们的实验结果表明,农杆菌菌株GV3101的侵染浓度为OD600 = 1.0时,瞬时表达效果最好。目前其他研究也发现在多种植物中建立的瞬时表达体系与植物材料的遗传背景、生长状态和农杆菌的菌株和侵染浓度等都有关系[18] 。本研究以在细胞质中表达的GUS基因以及在细胞核中表达的RIN基因为报告基因,研究在烟草叶片中统一进行的蛋白瞬时表达系统,探寻烟草叶片中蛋白瞬时表达时最佳农杆菌菌液浓度,为蛋白亚细胞定位、外源基因的表达、蛋白质间的互作、转录因子与顺式作用元件的互作、启动子功能分析、蛋白功能的研究提供了简便快捷的方法。
致谢
本论文由国家自然科学基金31471921、“中央高校基本科研业务费专项(2014RC006)资金”和中国农业大学本科生科研训练计划(URP)共同资助,感谢杨永芳、于童童、王恬、李冉、李蕊对本实验的技术支持。