1. 引言
明确烟草病毒病的传播途径是控制烟草病毒病害的重要环节。TMV主要靠病汁液侵染微伤口传播,在农事操作中沾染病株汁液的手或工具通过接触幼苗的微伤口的侵入 [1] 。种子带毒 [2] ,混有病残体的肥料、土壤和田间带病的其他植物及野生植物,丢弃在烟田的带病烟顶、烟杈、烟根、烟叶等都可以成为病害的初侵染源。有研究指出,在漂浮育苗过程中,被TMV污染的漂浮盘、基质和营养液不是TMV在漂浮育苗期间传播的主要途径,但却是病毒病传播的主要初侵染源 [3] 。这些初侵染源及移入大田的带病烟苗,通过各种摩擦接触引起再侵染,使病害在田间大面积发生。另外,地下害虫危害严重的烟田病毒病发生相对严重。土壤中的病残体传播病毒一直被视为转播TMV的途径之一,但至今鲜有试验明确证明这一途径的存在,也没有关于土壤病残体传播TMV效率的报道。本文通过田间试验和室内试验充分证实土壤病残体可以传播TMV,并分析了其传播效率。对今后采取合理的控制烟草普通花叶病毒病措施提供了借鉴。
2. 材料与方法
2.1. 供试品种
云烟87。
2.2. 供试试剂
琼脂糖(Sangon),DNA纯化试剂盒(BioFlux),DNA marker (BioFlux),pGEM-T easy Vector system (Promega),限制性内切酶(Promega),Ex-Taq DNA 聚合酶(Takara),Taq DNA聚合酶(Takara),DNA琼脂糖凝胶回收试剂盒(Tiangen),EASY spin植物RNA快速提取试剂盒(Aidlab),E. Z. N. A. TMSoil RNA Kit (OMEGA),pGEM-T载体(TIANGEN),反转录试剂盒(TaKaRa),引物(大连宝生物),LB培养基,氨苄青霉素(Ampicillin, Amp):100 mg/mL水溶液,−20℃保存,X-Gal:20 mg的x-gal溶解于1 mL二甲基甲酰胺中,−20℃避光保存,大肠杆菌(Escherichia coli) DH5α。
2.3. 主要器材
高速冷冻台式离心机 5417R (Eppendorf),高速常温台式离心机 5415D (Eppendorf),紫外分光光度计 UV-2201 (Bio-RAD),PCR S1000TM Thermal cycler (Bio-RAD),电泳仪DYY-6C (北京六一),恒温摇床,电子天平,超净工作台,恒温水浴锅,SZ-1快速混匀器。
2.4. 试验场所
试验在湖南省郴州市桂阳县梧桐村汪山组郴州市烟草公司实验基地和西南大学植物保护学院温室进行。
2.5. 田块及烟苗选择
选择土壤肥力中等,远离村庄,周围无其他作物种植,前一年烟草TMV发病严重的田块,清除田间、田边杂草及烟草残留物;选用由当地烟农温室大棚培育的,长势均匀、良好,且无毒的云烟87烟苗。
2.6. 小区设计
设计制作10个防虫网;烟草还苗期过后,对部分烟苗喷施杀蚜虫的药剂,喷施药剂后,罩上防虫网,每个防虫网罩3株,共30株,作为一个实验组(如图1),分别是:A1-1、A1-2、A1-3;B1-1、B1-2、B1-3;C1-1、C1-2、C1-3;D1-1、D1-2、D1-3;E1-1、E1-2、E1-3;A2-1、A2-2、A2-3;B2-1、B2-2、B2-3;C2-1、C2-2、C2-3;D2-1、D2-2、D2-3;E2-1、E2-2、E2-3。另设5株不罩防虫网作对照(A3、B3、C3、D3、E3)。
实验室设3个处理,处理1:带毒土壤上种植6株烟;处理2:不带毒土壤上种7株烟;处理3:不带毒土壤上种6株烟。
2.7. 样品采集
于3月下旬,加网之前,采集袋收集每株烟根基10~15 cm土壤编号,带回实验室用于分子检测;
于4月中旬,当地烟草病毒病高发期,加网之后,采集叶片,叶片样品采集编号,带回实验室进行分子检测。
2.8. 样品检测
取少许采集到的土壤样品,盛放在培养皿中,25℃恒温培养箱烘干,每隔一小时上下翻动一次,直至土样完全干燥。称取0.2 g干燥土壤,液氮中快速充分研磨至细粉末状,盛放在15 mL的离心管中,按照E.Z.N.A. TMSoil RNA Kit操作步骤提取土壤总RNA;叶片样品用EASY spin植物RNA快速提取试剂盒,提取得到RNA;

Figure 1. Field pest control network Settings
图1. 田间防虫网设置
用反转录试剂盒(TaKaRa):1.5 × Prime Script Buffer(for Real Time)*, 2 ul → Prime Script RT Enzyme Mix I*, 0.5 ul → OligodT Primer (50 μM), 0.5 ul → Random 6 mers (100 μM), 0.5 ul → Random 6 mers (100 μM), 0.5 ul → 5. RNase Free dH2O, 4 ul → RNA模板,2.5 ul,将上步中所得土壤RNA反转录,得到cDNA。
高速常温台式离心机离心后,PCR仪中37℃~15 min,85℃~20 s,15℃停止保存,得到cDNA;
以反转录得到的cDNA为模板,采用根据TMV外壳蛋白设计的引物TMVR\F,体系及反应条件如下:取以无菌PCR管(0.2 ml),依次加入下列试剂后,加双蒸水(ddH2O)至25 ul。
PCR反应试剂及用量:10 × Taq buffer,2.5 ul;dNTP mix1.5 ul;MgCl2,1.5 ul;cDNA,1 ul;上游引物,0.5 ul;下游引物,0.5 ul;Ex Taq酶,0.25 ul;ddH2O,17.25 ul。
实验操作中PC反应条件见表1,反应结束后,取5 ul反应产物,1%琼芝糖凝胶,水平电泳仪,电泳35 min,检测扩增结果。
2.9. 分子克隆
2.9.1. PCR产物的回收纯化
实验准备50℃恒温水浴锅、65℃~70℃恒温水浴锅、刀片、酒精灯、镊子
(1) 将吸附柱CB2放入收集管中,向吸附柱中加入500 μL平衡液BL,高速常温台式离心机,12,000 rpm (~13400 g),离心1 min,弃废液,将吸附柱重新放入收集管中。处理过的柱子要确保当天使用;
(2) 用刀片将单一的DNA片段,从琼脂糖凝胶中切下,尽量切除多余部分,用镊子夹取放入干净的离心管中,放到电子天平中称取重量;
(3) 向胶块中加入PC溶液,一般已没过胶块为止,天平称量,确保等量;若胶块过大,可将胶块切成碎块。将离心管放入50℃恒温水浴锅放置10 min左右,在此期间不断轻缓的上下翻转离心管,确保胶块充分溶解;
(4) 将(3)中得到的溶液加入处理过的吸附柱中(吸附柱放入收集管中),12,000 rpm (~13,400 g),离心1 min,弃废液,将吸附柱重新放入收集管中;
(5) 向吸附柱CB2中加入600 μL漂洗液PW,室温静止2~5 min,漂洗液在使用之前,注意检查是否已加入无水乙醇,12,000 rpm (~13,400 g),离心1 min,弃废液,将吸附柱重新放入收集管中;
(6) 重复操作步骤(5)
(7) 将吸附柱放入收集管中,12,000 rpm (~13,400 g),离心2 min,尽量洗去漂洗液。将吸附柱室温放置数分钟,直至彻底晾干;
表1. PC反应条件
(8) 将吸附柱CB2放入一个经过高压蒸汽灭菌的干燥的离心管中,向吸附柱中间吸附膜的中间位置悬空滴加不少于30 μL的ddH2O (ddH2O需在65℃~70℃恒温水浴锅提前预热),室温放置2 min,12,000 rpm (~13,400 g),离心2 min;
(9) 吸出离心管中的液体,重新悬空滴加到吸附膜的中心位置,室温静置2 min,12,000 rpm (~13,400 g),离心2 min,收集DNA溶液。
2.9.2. PCR产物的连接
去无菌PCR试管(0.2 ml),一次加入下列试剂后,离心机中混匀,4℃恒温冰箱中过夜。实验操作中PCR产物的连接试剂及用量见表2。
2.9.3. PCR回收产物的转化
准备工作:LB + Amp固体培养基,LB液体培养基,100 μL感受态细胞,42℃恒温水浴锅,超净工作台,冰。
(1) 将100 μL感受态细胞放置于冰上,待完全解冻,轻摇试管至细胞均匀悬浮;
(2) 将5 μL连接液加入50 μL感受态细胞中,用枪头轻轻将其混匀,冰上放置30 min;
(3) 42℃恒温水浴锅热击90 s,冰上放置3~5 min;
(4) 取出4℃冰箱内盛装LB液体培养基三角瓶,瓶口放置在酒精灯的火焰上方微热,向试管中加入500 μL LB液体培养基,37℃恒温摇床,225 rpm, 60 min;
(5) 摇菌的过程中,将16 μL的IPGT诱导物、40 μL的X-gal显色底物(黄色)(两种试剂均放置−20℃冰箱保存),均匀涂抹在LB + Amp固体培养基平板上;
(6) 菌液摇好后,3500 rpm,离心5 min,倒掉上清液,留100 μL液体,将留下的液体混匀,均匀的涂抹在LB + Amp固体培养基平板上;
(7) 平板LB + Amp固体培养基用封口膜封口,37℃恒温培养箱,正向放置1 h,然后倒置过夜培养10~12 h。
2.9.4. 挑选单克隆
(1) 取出过夜培养过后的平板,平板上会显示蓝白斑,如若蓝白斑显示不明显,可先将平板放置4℃数小时,待蓝白斑显示明显;如若蓝白斑较小,需继续37℃恒温培养箱培养,直至蓝白斑适中为止;
(2) 超净工作台中(超净工作台使用前紫外灯开启灭菌20 min左右),向灭菌的干燥的2 mL离心管中加入1 mL的LB + Amp液体培养基;
(3) 超净工作台中,用白色枪头挑取平板上白色单斑,挑斑时,要确保斑是白色的,且为单个斑;将枪头打入(2)中2 mL离心管中,密封;
(4) 将(3)中离心管包扎好,放置在37℃恒温摇床中,225 rpm, 5~6 h;
(5) 待菌液浑浊,即可取出离心管,按照前文PCR体系及条件,进行菌液检测;

Table 2. Connection reagents and dosage of PCR products
表2. PCR产物的连接试剂及用量
2.10. 室内温室实验
(1) 实验温室的条件参数设置:玻璃加PC板温室,跨度:9.6 m/10.8 m/12 m/定制;肩高:4 m~5 m;顶高:5.5 m~6.5 m;开间:4 m/8m,配套系统:喷灌系统/内遮阳系统/升温系统/湿帘风机系统//侧开窗系统//苗床系统等
(2) 选用无毒、包衣、云烟87种子,实验室温室内,用无菌土培育烟苗;
(3) 待烟苗长出3片叶时,移栽到实验室用小盆中,一盆一株,根据土壤的不同,设置3组实验:处理1:从实验基地采集的,检测出带有TMV的土壤;处理2:从基地采集的,检测出带有TMV的土壤,经过高温高压灭菌后作为烟苗种植土壤;处理3:用实验室无菌土作为烟草种植土壤。
(4) 温室内生长2个月后,采集每株叶片,检测TMV
(5) 叶片RNA的提取
准备工作56℃恒温水浴锅、70℃~80℃恒温水浴锅、无水乙醇、1.5 mL离心管、高速冷冻台式离心机(4℃)、超净工作台
称取0.1~0.2 g烟叶样品,放入已高温高压灭菌过的研钵中,加入液氮,充分研磨至细粉末状;
将500 μL RLT和50 μL RLANT aid加入1.5 mL离心管中;
将粉末状的样品加入离心管内,用快速混匀器剧烈震荡20 s,然后放入56℃恒温水浴锅3 min;
水浴后,涡旋30 s;
放入高速冷冻台式离心机(4℃)中,13000 rpm,10 min,离心后,将上清液转移至一新离心管中,向离心管中加入0.5体积的无水乙醇;
将离心管中液体吸出,加入吸附柱中(小于750 μL),高速冷冻台式离心机(4℃), 13,000 rpm, 2 min,弃废液;
向吸附柱中加入700 μL去蛋白液RW1,室温放置30 s,高速冷冻台式离心机(4℃), 13,000 rpm, 30 s,弃废液;
向吸附柱中加入500 μL漂洗液RW(使用前注意检查是否已添加过无水乙醇),高速冷冻台式离心机(4℃), 12,000 rpm, 30 s,弃废液;
重复一次上一步骤;
将吸附柱放入收集管中,高速冷冻台式离心机(4℃), 13,000 rpm, 2 min,弃废液;
将吸附柱放入一新1.5 mL离心管中,室温放置1 min,向吸附膜上悬空滴加30~50 μL RNase free water(提前放置到70℃~80℃水浴锅中),高速冷冻台式离心机(4℃), 12,000 rpm, 1 min;
将离心管中液体吸出,重新滴加至吸附膜上,重复操作一次;
弃吸附柱,收集样品,去2 μL样品,电泳检测。
(1) 反转录按照前文所述步骤,以RNA为模板进行反转录,得到cDNA
(2) PCR按照前文所述步骤,以cDNA为模板,进行PCR反应
(3) PCR反应结束后,进行电泳检测
(4) 统计分析实验结果
3. 结果与分析
3.1. 田间样品检测结果
(1) 提取的土壤(见图2)、叶片(见表3)RNA经反转录,TMV特异性引物PCR扩增后,1%的琼脂糖凝胶电泳,成像后,图片中的大小750 bp的特异性条带,清晰明亮,与目标片段大小一致,阳性条带清
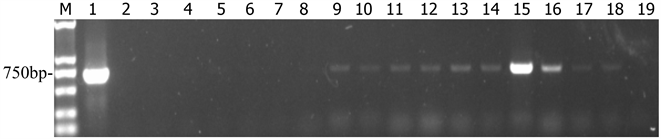
Figure 2. BM2000; 1: positive; 2 - 18: sample; 19: negative
图2. BM2000; 1:阳性;2~18:样品;19:阴性
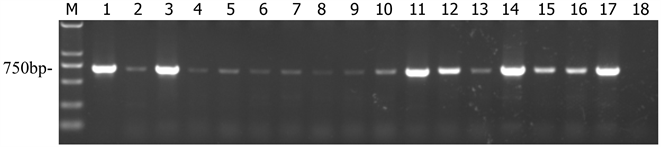
Figure 3. BM2000; 1: positive; 2 - 17: sample; 18: negative
图3. BM2000; 1:阳性;2~17:样品;18:阴性
晰,阴性无条带。
(2) 经过对35个土壤样品,以及每个土壤样品相对应的35株烟叶片检测(见表3)。35个土壤样品中,有25个检测出TMV,其中罩防虫网的22个,不罩防虫网3个,TMV检出率为71.43%,土壤带毒率较高。相对应的烟株,罩防虫网30个样中有22个样品检测出TMV,有19株为根基土壤带毒植株;不罩网处理的5个样中,有4个样品检测出TMV,其中有3株对应根部土壤带毒,有1株为根基土壤不带毒,以25株土壤根基带毒为总体,则带毒土壤传播TMV的传播率为88.0%。另外10株根基土壤不带毒的,有4株也携带有TMV病毒,分别是C1-3、A2-2、C2-2、C3,可能为植株之间相互摩擦而传播的。也有3株根基土壤带毒,而烟株不带毒,分别是E1-1、C2-1、D2-3,可能个体烟株抵抗力强或未造成伤口而未感染病毒。经过样品的检测结果认为,土壤携带TMV后,对烟株有较高比例的传播率。
3.2. 温室试验样品检测结果
为了进一步印证田间试验所得的结果,还进行了实验室试验。本实验对温室内处理1 (见图4),处理2 (见图5),处理3 (见图6),植株叶片进行RT-PCR检测,电泳图结果显示,处理1带毒土壤中试验组6株植株,有5株检测出TMV目标条带,传播率83.33%;处理2 (不带毒土壤) 7株植株,有2株显示出TMV目标条带;处理3 (不带毒土壤) 6株植株,有2株显示TMV CP目标条带;实验均在温室内进行,隔绝外界传播条件的干扰,只有处理1的土壤中含有TMV毒源,由实验结果可以看出处理1传毒很明显;处理2、3虽均有植株检测出TMV,但发病率较低,分别只有2株。分析原因,可能是其他人员进行温室实验的时候,有碰到过该植株叶片,摩擦传播,或昆虫传播。
综合大田、温室内试验结果,可以得出,土壤带TMV毒源对TMV有较高传播率。
4. 结论与讨论
(1) 董红红 [4] 研究认为除TMV和CMV可以通过土壤传播外,PVY也可以通过土壤传播,仅TMV存活时间最长,TMV在土壤中至少可以存活5个月,而CMV和PVY在土壤中的存活时间相对较短。TMV可以通过土壤传播与研究结论一致。

Table 3. Samples of field soil and corresponding tobacco plant TMV test results
表3. 田间土壤样品及对应烟株TMV检测结果
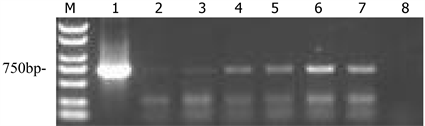
Figure 4. BM2000; 1: positive; 2 - 7: sample; 8: negative
图4. BM2000;1:阳性;2~7:样品;8:阴性
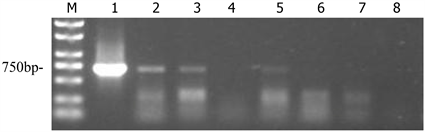
Figure 5. BM2000; 1: positive; 2 - 7: sample; 8: negative
图5. BM2000;1:阳性;2~7:样品;8:阴性

Figure 6. BM2000; 1: positive; 2 - 8: sample; 9: negative
图6. BM2000;1:阳性;2~8:样品;9:阴性
(2) 用分子生物学的方法对烟草TMV常发土壤及对应烟株进行了TMV检测,并明确了土壤是TMV传播途径,对TMV是否会由土壤传播得出了肯定的依据,为生产实际中防控TMV有现实的指导意义。
基金项目
湖南省烟草公司重点科研项目(项目编号:14-16ZDAa02)。