1. 引言
赤潮是当今全球海洋的一大公害。伴随沿海地区经济的发展,近海赤潮发生的频率越来越高,出现的范围和危害程度也越来越大,由赤潮引起的生态环境破坏问题日益严重,已经成为当今世界普遍关注的海洋生态环境问题 [1] 。受注入的几条主要河流,如北部的长江和钱塘江,以及来自南方的台湾暖流及夏季的偏南风等的影响,浙江沿海水动力环境复杂,水体中营养盐和生物量都较高,是我国赤潮灾害最为频发和严重的海域 [2] 。我国最早赤潮记录就是1933年发生在浙江沿海的夜光藻赤潮。根据浙江省海洋与渔业局公布的《浙江省海洋环境公报》(2000~2010年)和相关文献资料,2000~2010年,浙江海域共记录到赤潮316次,累计面积超过了9.1万km2。其中,有毒有害赤潮累计57次,累计面积超过2.2 km2。11年间赤潮灾害给浙江造成的直接经济损失累计超过了2.43亿元。尤其值得关注的是近年来有毒赤潮的发生呈现出快速增长的态势,对人民生命健康与海洋生态环境造成了长期潜在的不利影响,同时给海洋经济可持续发展战略带来了极大的威胁 [3] [4] [5] 。
赤潮藻类的生长和增殖,除了与环境因子有密切关系外,还与周围的微生物有密不可分的联系。在赤潮藻生消过程中伴随着许多微生物的共同作用。海洋细菌同藻类在时空上紧密地结合在一起,它们分别能合成不同类型的代谢物,而这些代谢物又能对双方分别产生有利或有害的影响 [6] ,细菌代谢物能特异地阻碍甚至中止藻类的繁殖 [7] ,同时也可能促进藻类的增殖,在其中可能存在着某种反馈机制在控制藻类和海洋细菌种群动力学过程中起着重要作用。
海洋环境中绝大多数微生物都是处于未可培养的状态,影响了对环境微生物的深入研究 [8] 。在众多的微生物中只有不到1%的微生物能够通过培养的方法分离出来 [9] 。因此,这种传统的平板培养方法只能作为一种辅助工具,需要结合现代生物技术方法才能更客观而全面地反映微生物群落结构的真实信息。随着近几年分子生物学技术的普及,从DNA水平研究微生物的多样性已成为当前研究最主要的技术手段,并推动了微生物海洋学的快速发展 [10] 。本文采用基于MiSeq高通量测序平台对赤潮发生时水体微生物多样性进行了全面深入的调查。并应用多种统计软件等常用群落分析工具,对微生物群落与环境因子的潜在联系进行了深入研究,以期为我国近海生态研究与环境管理提供技术支撑。
2. 材料与方法
2.1. 采样概况
根据浙江省舟山海洋生态环境监测站对浙江海域常年的监测结果:每年的春、夏之交为浙江海域赤潮灾害的高发期,高发频发海域主要集中在嵊泗海域、东极海域、朱家尖海域、象山港、渔山列岛、台州列岛以及南麂列岛附近海域。2018年6月使用专业海洋环境调查船“浙海环监”号对上述海域海洋生态环境巡视性调查。根据历年来赤潮现场发生情况,共设12个站位,调查站位的具体位置见图1所示。调查过程中在渔山列岛海域疑似有赤潮发生。现场水体呈深褐色,以块状分布,伴有腥臭味。

Figure 1. Sampling sites of high frequency area of red tide in Zhejiang sea area
图1. 浙江海域赤潮监测点位图
2.2. 采样及分析方法
生态环境调查:调查海域生态环境各参数采样分析及浮游植物分析方法如表1所示。

Table 1. Analyzing methods and equipment of marine ecological environmental investigations
表1. 海洋生态环境调查分析方法及仪器设备
2.3. 微生物群落分析
在赤潮发生区域及附近海域采样水样,开展微生物群落分析。总DNA采用TIANGEN TIANamp Soil DNA Kit试剂盒提取,按标准流程操作。测序样品交由杭州晶佰生物科技有限公司按照16S宏基因组测序标准流程构建环境微生物16S rRNA基因V3-V4可变区(引物序列:341F-CCTACGGGNGGCWGCAG;805R-GACTACHVGGGTATCTAATCC)测序文库并进行相应的质量控制,应用Illumina MiSeq双末端(250 bp × 2)测序平台完成序列测定。具体实验操作、质量控制及序列分析方法参考文献 [11] 。
2.4. 数据处理
海水环境各环境因子及浮游植物分析结果,使用ODV4.0软件绘制各参数平面分布图。利用16S高通量测序结果,通过R语言绘制种类组成图和维恩图。
3. 结果
3.1. 海水水质
2018年6月调查海域进行了水环境调查,主要水质因子监测结果见表2。各因子的平面分布情况如图2所示。

Table 2. Statistical results of major monitoring indicators
表2. 海域主要指标监测统计结果
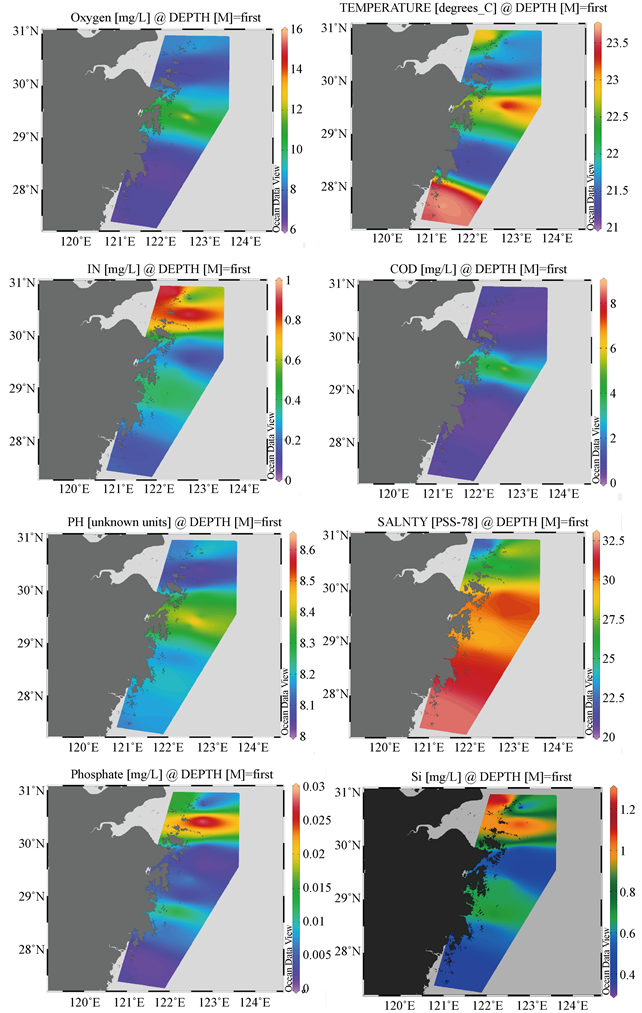
Figure 2. Distribution of main environmental factors
图2. 主要环境因子平面分布图
参照国家《海水水质标准》(GB3097-1997),所测参数中无机氮和活性磷酸盐是海水水质超标因子,其中无机氮浓度普遍较高,均值为0.414 mg/L,91.7%的样品超一类海水标准,平面分布上看,位于杭州湾口的北部海域无机氮含量明显高于其它区域;活性磷酸盐均值0.013 mg/L,其中41.7%样品超过一类海水标准,平面分布情况与无机氮呈同样趋势。其余各水质参数均没有超过一类海水标准 [12] 。
3.2. 浮游植物
本调查共鉴定浮游植物6门20科38属56种,其中硅藻30种,占53.6%;甲藻21种,占37.5%;金藻、裸藻、隐藻、针孢藻和鞭毛藻类各1种,各占1.8%。主要种类有Hillea sp.、东海原甲藻(Prorocentrum donghaiense)、中肋骨条藻(Skeletonema costatum)等。细胞丰度均值为1.03 × 105/L。叶绿素a含量均值为3.16 mg/m3,调查海域中部为叶绿素a含量的高值海域(图3)。其中在渔山列岛附近海域发现赤潮,在赤潮发生区域(J2018)叶绿素a含量为42.12 mg/m3,浮游植物细胞丰度为8.16 × 108/L,其中东海原甲藻丰度占98.5%,可以认为这是一次东海原甲藻事件(图4)。

Figure 3. Distribution of chlorophyll
图3. 海域叶绿素平面分布

Figure 4. Phytoplankton density of monitoring sites
图4. 各站位浮游植物细胞丰度
3.3. 微生物群落
3.3.1. 序列统计
采集赤潮发生海域测点(HAB01)和附近未发生赤潮海域测点(ZJ0205)表层水体微生物进行基于Illumina平台的高通量测序。共获微生物原始序列75451对(pair-end reads),序列平均长度为412 bp。经质量控制和序列优化,筛选出高质量序列77430条。考虑到各站位测序数据差异较大,本研究进行了进一步随机抽样将数据标准化,以平衡采样误差对后续分析的影响。原始序列通过预处理,按97%序列相似度进行划分,共得到595个OTU,其详细分布见表3。

Table 3. Summary of sequence information of marine sediment microbes
表3. 微生物序列信息统计
应用mothur软件对优化序列进行随机抽样,以抽到的序列数与它们的Chao1指数构建稀释曲线如图5所示。结果显示,各站位曲线均趋向平坦,说明本实验测序数量合理,OTU取样已达到或接近饱和,实验结果基本反映了样品的物种多样性。
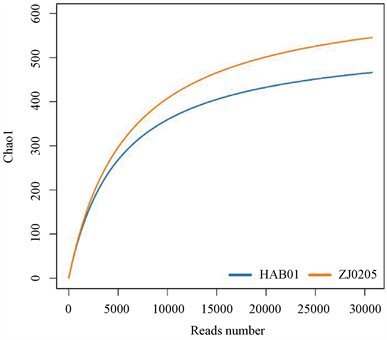
Figure 5. Rarefaction of marine sediment microbes
图5. 海域沉积物微生物稀释曲线
3.3.2. 微生物种类组成
本次调查共鉴定细菌16门82科126属。其中门分类水平上,变形菌门(Proteobacteria)是第一优势门类,其序列数占总数的38.4%;其次是蓝细菌(Cyanobacteria)和拟杆菌门(Bacteroidetes),其序列数占总数的29.9%和24.3%。这三类细菌序列数占总数的92.6%,此外,放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)等也有一定数量的检出,赤潮发生区(HAB01)及附近海域(ZJ0205)微生物门类组成如图6所示。另外从属的分类水平上看,Bacillariophyta、Candidatus Pelagibacte和黄杆菌科(Flavobacteriaceae)中的某些属是主要优势菌属,主要菌属组成如图7所示。
通过属水平的维恩(Venn-Diagram)图分析赤潮发生点及附近海域水体微生物群落的差异(图8)。从属水平上看,两区域共有微生物75属,占59.5%,共有物种占一半以上;赤潮发生海域水体微生物特有物种11属,占8.7%;附近海域水体特有微生物物种40属,占31.7%。从种类组成上看,二者有近一半的不同物种,双方水体微生物有一定程度的差异。
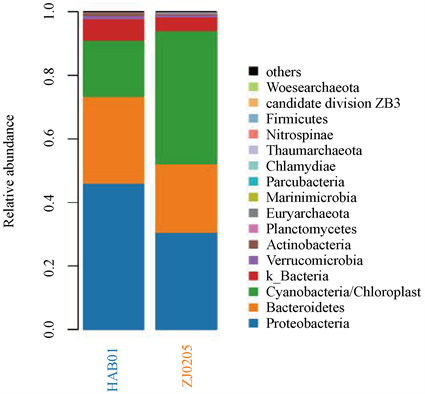
Figure 6. Species composition (phylum level)
图6. 微生物种类组成(门水平)

Figure 7. Species composition (genera level)
图7. 微生物种类组成(属水平)
比较二类水体微生物的主要优势门类(表4)。从门水平上看,二类水体中相对丰度占前四位优势种其中有二个门类是重合的,赤潮水体的第一优势菌和附近海域的第二优势菌均是变形菌门,赤潮水体的第二优势菌和附近海域的第三优势菌均是拟杆菌门。但各优势菌所占比例双方差异较大,如赤潮区域第一优势菌为变形菌门(占46.1%),在附近海域中占30.6%,而附近海域中第一优势菌蓝细菌(占42.0%),在赤潮区域仅占17.7%。
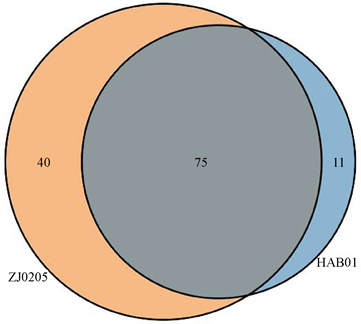
Figure 8. The variance analysis of microbial community (genera level)
图8. 微生物群落差异维恩图(属水平)

Table 4. Dominant species of marine microbes (phylum level)
表4. 微生物主要优势种(门水平)
黄备等采用可培养技术对台州海域发生东海原甲藻赤潮及对照海域水体细菌进行分离纯化,并对获得菌株进行基于生化反应的种类鉴定 [13] 。结果表明,赤潮水体中主要优势菌为弧菌、假单胞菌等均属变形菌门,与本次调查结果一致。但其在未发生赤潮的朱家尖海域发现主要优势菌是黄杆菌、气单胞菌,而本次调查结果为蓝细菌门,二者差异较大。这是由于二次调查采用的技术手段不同,本次调查采用的16s高通量测序手段与传统的细菌生化鉴定存在着很大的差异,加上二者采样海域也不同,因此结果存在着相当的差异。王剑等对不同时期条纹环沟藻赤潮时间可培养细菌的单菌落16S rDNA序列测定对细菌进行了分子分类鉴定,发现细菌多是以变形菌门和拟杆菌门的细菌类群为主 [14] 。常虹等采用末端限制性酶切片段长度多态性分析(T-RFLP)等分子生物学方法,通过主成分分析、克隆文库的构建,研究深圳大鹏湾海域锥状斯氏藻赤潮发生期间细菌群落结构,结果发现细菌的种类主要属于变形杆菌门、拟杆菌门和厚壁菌门 [15] 。Hye-Eun Kang等对韩国巨济岛海域发生赤潮异弯藻期间的微生物群落进行了分子生物学研究,其中16S rDNA测序及种类鉴定结果显示在赤潮水体变形菌门和拟杆菌门是二大最主要的细菌类群,其次为厚壁菌门和放线菌门 [16] 。由此可见,采用分子生物学技术研究赤潮发生时水体微生物群落,虽然赤潮原因种、研究海域等条件均不相同,但从门水平上看,水体微生物群落结构比较相似。变形杆菌门、拟杆菌门、放线菌门和厚壁菌门是最主要的细菌类群。本次研究的结果也证实了这一结论。
4. 结论
1) 2018年6月对浙江沿海赤潮高发海域进行了海洋生态环境巡视性调查,结果发现调查海域氮、磷营养盐含量普遍较高,大多数样品无机氮超一类海水水质标准。
2) 调查期间在渔山列岛附近海域发现赤潮,现场叶绿素a含量为42.12 mg/m3,浮游植物细胞丰度为8.16 × 108/L,其中东海原甲藻丰度占98.5%,可以认为这是一次东海原甲藻事件。
3) 应用Illumina MiSeq测序平台对赤潮发生区及附近海域水体进行16s高通量序列测定,共鉴定细菌16门82科126属。门水平上,变形菌门是第一优势门类,其序列数占总数的38.4%;其次是蓝细菌和拟杆菌门。
4) 比较赤潮发生点及附近海域水体微生物种类组成,双方水体微生物有一定程度的差异。二者优势菌所占比例双方差异较大。赤潮发生区域第一优势菌为变形菌门占46.1%;附近海域中第一优势菌蓝细菌,占42.0%。
基金项目
浙江省生态环境厅科研项目(2016A012;2017A011;2018A022及“浙江近海富营养化特征及风险评估”)。
NOTES
*通讯作者。