摘要: 目的:探讨六堡茶茶褐素对肠道菌群结构的影响。方法:以普通饲料和高脂饲料喂养C57BL/6J小鼠进行造模。造模成功后,将小鼠分为普通对照组(N组)、普通肥胖组(NT组)、高脂对照组(HFD组)和高脂肥胖组(HFDT组),四组小鼠分别给予普通饲料、普通饲料加药物、高脂饲料、高脂饲料加药物喂养。分别在给药前和给药八个月后采集4组小鼠粪便样本并提取菌群基因,分析其肠道物种菌群组成。结果:造模结束后,肥胖小鼠肠道中拟杆菌丰度、拟杆菌/厚壁菌比值降低,给药增加了拟杆菌丰度、拟杆菌/厚壁菌比值,降低了厚壁菌丰度。结论:六堡茶茶褐素对小鼠肠道拟杆菌、厚壁菌结构和数量有显著影响,可以改善小鼠肠道菌群结构。
Abstract:
Objective: To investigate the effect of Liupao tea theabrownins on intestinal microflora. Methods: C57BL/6J mice were fed with normal diet and high fat diet. After the model was established successfully, the mice were divided into four groups: normal diet group (N Group), normal diet + obesity group (NT group), high fat diet group (HFD group) and high fat diet + obesity group (HFDT group). The four groups were fed with normal diet, normal diet plus Liupao tea theabrownins, high fat diet, high fat feed plus Liupao tea theabrownins respectively. Fecal samples of 4 groups of mice were collected before and after eight months of administration, and bacterial genes were extracted to analyze the composition of intestinal flora by 16S rDNA analysis. Results: At the end of modeling, the abundance of Bacteroides and the ratio of Bacteroides to sclerella decreased in the intestine of obese mice. After administration, Bacteroides abundance and Bacteroides/sclerella ratio were increased, while sclerella abundance was decreased. Conclusion: The structure and quantity of Bacteroides and sclerella in intestine of mice were significantly affected by theabrownins from Liupao tea, which can ameliorate the structure of intestinal flora.
1. 引言
人体肠道内栖息着大量的共生微生物,其种类超过了1000种,肠道菌群主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门等组成 [1]。肠道菌群与宿主共存互利,相互影响,对维持宿主机体稳态起重要作用 [2]。肠道菌群为宿主提供特殊催化酶,共同构建生化途径,直接参与机体能量代谢,其代谢终产物-短链脂肪酸(SCFA),包括乙酸、丙酸、丁酸等,发挥重要的生理功能 [3] [4]。
肠道微生物的组成和数量同时受饮食营养成分组成类型、数量以及平衡状态影响,一起参与机体能量代谢,与肥胖、胰岛素抵抗、糖尿病的发病和进展相关 [5] [6] [7]。虽然对肠道菌群的作用机制尚未完全清楚,但随着对肠道菌群与能量代谢研究的深入,平衡肠道菌群有望成为防治能量代谢紊乱性疾病的新思路,肠道菌群有望成为治疗肥胖和糖尿病的新靶点。
本实验通过研究六堡茶茶褐素对小鼠肠道菌群的影响,期望揭示六堡茶对机体肠胃和肥胖作用机制。
2. 材料与方法
2.1. 实验动物与材料
4周龄C57BL/6J雄性小鼠,13 ± 2 g,购于上海斯莱克实验动物中心。该动物实验经桂林医学院动物实验伦理委员会同意进行。宏基因组DNA提取试剂盒,北京天恩泽基因科技有限公司。BIO-Photometer 型核酸蛋白测定仪,德国Eppendorf公司。六堡茶茶褐素,本实验室制备,茶褐素含量98%。
2.2. 饲料配方
普通饲料:市售小鼠饲料;
高脂饲料:小鼠饲料60%,猪油15%、鸡蛋6%、蔗糖10%、羧甲基纤维素5%、花生2%、食盐2%;
普通加六堡茶茶褐素饲料:小鼠饲料94%,六堡茶茶褐素6%;
高脂加六堡茶茶褐素饲料:高脂饲料94%,六堡茶茶褐素6%。
自制饲料为条形,烘干冷藏备用。
2.3. 样本采集与处理
50只C57BL/6J雄性小鼠适应性饲养1周后,随机分为普通饲料组(25只),普通饲料喂养,期间自由取食,自由饮水,高脂饲料组(25只)以高脂饲料喂养,以5%的蔗糖水替代水,每周称重一次。根据肥胖度(%) = (试验组实际体重 − 对照组平均体重) /对照组平均体重 × 100,将体重超过普通饲料组平均重量 10% 的小鼠定为超重,把体重大于普通饲料组平均重量20%的小鼠作为肥胖模型 [8]。从普通饲料组中筛选出未达超重状态的小鼠12只,为普通对照组(N组),超重的小鼠8只为普通肥胖组(NT组);从高脂饲料组中筛选出未达到肥胖标准的小鼠12只,为高脂对照组(HFD组),肥胖小鼠13只为高脂肥胖组(HFDT组)。搜集4组小鼠粪便样本并提取菌群基因,采用16S rDNA测序技术分析样本肠道菌群组成。
小鼠分别以不同饲料喂养,普通对照组(N组)喂以普通饲料,普通肥胖组(NT组)喂以加入六堡茶茶褐素的普通饲料,高脂对照组以(HFD组)喂以高脂饲料,高脂肥胖组(HFDT组)喂以添加六堡茶茶褐素的高脂饲料,饮用水全部采用灭菌水。饲养期间N组小鼠死亡2只,NT组、HFDT组各死亡1只。32周后收集4组小鼠粪便样本并提取菌群基因,采用16S rDNA 测序技术分析样本的肠道菌群结构。
2.4. 粪便菌群基因提取与检测
采用腹部按摩的方法收集小鼠粪便 0.1~0.3 g,严格按照宏基因组DNA提取试剂盒说明书进行操作,取小鼠粪便后立即进行DNA提取,检测DNA OD260/OD280比值确认在1.7~1.8间,每个合格DNA样本各取15 μL,混合置于−20℃冰箱保存供测试用。
2.5. 肠道微生物菌群物种组成及丰度分析
将提取的基因组送深圳华大基因研究院,采用16S rDNA测序技术分析样品肠道菌群DNA,比对样品库确定微生物种类。
2.6. 统计学处理
肠道菌群测定结果转换为l g值建库。采用T-test检验对所得数据进行结果统计分析,以P < 0.05为具有统计学意义。
3. 结果
3.1. 各组小鼠的生长情况观察
在饲喂普通饲料与高脂饲料期间,喂养普通饲料小鼠进食量正常,毛发光亮,行为较活跃,体重增加;喂养高脂饲料小鼠进食量刚开始比普通饲料小鼠多,但是在实验后期进食量有所减少,毛发较湿、黏结,饮水量和尿量比较多,粪便较为稀软、臭味重,活动减少,精神萎靡,体重明显增加,动作较为迟缓,背部有少量毛发脱落,饮水量增多,尿量多,与文献报道一致 [9]。每次换垫料的时候均发现木屑沾有少量红色液体,疑为尿液,而普通饲料组则无此现象。喂养普通饲料小鼠粪便较添加六堡茶茶褐素组硬。
3.2. 各组小鼠的体重变化
小鼠体重变化见图1。造模开始前,4组小鼠的体重均无差异(P > 0.05)。第8周造模结束给药前,NT组体重与HFD组体重相比无差异(P > 0.05),但比N组大,HFDT组与 HFD组、NT组相比有显著性差异(P < 0.05);没有喂饲六堡茶茶褐素的N组、HFD组两组小鼠体重在32周实验期内均逐渐增加;添加六堡茶茶褐素的小鼠体重在实验结束时同样下降,但下降方式和程度不同。高脂肥胖组给予茶褐素后体重减轻幅度大,普通肥胖组给药后体重减轻幅度小。
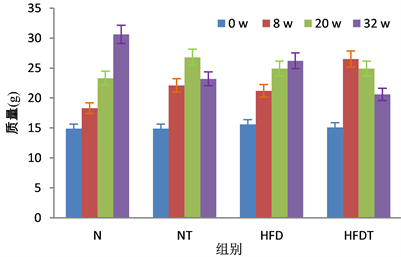
Figure 1. Effects of Liupao tea theabrownins on mice body weight
图1. 六堡茶茶褐素对小鼠体重的影响
3.3. 各组小鼠肠道菌群之间的主要差异
造模小鼠肠道菌群16S rDNA 测序结果见表1。第8周造模成功后,普通肥胖组(NT组)中拟杆菌数量比普通对照组(N组)少,高脂肥胖组(HFDT)拟杆菌数量也比高脂组少;而厚壁菌的数量从两种饲料喂养小鼠来看,结论并不是很明确,普通饲料喂养小鼠厚壁菌数量相近,高脂饲料喂养小鼠则是肥胖组厚壁菌数量占优势。但是肥胖组小鼠,不管喂饲普通饲料还是高脂饲料,其拟杆菌/厚壁菌数量比值比相应对照组小鼠低。除变形菌外,放线菌、脱铁杆菌、TM7、柔膜菌、疣微菌和未鉴定的菌落占比很低,菌群结构单一。

Table 1. Effect of intestinal flora levels in mice at week 8 (%)
表1. 第8周小鼠肠道菌群水平的影响(%)
给药12个月后的16S rDNA测序结果如图2所示。给予六堡茶茶褐素后,所有组别拟杆菌数量增加,增加幅度与喂养饲料不同而异。而厚壁菌数量改变比较复杂,与给予六堡茶喂养前相比,厚壁菌数量都减少,其减少幅度不定,见表2。与拟杆菌数量增加趋势一致,拟杆菌/厚壁菌值与给予六堡茶茶褐素前相比,基比值都变大。排除饲料因素,不管喂养体积饲料,肥胖组与相应饲料对照组比较,拟杆菌/厚壁菌比值都小于相应饲料对照组,见表3。

Figure 2. Composition of intestinal flora of mice after administration
图2. 给药后小鼠肠道菌群组成

Table 2. Effects of Liupao tea theabrownins on intestinal flora of mice (%)
表2. 六堡茶茶褐素对小鼠肠道菌群水平影响(%)

Table 3. Analysis of the effect of liupao tea theabrownins on relative contents of bacteroides and firmicutes
表3. 六堡茶茶褐素对拟杆菌和厚壁菌相对含量分析
4. 讨论
在实验中对同一品系、同一批小鼠同时给予高脂高糖饮食,使其中一部分小鼠发生肥胖,并对实验小鼠进行六堡茶茶褐素干预喂养。普通饲料喂养小鼠体重缓慢增加,比分组前增加了4.68%,食量、饮水量、尿量如常,行动较为活跃;高脂饲料喂养小鼠体重增加了10.4%,食量、饮水量、尿量增多,行动较为迟缓。分组后收集小鼠粪便并进行基因分析,发现各组小鼠肠道菌群具有比较显著大的差异。HFDT组、NT组这两个组虽然喂饲不同饲料,但是体重都达到了肥胖标准,其肠道菌群拟杆菌数量较低,HFD组、N组也喂饲不同饲料,但是HFD喂饲高脂饲料体重却达不到肥胖标准,属于肥胖抵抗型个体,N组喂饲普通饲,体重也较轻;肠道菌群结构不但与饲料能量高低相关,也与体重相关,至于菌群结构与饲料能量结构、肥胖的相关性还有待进一步深入研究。
高脂饲料与肥胖、拟杆菌数量、厚壁菌数量、拟杆菌/厚壁比值相关,拟杆菌数量、拟杆菌/厚壁比值减少,厚壁菌数量增加、或许拟杆菌数量、厚壁菌数量、拟杆菌/厚壁菌比值可以定义为肠道菌群不健康指标。除变形菌外,放线菌、脱铁杆菌、TM7、柔膜菌、疣微菌和未鉴定的菌落占比很低,菌群结构单一。
给以六堡茶茶褐素干预后,所有组别拟杆菌数量增加,增加幅度与喂养饲料不同而异。而厚壁菌数量改变比较复杂,与给予六堡茶喂养前相比,厚壁菌数量都减少,其减少幅度不定。与拟杆菌数量增加趋势一致,拟杆菌/厚壁菌值与给予六堡茶茶褐素前相比,基比值都变大。排除饲料因素,不管喂养体积饲料,肥胖组与相应饲料对照组比较,拟杆菌/厚壁菌比值都小于相应饲料对照组。其中,N组拟杆菌门较喂药前增加28.8%,NT组增加3.6%;HFD组增加10.9%,HFDT组增加24.9%。厚壁菌门丰度都有所下降,其中,N组下降55.6%,NT组下降9.1%,HFD组下降10.8%,HFDT组下降22.1%。研究表明,拟杆菌门与脂肪沉积成负相关关系,厚壁菌门则相反 [10],经分析,进入喂饲六堡茶茶褐素阶段的各组小鼠,肠道内的拟杆菌门丰度数量都有增高,厚壁菌门的数量均有所下降。无论是拟杆菌门还是厚壁菌门,变化最大的都是N组,即普通饲料组,其次HFDT组即高脂加药饲料组,变化较小的是HFD组,即高脂饲料组,变化最小的是NT组即普通加药饲料组。此外,拟杆菌门与厚壁菌门的比值也与脂肪的沉积成负相关关系 [11],而每组的拟杆菌门与厚壁菌门的比例都提高,且各组变化的程度与拟杆菌门、厚壁菌门变化程度一致,由此可知,六堡茶茶褐素能够使肠道菌群结构发生变化从而使体重下降,N组拟杆菌门增加最多,厚壁菌门下降最大,NT组拟杆菌门和厚壁菌门的变化都是最小的;而HFD组拟杆菌门和厚壁菌门的变化都比HFDT组要低。或许可以理解为在普通饮食的情况下,六堡茶茶褐素会抑制肠道菌群中拟杆菌门的增多和厚壁菌门的减少,但在高脂饮食的情况下,六堡茶茶褐素可以促进拟杆菌门的增多和厚壁菌门的减少。
此外,各组的变形菌门除NT组有微弱的增加外,其余各组均有小幅度的下降;脱铁杆菌门也均有增加,但不明显;而放线菌门的丰度几乎没有变化,由此可知,六堡茶茶褐素对变形菌门和脱铁肝菌门影响不大,对放线菌门几乎没有影响。
本次实验探讨了六堡茶茶褐素在普通饲料和高脂饲料喂养情况下对肠道菌群的影响,但其作用机制尚未深入探讨,六堡茶茶褐素对小鼠肠道菌群干预作用可以六堡茶的健康效果提供理论基础。
基金项目
《中茶窖藏六堡茶对高血糖血症的研究》,广西高校科学技术研究项目(KY2015ZD086),钦州学院校级科研项目(2017KYQD223)。