1. 引言
随着动力电池制造技术的日益提升,汽车行业对动力电池安全性能和续航能力的要求越来越高,根据《节能与新能源汽车产业发展规划(2012~2020年)》要求,2020年动力电池模块的能量密度达到300 Wh/kg [1]。而作为负极的石墨,比容量已达到350 mAh/g,于是限制锂离子电池能量密度提高的主要因素是低容量的电池正极材料,而电池正极材料中,磷酸铁锂电池达到此目标的可能性较小,而具有高能量密度、高振实密度等优点 [2] 的三元正极材料更易实现此目标,因此三元正极材料成为近年来电池行业研究的重点方向,Ni0.6Co0.2Mn0.2(OH)2有可能代替磷酸铁锂成为新一代正极材料。
制备三元正极材料的工艺方法有很多,其中较为主流的方法是:先通过共沉淀的方式合成三元正极材料前驱体,再采用高温固相烧结法合成三元正极材料 [3]。
制备Ni0.6Co0.2Mn0.2(OH)2相关的难溶电解质的溶度积常数(25℃)见表1。

Table 1. Solubility product parameters of related insoluble electrolytes in the preparation of ternary materials
表1. 三元材料制备中相关难溶电解质的溶度积参数
表1可知,Ni和Co的溶度积非常相近,所以Ni(OH)2和Co(OH)2的沉淀pH大致相同,而Mn的溶度积与Ni和Co的溶度积相差较大,所以相同条件下Mn、Ni、Co同时沉淀就比较困难。可通过控制合成过程中的pH值、温度、流量、搅拌速率、反应时间等,使得难容电解质与碱之间能够顺利均匀的发生沉淀反应 [4]。
针对目前合成三元正极材料前驱体过程中存在细粉较多、一次颗粒不均匀、合成过程各项控制参数对产品各指标影响不明确等问题 [5] [6] [7],提出采用多组实验控制变量的方法,探究出氨水浓度、pH、温度、陈化时长、陈化洗水量对Ni0.6Co0.2Mn0.2(OH)2的影响,从而找出合成Ni0.6Co0.2Mn0.2(OH)2的最优工艺,解决目前合成Ni0.6Co0.2Mn0.2(OH)2过程中控制不稳定等问题。此外,对新产品研发、各项指标调整以及规模化生产节本降耗有指导意义。
2. 实验过程
实验所用的原料为电池级硫酸镍(NiSO4·6H2O),纯度为99.9%;电池级硫酸钴(CoSO4·7H2O),纯度为99.9%;电池级硫酸锰(MnSO4·H2O),纯度为99.9%;氨水(NH3·H2O);氨碱,浓度为123 g/L。首先使用硫酸镍(NiSO4·6H2O)、硫酸钴(CoSO4·7H2O)、硫酸锰(MnSO4·H2O)按配方摩尔比例配置盐溶液,然后设定盐流量为80 mL/min,氨碱流量为63 mL/min,氨水流量为4 mL/min,在氮气(N2)保护、搅拌状态下,在8 m3反应釜中合成Ni0.6Co0.2Mn0.2(OH)2,合成过程中氨水浓度采用2 g/L、4 g/L两种,pH终点分别控制至11.2、11.6、12.2。本实验是通过搅拌转速控制合成温度,两组实验温度分别维持在50℃和60℃;通过溢流提浓的方式来改变含固量,反应完成后,陈化1.5 h,陈化所用碱液碱度为111 g/L,碱液加入量按陈化后液碱度为25 g/L计,陈化后对反应料浆进行过滤清洗,洗水量按20 m3/t计,陈化时长设计1 h、2 h、4 h三组,经110℃烘干8 h即可得到三元正极材料前驱体。
观测分析样品微观形貌采用德国ZEISS GeminiSEM 500场发射扫描电子显微镜,工作电压(EHT) = 1.00 kV,探头采用SE2,物镜焦距5.0 mm。测量粒度采用英国马尔文激光粒度仪Mastersizer 3000,颗粒折射率2.420,颗粒吸收率1.000,分散剂折射率1.330,测振实密度采用ZS703型粉体振实密度仪,振动频率300次/分,振动幅度3 mm,合成过程在氮气保护,pph材质容器中进行,合成方法采用间断共沉淀合成法。
3. 分析与讨论
3.1. 氨水浓度的影响
氨水体系中,镍钴锰金属离子M2+以络合的形式存在 [8] [9],具体反应如下:
两组实验所用的氨水浓度分别为0.3 mol/L和0.6 mol/L,其他控制参数保持一致,观测两组实验合成的Ni0.6Co0.2Mn0.2(OH)2的电镜形貌,如图1。
 (a) 0.3 mol/L (b) 0.6 mol/L
(a) 0.3 mol/L (b) 0.6 mol/L
Figure 1. SEM of precursor products with different ammonia concentrations
图1. 不同氨浓度前驱体产品的SEM图
图1可知,氨水浓度为0.3 mol/L时,Ni0.6Co0.2Mn0.2(OH)2形貌较疏松,致密性较差,表面细粉也较多;氨水浓度为0.6 mol/L时,Ni0.6Co0.2Mn0.2(OH)2球型致密,空隙较少。
溶液中的游离态的金属离子很少,溶液的过饱和度也较低,会抑制成核形成的速率,促进晶体生长,形成结晶度好、球形粒度适当的Ni0.6Co0.2Mn0.2(OH)2,氨水在反应过程中主要起到控制金属离子的释放速度的作用 [10],从而达到控制反应速度的目的,所以制备不同组分的Ni0.6Co0.2Mn0.2(OH)2,所需要的氨水浓度也不同。
3.2. pH的影响
根据NOH, M. [11] 等人的探究,因为镍、钴、锰的Ksp值不同,合成不同镍、钴、锰比例的Ni0.6Co0.2Mn0.2(OH)2的适宜氨水浓度和适宜反应pH和氨水浓度也不同。
沉淀过程中的pH直接影响三元正极材料前驱体晶体颗粒的生成、长大,并对球形表面规则度有一定影响,实验在不同pH环境下合成三元正极材料前驱体,并观测不同pH对三元正极材料前驱体微观形貌的差异表现性,如图2所示,pH由11.2增高到12.2过程中,球形度、球表面光滑程度都有所改善。
 (a) Ph = 11.2 (b) pH = 11.6
(a) Ph = 11.2 (b) pH = 11.6  (c) pH = 12.2
(c) pH = 12.2
Figure 2. Effect of pH on precursor morphology
图2. pH对前驱体形貌的影响
本实验发现,pH过高,会导致晶粒爆核,Ni0.6Co0.2Mn0.2(OH)2的粒度会迅速下降;pH过低,晶粒会持续生长,Ni0.6Co0.2Mn0.2(OH)2的粒度会持续升高。在合适范围内随着pH值升高,一次颗粒的细化程度会变得较好,颗粒的球形度也会变好,振实密度(TD)也会升高,如图3所示 [12]。
除此之外,pH与3C存在对应关系,在晶粒生长状态时,pH与3C的增长幅度比例约为1:1,即pH提升0.01,3C提升0.01;在晶粒处于平衡状态时,pH与3C的增长幅度比例约等于1:(2~3),即pH提升0.01,3C提升0.02~0.03;在出核状态时,pH与3C的增长幅度比例大于1:3,即pH提升0.01,3C提升大于0.03。同时在粒径处于生长状态时,过多的降低pH不仅不能带来更大的增长速度,反而会造成严重的失衡状态,对后续控制带来更大的困难。

Figure 3. Effect of pH on the vibration density of precursor
图3. pH对前驱体振实密度的影响
3.3. 温度的影响
温度主要是影响化学反应速率 [13]。在合成Ni0.6Co0.2Mn0.2(OH)2过程中,温度越高各种反应过程的速率都会加快,但是其晶核生长增长速率明显高于成核增长速度 [14]。温度过高会导致Ni0.6Co0.2Mn0.2(OH)2氧化,同时系统的pH会持续下降,人为控制会导致pH处于比系统pH更高状态,易导致爆核。温度稳定在控制过程中极为重要 [15],如图4,温度稳定在50℃时球形度较为规则,升高到60℃时球形度变差,可知温度出现大幅度波动会导致Ni0.6Co0.2Mn0.2(OH)2的形貌结构改变。
 (a) 50℃ (b) 60℃
(a) 50℃ (b) 60℃
Figure 4. Relationship between temperature and morphology of high nickel precursor ((a) 50℃, (b) 60℃)
图4. 温度与高镍前驱体形貌关系((a)反应温度50℃,(b)反应温度60℃)
3.4. 陈化时长的影响
陈化过程在合成三元正极材料前驱体工艺流程中极为重要,陈化过程会再次修饰球形形貌,完善晶体结构,进而对电池性能有较大影响 [16] [17]。
陈化实验所用碱液碱度为110 g/L,碱液加入量按陈化后液碱度为25 g/L计,陈化时长分别为1 h、2 h、4 h的三组平行实验,以探究不同陈化时长对Ni0.6Co0.2Mn0.2(OH)2形貌的影响。
通过图5可知,随着陈化时间的延长(1 h到2 h再到4 h),三元正极材料前驱体的球形度变得更加规整,一次颗粒分布更加均匀,球表面细粉减少,疏松度也有所改善。
 (a) 1 h (b) 2 h
(a) 1 h (b) 2 h (c) 4 h
(c) 4 h
Figure 5. Effect of different aging time on the morphology of Ni0.6Co0.2Mn0.2(OH)2
图5. 不同陈化时长对Ni0.6Co0.2Mn0.2(OH)2形貌的影响

Table 2. Particle size of precursor of ternary anode material under different aging time
表2. 不同陈化时长下三元正极材料前驱体的粒径
由表2可知,陈化时长从1小时到4小时过程中,三元正极材料前驱体的粒度从10.4 um增长的11 um,且球形度逐渐改善,这表明三元前驱体在陈化过程中小颗粒会逐溶解,大颗粒会继续长大,在一定程度上形成一次颗粒规则排布,并会对二次球型进行修饰,使得三元正极材料前驱体粒度变大,表面也更加规则、圆滑。
3.5. 陈化时长的影响
陈化后的物料通过纯水洗涤,洗去易溶的Na2SO4 [18],为探究最合适的洗水用量,做了如下实验:
使用70℃的纯水洗涤陈化后的物料,物料干重1 t,洗水量梯队式每增加1 m3检测洗水后液pH,得出洗水量与洗水后液PH关系,如图6所示。
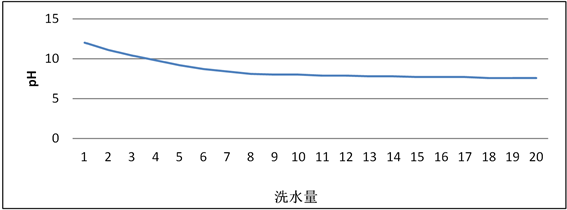
Figure 6. Relationship between washing water volume and pH of washing liquid
图6. 洗水量与洗水后液PH关系图
由图6可知,洗水量前5立,洗水后液pH下降明显,洗水量到8立时,随着洗水量的继续增加洗水后液pH下降变缓,继续增加洗水量,洗水后液pH变化不明显。
4. 结论
1) 氨浓度较低时,合成的Ni0.6Co0.2Mn0.2(OH)2球形形貌较疏松,致密性差,表面细粉较多;
2) pH过高,会导致晶粒爆核,粒度会迅速下降;pH过低,晶粒会持续生长,粒度会持续升高。在合适范围内pH值升高,一次颗粒的细化程度会变得较好,颗粒的球形度也会变好,振实密度(TD)也会提高;
3) 陈化时间从1 h到4 h,随着时间的延长前驱体粒度分布变窄,粒度变大,球型表面也更加规则、圆滑;
4) 合成Ni0.6Co0.2Mn0.2(OH)2后,陈化洗水量从0增长到5立的过程中,洗水后液pH有明显下降趋势,洗水量到8立时,随着洗水量继续增加洗水后液pH下降变缓,继续增加洗水量,洗水后液pH变化不明显。
基金项目
河北省杰出青年培育基金资助项目(E2015209021)。