摘要:
目的:对比循环肿瘤DNA (Circulating Tumor DNA, ctDNA)与传统肿瘤指标神经元特异性烯醇化酶(Neuron-specific-enolase, NSE)、癌胚抗原(Carcino-embryonic antigen, CEA)、乳酸脱氢酶(Lactic dehydrogenase, LDH)对SCLC患者近期疗效的预测,分析ctDNA与SCLC临床病理特征及预后的关系。方法:收集2017年7月~2019年8月于我院肿瘤内科经病理确诊的62例初治的SCLC患者的血液样本。ECOG评分:0~1分。行4周期化疗。分别在化疗前、2周期化疗前1天、4周期化疗前1天抽取空腹静脉血检测ctDNA、CEA、NSE、LDH。参照RECIST1.1实体瘤疗效评价标准将患者分为进展组(PD)与非进展组(CR + PR + SD),比较治疗前后ctDNA与NSE、CEA、LDH变化,进而对比上述指标对SCLC患者近期疗效的评估价值。采用受试工作者曲线(ROC)确定化疗前ctDNA高低表达临界值,分为ctDNA高表达组和低表达组,对SCLC患者进行随访,分析ctDNA与SCLC临床病理特征及预后的关系。结果:纳入62名患者中,49名SCLC患者检测到ctDNA,该49名患者被纳入此研究。1) 化疗2周期后,ctDNA在进展组表达高于非进展组(p < 0.01),NSE、CEA、LDH表达在进展组及非进展组中相比无统计学差异(p均>0.05)。2) 化疗4周期后,ctDNA在进展组表达高于非进展组(p < 0.01)。NSE (p < 0.01)在进展组表达高于非进展组,CEA、LDH表达在进展组及非进展组相比无统计学差异(p均>0.05)。3) ctDNA高表达与广泛期(p < 0.01),多部位转移(p = 0.019)以及低钠血症(p = 0.013)有关。4) 发现ctDNA高表达组PFS较低表达组短(8.051 ± 0.536 Vs 9.910 ± 0.560; χ
2 = 4.356, p = 0.037),OS在ctDNA高表达组和低表达组中无明显差异(10.874 ± 0.408 Vs 11.166 ± 0.428; χ
2 = 0.059, p = 0.807)。结论:1) ctDNA较NSE可以更早地预测小细胞肺癌治疗的近期疗效。2) 化疗前ctDNA高表达与广泛期,多部位转移以及低钠血症有关,提示ctDNA高表达患者预后较ctDNA低表达患者更差。
Abstract:
Purpose: Compare Circulating Tumor DNA (ctDNA) with traditional tumor indicators Neuron-specific-enolase (NSE), Carcino-embryonic antigen (CEA), and lactate dehydrogenase (LDH) to predict the short-term efficacy of SCLC patients, analyze the relationship between ctDNA and the clinicopathological characteristics and prognosis of SCLC. Methods: Collect blood samples of 62 newly-treated SCLC patients who were pathologically diagnosed in the Oncology Department of our hospital from July 2017 to August 2019; ECOG score: 0 - 1 points; perform 4 cycles of chemotherapy. Fasting venous blood was drawn to detect ctDNA, CEA, NSE, and LDH before chemotherapy, 1 day before 2 cycles of chemotherapy, and 1 day before 4 cycles of chemotherapy. According to the RECIST1.1 solid tumor efficacy evaluation standard, the patients were divided into progressive group (PD) and non-progressive group (CR + PR + SD), and the changes of ctDNA and NSE, CEA, LDH before and after treatment were compared, and the above indicators were compared to SCLC patients in the near future. The evaluation value of efficacy was also compared. The test worker curve (ROC) was used to determine the cutoff value of ctDNA expression before chemotherapy, and divided into ctDNA high expression group and low expression group. SCLC patients were followed up to analyze the relationship between ctDNA and SCLC clinicopathological characteristics and prognosis. Results: 62 patients were included, ctDNA was detected in 49 SCLC patients, and these 49 patients were included in this study. 1) After 2 cycles of chemotherapy, the expression of ctDNA in the progressive group was higher than that in the non-progressive group (p < 0.01), and the expressions of NSE, CEA, LDH were not statistically different between the progressive group and the non-progressive group (p < 0.05). 2) After 4 cycles of chemotherapy, the expression of ctDNA in the progressive group was higher than that in the non-progressive group (p < 0.01). The expression of NSE (p < 0.01) in the progressive group was higher than that in the non-progressive group, and the expression of CEA and LDH was not statistically different between the progressive group and the non-progressive group (p > 0.05). 3) High expression of ctDNA is related to extensive phase (p < 0.01), multi-site metastasis (p = 0.019) and hyponatremia (p = 0.013). 4) It was found that the low PFS expression group of the ctDNA high expression group was short (8.051 ± 0.536 Vs 9.910 ± 0.560; χ2 = 4.356, p = 0.037), and the OS was higher in ctDNA. There was no significant difference between the expression group and the low expression group (10.874 ± 0.408 Vs 11.166 ± 0.428; χ2 = 0.059, p = 0.807). Conclusion: 1) ctDNA can predict the short-term efficacy of small cell lung cancer treatment earlier than NSE. 2) Before chemotherapy, the high expression of ctDNA is associated with extensive stage, multi-site metastasis and hyponatremia, suggesting that the prognosis of patients with high ctDNA expression is worse than that of patients with low ctDNA expression.
1. 引言
肺癌是最常见的恶性肿瘤之一,大部分患者发现时已经是晚期 [1]。近期肺小细胞癌发病率逐年增加。其治疗一直都是以化、放疗为主,虽对其极度敏感,但是发生远处转移速度相当快 [2],预后一般很差,五年生存率仅有5%~10% [3]。故目前迫切需要一种新的手段帮助我们更早发现疾病进展。
在肿瘤发生的早期即可在外周血中检测到循环肿瘤DNA (circulating tumor DNA, ctDNA),这是一种存在于体液中的细胞外DNA,是游离DNA (cell-free DNA, cfDNA)中的一类,约占其0.1%~1%,主要来源于坏死或凋亡的肿瘤细胞或循环肿瘤细胞 [4]。故ctDNA可以一定程度上体现肿瘤负荷变化,本文旨在研究ctDNA对晚期SCLC化疗前后的疗效评估、监测病情进展及预后的意义。
2. 研究对象与方法
在收集2017年7月~2019年8月于我院肿瘤内科就诊的62例SCLC患者的血液样本,所有患者原发病灶经病理证实均为SCLC,且均为初次诊断。ECOG评分:0~1分。其中49例患者检测出ctDNA,并纳入研究,所有患者或其家属均签署书面知情同意书加入研究。本研究已取得伦理委员会许可。
2.1. 研究对象的纳入及排除标准
纳入标准:病理诊断为原发性肺小细胞肺癌。排除标准:1) 合并其他部位肿瘤;2) 合并心、脑、肾等脏器严重病变;3) 合并各种急慢性感染;4) 严重精神疾病、神经系统疾病患者。
2.2. 治疗方法及疗效评价
1) 治疗方法:
2) 一线治疗:EP (依托泊苷100 mg/m2,d1-3 + 顺铂75 mg/m2,d1)方案,21天为1周期。共进行4周期治疗。
3) 若化疗过程中疾病进展,进行二线治疗:IP (伊立替康60 mg/m2,d1,8,15 + 顺铂30 mg/m2,d1,8),28天为1周期。
4) 疗效评价标准:每周期进行影像学检查,参照RECIST实体瘤疗效评价标准判断疗效 [5]。完全缓解(CR, Complete remission):病灶完全消失,维持4周以上;部分缓解(PR, partial reponse):肿瘤最大径之和缩小≥30%,维持4周以上;疾病稳定(SD, stable disease):介于PR和PD之间;疾病进展(PD, progressive disease):病灶或肿瘤最大径之和增大>20%,或出现新病灶。
2.3. 标本采集及检测方法
抽取SCLC患者化疗前,第2周期化疗和第4周期化疗前1天空腹静脉血5 ml于EDTA抗凝管中,充分混匀,2 h内以4000 r/min离心5 min分离血浆,并将其保于−80℃冰箱中待集齐检测。ctDNA水平测定步骤:严格按照QIAamp DNA Blood Mini Kit试剂盒操作步骤分离并提纯ctDNA。运用nanodrops 2000分光光度计检测所获样本ctDNA浓度。并利用ROC曲线确定化疗前ctDNA高低表达临界值。将患者分低表达组、高表达组。
NSE、LDH、CEA指标检测方法:采集所有患者清晨空腹静脉血5 ml,首先对血液样本进行离心分离出血清。选取全自动生化分析仪与酶联免疫法定量测定血清标本中NSE、LDH与CEA水平。
2.4. 随访
本研究对患者随访1年,收集患者无进展生存期PFS和总生存率OS情况。
2.5. 统计学分析
采用以SPSS 17.0统计学软件处理数据,计量资料以均数±标准差表示,采用T检验比较数据,采用Pearson相关检验相关性。计数资料采取构成比描述,并选用χ2检验比较;用Kaplan Meier法绘制生存曲线,用Log-rank法比较生存率,P < 0.05视为有统计学意义。
3. 结果
3.1. 一般资料
本次共纳入62例患者。49例患者检测出ctDNA,并纳入研究,男性患者38人,女性患者11人,其中局限期16人,广泛期33人。治疗2周期后进展组12人,非进展组37人。治疗4周期后进展组23人,非进展组26人。
3.2. ctDNA与临床病理特征关系
采用受试工作者曲线(ROC)确定化疗前ctDNA高低表达临界值(17.226 ng/mL) (见图1),分低表达组19人,高表达组30人。并与相关临床病理特征分析表明,广泛期患者高表达者28人,而低表达者仅5人,两者差异有统计学意义(χ2 = 23.758, P < 0.01);多器官转移者27人中有25人高表达,而单器官转移者6人中3人高表达,经统计学检验差异有意义(χ2 = 5.495, P < 0.019);低钠血症共36人,其中29人高表达,血清钠正常者13人,5人高表达,差异有统计学意义(χ2 = 6.109, P < 0.013)。余临床特点与ctDNA表达情况差异无统计学意义(P均大于0.05),详见表1。


Table 1. Relationship between ctDNA and clinicopathological characteristics
表1. ctDNA与临床病理特征关系
注:a, b, c,P均<0.05有统计学意义。
3.3. ctDNA与近期疗效的关系
分别比较化疗前与化疗2周期及化疗前与化疗4周期ctDNA变化。发现在化疗过程中,进展组治疗2、4周期均较治疗前升高,而非进展组均降低。差异均有统计学意义。详见表2和表3。

Table 2. The relationship between ctDNA and the short-term efficacy of 2 cycles of chemotherapy (ng/mL)
表2. ctDNA与化疗2周期近期疗效的关系(ng/mL)

Table 3. The relationship between ctDNA and the short-term efficacy of 4 cycles of chemotherapy (ng/mL)
表3. ctDNA与化疗4周期近期疗效的关系(ng/mL)
注:a与治疗前比较有统计学意义,T = 2.962, P = 0.006。
注:b与治疗前比较有统计学意义,T = 5.651, P < 0.001。
注:c与治疗前比较有统计学意义,T = 3.55, P = 0.002。
注:d与治疗前比较有统计学意义,T = 4.922, P < 0.001。
3.4. NSE与近期疗效的关系
分别比较化疗前与化疗2周期及化疗前与化疗4周期NSE变化。发现在化疗过程中,进展组均值上升,而非进展组均值下降。但仅化疗前与化疗第4周期的差异均有统计学意义。详见表4和表5。

Table 4. The relationship between NSE and the short-term efficacy of 2 cycles of chemotherapy (ng/L)
表4. NSE与化疗2周期近期疗效的关系(ng/L)

Table 5. The relationship between NSE and the short-term efficacy of 4 cycles of chemotherapy (ng/L)
表5. NSE与化疗4周期近期疗效的关系(ng/L)
注:a与治疗前比较无统计学意义,T = 1.657, P = 0.109。
注:b与治疗前比较有统计学意义,T = 3.482, P = 0.002。
注:c与治疗前比较无统计学意义,T = 0.511, P = 0.615。
注:d与治疗前比较有统计学意义,T = 2.415, P = 0.025。
3.5. CEA、LDH与近期疗效的关系
分别比较化疗前与化疗2周期及化疗前与化疗4周期CEA及LDH变化。统计学分析示治疗前后差异均无统计学意义。详见表6~9。

Table 6. The relationship between CEA and the short-term efficacy of 2 cycles of chemotherapy (ng/L)
表6. CEA与化疗2周期近期疗效的关系(ng/L)

Table 7. The relationship between CEA and the short-term efficacy of 4 cycles of chemotherapy (ng/L)
表7. CEA与化疗4周期近期疗效的关系(ng/L)
注:a与治疗前比较无统计学意义,T = 1.349, P = 0.189。
注:b与治疗前比较无统计学意义,T = 0.365, P = 0.718。
注:c与治疗前比较无统计学意义,T = 0.402, P = 0.692。
注:d与治疗前比较无统计学意义,T = 0.865, P = 0.397。

Table 8. The relationship between LDH and the short-term efficacy of 2 cycles of chemotherapy (U/L)
表8. LDH与化疗2周期近期疗效的关系(U/L)

Table 9. The relationship between LDH and the short-term efficacy of 4 cycles of chemotherapy (U/L)
表9. LDH与化疗4周期近期疗效的关系(U/L)
注:a与治疗前比较无统计学意义,T = 0.378, P = 0.708。
注:b与治疗前比较无统计学意义,T = 1.280, P = 0.212。
注:c与治疗前比较无统计学意义,T = 0.892, P = 0.383。
注:d与治疗前比较无统计学意义,T = 0.662, P = 0.515。
3.6. ctDNA表达与预后的关系
随访患者至2020-6,中位随访时间12个月(3.9~12个月),发现高表达组PFS较低表达组短(8.051 ± 0.536 Vs 9.910 ± 0.560; χ2 = 4.356, p = 0.037),ctDNA与PFS呈负相关,OS在高表达组和低表达组无明显差异(10.874 ± 0.408 Vs 11.166 ± 0.428; χ2 = 0.059, p = 0.807),提示ctDNA与小细胞肺癌预后相关;详见图2及图3。
4. 讨论
小细胞肺癌恶性程度极高,患者2年生存率仅仅约在1% [6]。预后极差,与其倍增时间不长,生长分数高相关,虽然临床证实小细胞肺癌对于放疗、化疗均十分敏感,然而到后期肿瘤复发并发生转移几率很高 [7]。正常人的血液中存在游离的DNA,即cfDNA (Cell free DNA),而当此DNA存在突变时,即为ctDNA,这种突变一般为点突变,多在肿瘤情况发生,所以ctDNA能较为特异的提示肿瘤的发生 [8]。正常人因为免疫系统作用,血液中测定的cfDNA往往处于较低水平 [9]。在肿瘤细胞生长的病理过程中多会发生坏死、凋亡,导致ctDNA大量释放 [10]。使得ctDNA对肿瘤具有较好的提示作用。而当原发灶肿瘤细胞转移侵入血液时,释放的ctDNA可能诱导相关炎性细胞因子的释放,进而刺激肿瘤营养血管的形成,对帮助肿瘤细胞逃避免疫系统的清除起到一定作用 [11]。已有研究证实,在外周血检测到的ctDNA可作为肿瘤发生转移的指标之一 [12]。
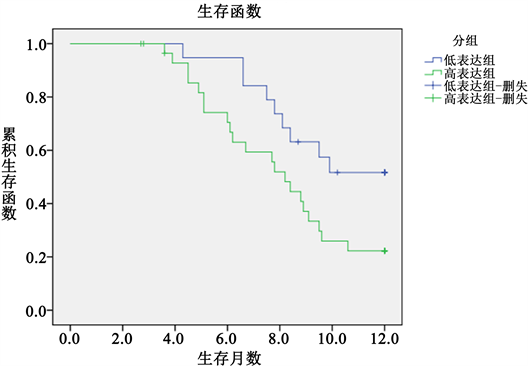
Figure 2. PFS survival time (months)
图2. PFS生存时间(月)
健康人检测循环肿瘤DNA往往处于较低水平,基本于3~63 ng/mL间,而当肿瘤细胞在循环系统坏死后,其循环肿瘤DNA会上升,基本约于122~462 ng/mL间 [13]。国外相关文献证实,ctDNA水平与患者所患肿瘤病情进展程度及治疗后相关反应有关 [14]。而ctDNA在恶性肿瘤晚期时含量较病情早期多有升高,而随着肿瘤病情不断发展恶化,其ctDNA含量也随之升高 [15]。这提示ctDNA能够反映机体肿瘤负荷。本次研究也证实,在广泛期及肿瘤已经多部位转移的患者中,ctDNA含量较高,与之前研究相符。
相关肿瘤指标如NSE、CEA等已广泛应用,NSE在小细胞肺癌的早期诊断,疗效评估有一定作用 [16]。本研究也提示NSE高表达与PD组患者有关。但NSE在局限期小细胞肺癌患者中敏感性低,在其它类型肿瘤中也可升高 [17]。CEA是一种非特异性肿瘤标志物,在多种肿瘤均可出现升高,单独通过CEA来评价小细胞肺癌的价值相对较差 [18]。本次研究也证实CEA与小细胞肺癌的近期疗效无关。LDH广泛存在于人体各个组织中,有学者提出利用LDH评估小细胞肺癌具有一定意义,在病程处于广泛期的小细胞肺癌LDH是其独立预后因素 [19]。而本次研究结果提示,LDH与小细胞肺癌的近期疗效仍无关。这与于溪等人的研究相符 [20]。
ctDNA作为一种较为新颖的评估方法,对于评价小细胞肺癌具有较好的优势。根据本研究结果提示,ctDNA能够较NSE更早预测近期疗效。而对于已经发生远处转移,尤其是存在肝转移的小细胞肺癌患者,NSE及LDH可明显升高 [21]。但此时往往提示意义不大,相较ctDNA有较大劣势。此次研究提示ctDNA较既往较良好的肿瘤标志物更能早期提示病情预后。
本次研究随访1年,发现ctDNA高表达组PFS较低表达组短(P < 0.05),提示血浆ctDNA表达情况与小细胞肺癌预后密切相关。研究表明,在非小细胞肺癌、乳腺癌及卵巢癌等恶性肿瘤中,多数ctDNA在治疗前是影响肿瘤预后的独立危险因素 [22],但在小细胞肺癌预后中的评估价值尚不确定。本次研究探索ctDNA和临床病理特征关系,发现在肺小细胞癌广泛期、多处转移及合并低钠血症的患者中,ctDNA含量明显高于局限期、单部位转移及无低钠血症患者。故ctDNA在SCLC患者广泛期、多处转移及低钠血症情况下高表达。对比化疗前后ctDNA,NSE,CEA,LDH与近期疗效的关系,发现ctDNA和NSE高表达时,患者表现为疾病进展,且ctDNA较NSE能更早提示疾病进展(P < 0.05),有统计学意义。而LDH、CEA与近期疗效无明确统计学意义。因此考虑ctDNA,NSE高表达与PD患者有关,且ctDNA能更早提示疾病进展。
5. 结论
综上,ctDNA作为较新颖的一类肿瘤指标,能较好地提示SCLC患者病情变化及预后。虽本研究限于条件病例较少,但值得进一步研究与推广。
NOTES
*第一作者。
#通讯作者。