1. 引言
肝癌,通常称为肝细胞癌(HCC),是目前世界上第六大常见癌症,死亡率高,发病率也在不断上升,其病因与环境、饮食或生活方式等因素有关 [1]。例如,有证据显示肝硬化、HBV/HCV感染和非酒精性脂肪肝可能与肝癌易感有关 [2]。然而,肝癌的发生发展是一个复杂的过程,其发生发展的机制尚不清楚。近年来,微量元素在肝癌发生中的作用日益受到人们的关注。证据表明砷暴露可能增加肝癌风险 [3]。相比之下,锌和锰的摄入可降低肝癌的风险 [4] [5]。近年来,镉(Cd)备受关注,因为它被国际癌症研究机构列为人类致癌物 [6]。人们通常通过食物、饮用水和被污染的空气接触到Cd [7]。镉暴露会增加多种癌症的风险,尤其是肝癌,其机制复杂 [8]。
为了明确Cd相关肝癌的分子机制,我们通过对高通量数据的分析,筛选了几个可能在Cd诱导肝细胞恶性转化中发挥作用的关键基因。SLC7A11是一个编码半胱氨酸–谷氨酸反转运体的基因,被选为关键基因之一。生物信息学方法表明,与正常肝组织相比,它在肝癌中过度表达。此外,基于癌症基因组图谱(TCGA)队列的临床数据分析也提示SLC7A11是肝癌的预后因素。这可能具有很大的治疗价值,特别是考虑到SLC7A11在肝癌中过表达。然而,从数据库中检索到的SLC7A11在肝癌中的表达证据很少。因此,本研究旨在通过生物信息学方法深入了解SLC7A11在肝癌中的作用和功能,进一步评估了SLC7A11在肝癌中的临床意义和预后价值。
2. 材料与方法
2.1. 相关试剂
总RNA提取试剂盒、反转录试剂盒和RT-PCR试剂盒均购自中国索莱宝公司。
2.2. 试验方法
2.2.1. 生物信息学采集
从TCGA数据库(https://portal.gdc.cancer.gov/)下载肝癌的miRNA和mRNA表达谱,其中包括所有病人的基因表达谱和临床数据,总共获得396例肝癌组织和160例正常肝组织。临床信息包括病人的年龄,性别、危险因素、肿瘤大小、TNM分期、T分期、N分期、M分期、生存时间和生存状态。
2.2.2. 肝癌组织和正常肝组织的RNA分离及RT-PCR分析
纳入标准:满足三个EASL标准其中之一即可证实为肝细胞癌:1) 组织病理学;2) 超声,MRI,CT,动脉造影其中两项确定病变 > 2 cm且伴有动脉期强化;3) 一项影响技术确定病变 > 2 cm伴有动脉强化且AFP > 400 ng/ML。排除标准:1) 患者经过化疗或者局部、全身放疗治疗;2) 患者身体状况差,无法耐受相关检查或手术,因本身基础身体条件差而影响预后;3) 患者肝癌并非原发病灶,而是由于身体其他组织器官癌症转移所致;4) 患者入院检查发现存在多种疾病,特别是机体中存在除却肝癌的第二种癌症。样本收集前已征得患者知情同意,且患者及家属均已在病人样本收集知情同意书上签字。根据纳入标准和排除标准收集山东大学齐鲁医院肝癌患者和正常的肝组织各6例,用总RNA提取试剂盒试剂提取总RNA,用反转录试剂盒合成cDNA。采用RT-PCR试剂盒,按照制造商程序进行RT-PCR。用GAPDH对SLC7A11 mRNA进行规格化。采用2−ΔΔCt法计算SLC7A11的相对表达量。
2.2.3. 统计学方法
常规临床病理参数(诊断时的年龄、性别、美国癌症联合委员会(AJCC)第8版TNM分期和生存结局采用卡方检验进行评估。使用R软件的MaxStat软件包(maximum selected Rank Statistics)确定用于将患者分为低危和高危组的SLC7A11表达的最佳截断点。Maxstat计算最大选择的log-rank统计量,以确定提供最佳分离(标准化统计量取其最大值)的切点。采用Kaplan-Meier分析估计不同组的生存曲线,采用log-rank检验(Mantel-Cox)比较曲线。使用R统计软件(3.4.1版)进行统计学分析。P < 0.05差异具有统计学意义。
3. 结果
3.1. SLC7A11在TCGA数据库中表达
图1可以看出,纳入369例肝癌组织和160例正常肝组织,发现二者的SLC7A11表达量的差异具有统计学意义,P = 0.036 (P < 0.05)。
3.2. 无病生存期(DFS)和总生存期(OS)分析
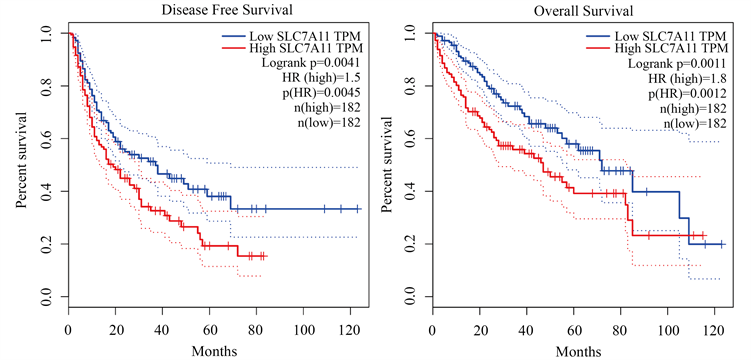
根据Maxstat法确定的截断值将患者分为SLC7A11高表达组(n = 182)和低表达组(n = 182)。与低表达组相比,高表达组的DFS (P = 0.0045)和OS (P = 0.0012)更差(图2)。
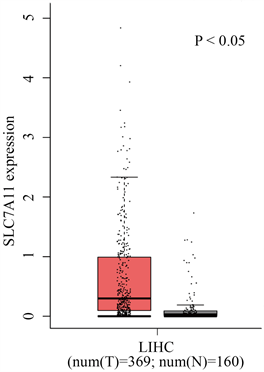
Figure 1. SLC7A11 is expressed in the TCGA database
图1. SLC7A11在TCGA数据库中表达
 (a) (b)
(a) (b)
Figure 2. Survival and disease free survival curves (a); overall survival (b) for patients with high SLC7A11 expression (n = 182) vs. low SLC7A11 expression (n = 182). P-values for significance of difference between high and low expression were calculated using the log-rank test
图2. 高表达SLC7A11肝癌组织(n = 182)与低表达SLC7A11肝癌组织(n = 182)的生存率和无病生存期(a);总生存期(b)曲线。使用log-rank检验计算高表达与低表达差异显著性的P值
3.3. SLC7A11的表达与肝癌患者临床病理学特征之间的关系
本研究分析了60例肝癌组织的SLC7A11的表达情况与该患者临床病理特征的关系。在表1中,SLC7A11的低表达与高表达在AJCC TNM分期、T分期、N分期的差异具有统计学意义,P < 0.05。

Table 1. Relationship between SLC7A11 expression and clinicopathological features in patients with hepatocellular carcinoma
表1. SLC7A11的表达与肝癌患者临床病理学特征之间的关系
TNM分期#:第八版AJCC分期。
3.4. 肝癌患者的生存曲线分析
根据每个病人的风险评分,将整个TCGA集的病人分别按照风险评分中位数分为高风险组和低风险组,进一步绘制Kaplan-Meier曲线和时间相关的ROC曲线,比较高风险组和低风险组的3年生存率和5年生存率。结果表明(图3),在整个TCGA集中,低风险组的生存率高于高风险组。
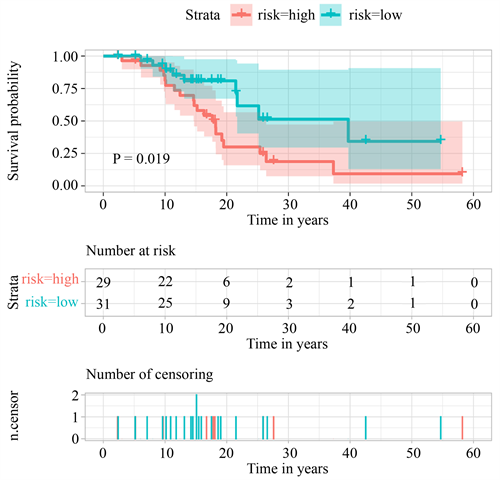
Figure 3. ROC survival curves for high-risk and low-risk patients across the TCGA set
图3. 整个TCGA集中高风险和低风险病人的ROC生存曲线
3.5. RT-PCR分析
RT-PCR检测结果(图4)显示,正常肝组织中SLC7A11的表达量在1.0左右,而肝癌组织中的表达量均在1.5以上。与正常肝组织相比,肝癌患者的肝组织中的SLC7A11的mRNA表达水平明显增高。
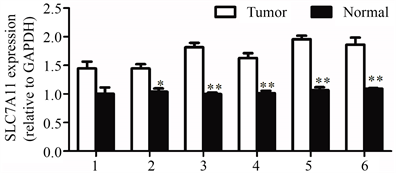
Figure 4. Relative expression of SLC7A11 in human liver cancer tissues and normal liver tissues; Compared with normal group and tumor group, *P < 0.05, **P < 0.01
图4. SLC7A11在人肝癌组织和正常肝组织中的相对表达量;Normal组和Tumor组相比,*P < 0.05,**P < 0.01
4. 讨论
癌症基因组分析发现,SLC7A11是人类癌症中最高的BAP1靶基因,SLC7A11也在氧化应激反应中,氧化应激反应是GO分析中排名最高的生物学过程 [9] [10]。在本研究中,我们利用TCGA数据库探讨SLC7A11基因在肝癌中的临床意义。TCGA数据中信使RNA基因表达分析优于免疫组化方法,在TCGA数据中可能是预测肿瘤预后的最佳方法 [11]。本研究首次利用TCGA数据库报道了肝癌中SLC7A11基因的表达情况。为了扩大这些发现的临床有效性,我们分析了TCGA中所有肿瘤谱系中SLC7A11的表达水平,发现大多数肿瘤谱系中SLC7A11的表达与肝癌的发生有密切联系,高表达组的DFS和OS比低表达组更差。此外,对肝癌中SLC711的生物信息学分析表明,SLC711的表达与肝癌患者的肿瘤分期、T期和M期等临床病理特征相关。与正常肝组织相比,肝癌患者的肝组织中的SLC7A11的mRNA表达水平明显增高。总之,我们系统地展示了SLC711在肝癌中的临床相关性,可用于评估肝癌病人的预后。
NOTES
*第一作者。
#通讯作者。