1. 引言
低碳钢及其合金由于性能优异、结构稳定,经常用做各种建筑材料 [1] 。但是在一些复杂严峻的,如酸、碱、盐的环境下,这些合金也容易被腐蚀。金属材料在各个行业均有大量使用,一旦产生锈蚀痕迹就会破坏金属本身的部分力学性能。金属部分长期在被腐蚀状态下不仅会影响设备的使用寿命,甚至会发生事故,危及人身安全。在缓解金属腐蚀的几种方法中,添加缓蚀剂因为成本低,易操作,效果显著等优点成为了缓解金属腐蚀最广泛的手段之一 [2] 。有机缓蚀剂一般含有N、O、S、P等杂原子,和一些双键、三键、苯环等体系,这些元素都有很强的给电子能力 [3] 。其中苯并咪唑类有机物结构组成为:一个苯环和一个五元环共键相连,五元环包含两个对角位置的N原子和三个C原子,五元环中的N原子和不在共价键上的C原子上带有支链,同时苯并咪唑类缓蚀剂具有毒性小、效率高等特点。在李中普等人 [4] 的苯并咪唑缓蚀剂缓蚀机理研究中也可以了解到苯并咪唑类有机物能够通过化学吸附作用到金属表面形成保护膜,阻挡水分子和腐蚀介质对金属的破坏,从而达到缓解金属腐蚀的作用。
利用Materials Studio软件进行分子动力学模拟可以获得实验无法得到的一些精细数据,能够完整地展示整个运行过程的微观形态,为实际应用提供理论借鉴 [5] 。分子动力学模拟可以确定出最优构型并计算出粒子在特定环境下的相互作用轨迹和结果,在材料学的研究中使用很广泛 [6] 。M. Messali等人 [7] 通过分子动力学计算了Guar gum (瓜胶)与Fe表面的结合能,结果显示Guar gum的结合能很高,表明了瓜胶具有很好的缓蚀效果。Savas Kaya等人 [8] 用分子动力学方法研究了哌啶衍生物与Fe表面的结合能和吸附结构,证明了哌啶衍生物良好的缓蚀能力。本文以苯并咪唑类有机物作为研究对象,依据分子动力学模拟对不同浓度的有机物分子2-苯胺-苯并咪唑(BZA)和2-甲苯-苯并咪唑(BZT)进行对比,研究其缓蚀作用机理。
2. 计算方法
本文选择2-苯胺-苯并咪唑(BZA)和2-甲苯-苯并咪唑(BZT)作为不同基团缓蚀剂分子进行缓蚀能力研究,两种分子的结构如图1所示。
2.1. 量子化学计算方法
密度泛函理论在Materials Studio软件中进行,首先优化分子的几何结构得到稳定构型。对于整个体系,利用公式(1)~(4)可以计算出分子的电荷分布、电子能级、Fukui指数和偶极矩等。利用DMol3工具,在set up页面中进行优化,选择GGA-PW91功能;性质选中Fukui function和Orbitals计算分子的前线轨道分布、吸附活性位点、全局参数:偶极矩(
)、硬度(
)、软度(S)和局部参数:Fukui指数等。计算公式如公式(1)~(4)所示。

Figure 1. Molecular structure of the inhibitor (Left: BZA; right: BZT)
图1. 缓蚀剂的分子结构(左:BZA;右:BZT)
(1)
(2)
(3)
(4)
其中EHOMO指最高占据分子轨道的能量;ELUMO指最低空分子轨道的能量;ΔE代表分子能隙,是ELUMO和EHOMO的差值;
代表化学势,定义为ELUMO和EHOMO之和的二分之一;
代表全局硬度,定义为分子能隙ΔE的二分之一;S代表全局软度,定义为全局硬度
的倒数。
2.2. 分子动力学模型构建
首先利用MS软件的visualizer模块构建BZA和BZT的分子模型,然后对其结构进行优化。模型由三层结构构建而成,并考虑周期边界条件。
第一层为金属表面,选取Fe(001)晶体中的7层铁原子,模拟过程中冻结该表面所有原子。第二层为缓蚀剂溶液层,通过Amorphous Cell模块构建含有500个水分子和分别含有数量为1、5、10、15个BZA (或BZT)分子的溶剂层,用于模拟不同的浓度下溶液的缓蚀情况。第三层为纯水体系,通过Amorphous Cell模块构建含有250个H2O的溶剂层,模拟过程中冻结该层所有原子的坐标。选择Build Layers将三层建立成一个整体,进行分子动力学计算,体系大小为25.79 Å × 25.79 Å × 63.53 Å。
模拟过程中使用COMPASS力场,选用Smart方法对体系进行优化,然后以优化后的模型为初始结构进行分子动力学模拟。模拟选择NVT系综,Andersen恒温器,温度设定为298 K,各分子的起始速度随机产生。库伦相互作用采用Ewald方法,范德华采用Atom based方法计算。截断半径为12.5 Å,模拟时间为4000 ps,模拟步长为1.0 fs,每1000 fs输出一步轨迹信息。
3. 结果与讨论
3.1. 量子化学计算
图2是两种苯并咪唑分子利用DMol3模块优化后的模型,可以看出2种苯并咪唑化合物均含有N、O原子,且分子上苯并咪唑环与苯环及其衍生物在同一个平面上,形成共轭键,理论上具有很强的共轭效应 [9] 。
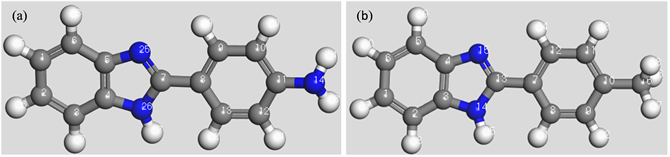
Figure 2. Optimized structures of the Benzimidazole and its derivants BZA (a) BZT (b)
图2. 苯并咪唑及其衍生物优化后的几何构性
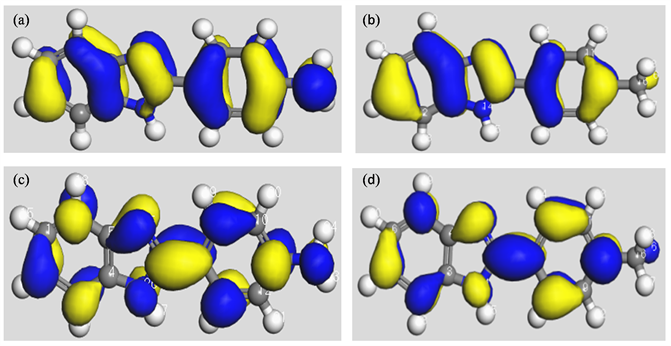
Figure 3. Map of the HOMO and LUMO tracks for BZA and BZT. BZA: (a, c); BZT: (b, d)
图3. BZA和BZT分子的HOMO轨道分布图和LUMO轨道分布图。BZA (a, c);BZT (b, d)
分析缓蚀剂在金属表面的吸附行为要考虑缓蚀剂分子前线轨道的差异 [10] ,因此要分析最高占据分子轨道(HOMO)和最低空分子轨道(LUMO)。图3是分子BZA和BZT的分子轨道图。可以看出两种分子的HOMO和LUMO遍布了所有的环状结构,这种分布可以使缓蚀剂分子的整体部分都吸附在金属表面,从而在金属表面形成稳定的吸附膜,有效阻止水分子等腐蚀介质与金属表面的接触 [11] 。BZA分子的氨基衍生物部分存在分子轨道,BZT分子同样位置处是一个烷基基团不含分子轨道,验证了N元素具有很强的给电子能力。为了定量描述缓蚀剂分子的化学稳定性,表1计算了EHOMO值和ELUMO值,EHOMO值越大说明分子的给电子能力越强,ELUMO值越大说明分子的得电子能力越强 [12] 。ΔE值是两者的差值,ΔE值越大则说明分子的全局反应活性越低,在金属表面吸附的稳定性越差,缓蚀性能越差。由表1可见,BZA分子的ΔE值小,同时硬度值也小,软度比较大,说明BZA分子比BZT分子更容易得电子或者失电子,所以BZA活性最强,缓蚀能力也最强。

Table 1. Global reaction parameters
表1. 全局反应参数
由于全局反映参数仅代表整个缓蚀剂分子的活性强度大小,不能确定具体的局部反应活性部分,所以需要用Fukui指数来研究缓蚀剂分子的亲核反应中心和亲电反应中心,同时可以测定分子的反应活性位点。Fukui函数
定义为电子密度
对电子数N的一阶偏导,
(5)
应用有限差分近似,Fukui函数
可表示为:
(6)
(7)
该指数表示各个原子得电子能力或者失电子能力的强弱,当
值越大,该原子得电子能力越强,当
值越大,该原子失电子能力越强,具体数值为表2所示。

Table 2. Fukui index of BZA and BZT inhibitor molecules
表2. BZA和BZT缓蚀剂分子的Fukui指数
从表2可以看出,
数值较大的是BZA的C11、N25和H16,还有BZT的N15、H17和C10这几个原子,说明这三个原子为亲核反应中心,得电子能力最强。
数值较大的是N14、H16、N25还有H17、N15和C13,这三个原子是分子中最容易失电子的原子。通过计算可知,BZA的H16、N25原子是反应活性中心,BZT的H17、N15原子的反应活性最强。综合量子化学计算结果,2种缓蚀剂分子的反应活性强弱为BZA > BZT,也印证了N原子具有更强的缓蚀能力。
3.2. 分子动力学模拟
3.2.1. 体系平衡
当温度和能量数值在一定范围内变化认为体系达到平衡。在3000~4000 ps时,体系温度围绕着300 K波动,振幅为±15 K,作用能变化在5%以内。由此判断体系已经达到波动平衡,所以选取最后1000 ps计算体系的扩散系数,数密度和缓蚀剂分子的自扩散系数等。
3.2.2. 缓蚀剂分子在Fe(001)表面的吸附构型
图4为在水溶液的环境下,为了研究不同缓蚀剂个数对分子成膜的影响,建立了BZA和BZT缓蚀剂分子个数为1,5,8,10的吸附构型。在最初的构型设定中使两种缓蚀剂分子都随机放置在水溶液中,模拟开始后能够看到前期BZA和BZT伴随着水分子进行剧烈的反应,经过4000 ps时长的反应后,体系达到平衡。在运行轨迹图中可以看到在液相条件下,刚开始时缓蚀剂和水分子剧烈运动,缓蚀剂分子四散开来和水分子充分混合;反应一段时间后缓蚀剂分子开始聚拢,并且向金属表面移动;快结束时缓蚀剂分子全部吸附在金属表面。
缓蚀剂分子数量为1时,初始构型中分子距离金属表面的距离和角度任意排列,运行结束后BZA和BZT都分别平行吸附在Fe表面。这种平行吸附有利于缓蚀剂分子在金属表面形成一层隔绝水和其他与金属反应物质的吸附膜,能够有效地缓解金属腐蚀 [13] 。反应结束后缓蚀剂分子的苯并咪唑环和官能团都平行吸附在Fe(001)表面,也说明了反应活性位点在苯并咪唑环及其官能团上。
当缓蚀剂分子数量达到5时,可以发现BZA和BZT都趋于向金属靠近,并且吸附在Fe表面,其中BZA缓蚀剂膜比BZT缓蚀剂膜覆盖金属的表面范围大。当缓蚀剂分子数量达到8时,大部分缓蚀剂分子缓慢吸附到金属表面并且发生重叠现象,缓蚀剂分子变成两层平铺在金属表面,分子主体部分是环状结构,所以具有一定的刚性 [14] ,没有出现明显的交织现象,形成的缓蚀膜具有一定的孔隙。
当缓蚀剂分子数量达到10时,缓蚀剂分子大部分都跟铁表面有一定的夹角且排列凌乱的吸附在Fe表面,通过观察发现BZA和BZT都形成了两层缓蚀膜其余的分子则以一定的角度吸附在金属表面。

Figure 4. Equilibrium configurations of molecules A-H adsorbed on the Fe(001) surface in liquid phase. BZA (a) (c) (e) (g); BZT (b) (d) (f) (h)
图4. 液相中分子在Fe(001)表面的平衡吸附构型。BZA (a) (c) (e) (g);BZT (b) (d) (f) (h)
3.2.3. 缓蚀剂膜的吸附稳定性
使用分子动力学模拟液相条件下缓蚀剂分子在金属表面的吸附能力大小,可以通过计算比较缓蚀剂分子在Fe表面的吸附能(Eadsorption)来实现。根据热力学原理,在缓蚀剂分子吸附到金属表面的过程中,体系自由能是逐渐降低的,反应过程为放热反应,且吸附能应该为负值。
吸附能公式如下:
(8)
其中,Eadsorption:缓蚀剂分子在铁表面的吸附能;Etotal:一个缓蚀剂分子和金属表面体系的总能量;Emolecule:单个分子能量;Esurface:未吸附缓蚀剂分子时金属表面的能量。

Table 3. Adsorption energy of different inhibitor molecules on the Fe surface
表3. 不同缓蚀剂分子在Fe表面的吸附能
通过表3计算得到,水分子在Fe(001)表面的吸附能为−26.415 Kcal/mol,BZA和BZT的吸附能为−1569.065 Kcal/mol和−1472.245 Kcal/mol,它们的值都是负值,说明是放热反应。吸附能绝对值越大,说明分子与金属表面的吸附效果越好,吸附行为也就越稳定 [15] 。BZA和BZT在金属表面的吸附能绝对值都大于水分子在金属表面的吸附能绝对值,表明BZA和BZT都能吸附在Fe(001)表面隔绝水与金属的接触,形成一层吸附膜,从而减缓金属的腐蚀现象。在Fe(001)面吸附时,苯并咪唑环和官能团都有一定的吸附能力,BZA和BZT的结构分析:两者都具有苯并咪唑环和一个苯环,此外前者拥有一个氨基官能团而后者仅有一个甲基基团,通过分子吸附图的对比和吸附能的计算可以得出BZA比BZT的缓蚀效果更好的结论,且含有N原子的缓蚀剂的缓蚀能力更强。

Figure 5. Concentration profile for water molecules on the metal surface with added inhibitor
图5. 添加缓蚀剂条件下金属表面水分子的数密度值
3.2.4. 缓蚀剂驱替水分子的能力
为了进一步研究缓蚀剂分子对水的驱替效果,计算了在纯水体系和分别带有不同数量BZA和BZT的溶液体系中,水分子在Fe(001)表面的分布情况。在纯水体系中,距离Fe表面最近的位置处有大量水分子聚集在一起,生成出一层致密的水分子膜;加入BZA和BZT后的溶液体系中贴近金属表面的水分子膜被缓蚀剂分子冲散,金属表面水分子密度明显变小。为了定量分析缓蚀剂驱替水分子的能力,可以通过计算体系中水分子的数密度来得到。
在数密度曲线中可以看到曲线具有多个峰值,说明水分子在金属表面处是分层状态,靠近金属表面的最高峰值代表金属表面处水分子的浓度。在未添加缓蚀剂的空白对照组中,水分子浓度峰值为4.859,添加1个BZA和BZT分子后水分子浓度峰值下降到4.822和4.849。当缓蚀剂分子数量逐渐增多时,水分子数密度值分别呈线性关系逐渐减小,且添加BZA缓蚀剂的溶液组总是比添加BZT缓蚀剂的溶液组中的水分子数密度小,当缓蚀剂分子个数为10时,水分子浓度最小,分别为2.483和3.060。图5表明,两种缓蚀剂分子在Fe(001)表面吸附后,能够替换金属表面的水分子,阻碍水分子腐蚀金属,达到抑制腐蚀的作用。其中驱替水分子能力强弱为BZA > BZT,即缓蚀能力大小为BZA > BZT。
4. 结论
1) BZA和BZT分子环状部分及衍生物部分都能吸附在金属表面,分子的活性中心主要集中在环上的C原子和衍生物中的H、O原子上。
2) 在水溶液中,BZA (2-苯胺-苯并咪唑)和BZT (2-甲苯-苯并咪唑)两种缓蚀剂在Fe表面的吸附成膜能力由大到小顺序为BZA > BZT。
3) 官能团不同导致两种缓蚀剂分子缓蚀成膜有差异,从缓蚀剂膜的致密性、金属表面水分子密度、缓蚀剂与金属表面的吸附能等方面最终导致缓蚀性能的差异。
NOTES
*通讯作者。