1. 实验目的
1.1. SF6分解组分检测的意义
SF6气体具有很高的电负性。SF6分子倾向于吸收自由电子,形成质量比较大的负离子,从而削弱了气体碰撞和电离的过程。因此,SF6的电气绝缘强度很高,约为均匀电场中空气的2.5倍。而SF6的灭弧能力约为空气的100倍,其冷却效果远强于空气 [1] 。由于SF6气体具有优异的灭弧能力,绝缘性能以及化学稳定性良好,被广泛用作高压电气设备的绝缘介质。
以SF6气体绝缘设备(Gas Insulated Switchgear, GIS)为代表的SF6气体绝缘设备有着检修周期长、抗污染能力强、占地面积小、不受外界电磁干扰等突出优点 [2] 。GIE变电站的实地运用规模在电力系统中愈发广泛。
但GIS也有其固有的缺点,GIS的内部空间极为有限,工作场强很高,且绝缘裕度相对较小。GIS内部一旦出现绝缘缺陷,极易造成设备故障,引起的停电时间较长,检修费用也很高。GIS内部出现绝缘缺陷时一般会出现局部放电现象(Partial Discharge, PD) [3] ,局部放电点的高温将会加速绝缘热劣化;在放电能量的作用下,SF6出现化学断键产生的不稳定产物与气体绝缘开关内部微量水、微量氧结合,进而形成物理化学性质更为稳定的SO2、SOF2、SO2F2、HF、SF4和H2S等多种分解气体。此类反应不可逆,这些气体无法恢复成SF6,导致绝缘性能下降 [4] ;
因此,通过监测SF6分解气体组分的成分和浓度能及时、有效地发现GIS设备内部潜伏性绝缘缺陷,进而对GIS设备的运行状态和绝缘水平进行评估。通过及时预警,避免发生因潜伏性绝缘缺陷造成的突发性故障,这种方法能进一步完善GIS故障的综合诊断与评估体系,具有重大的研究意义以及广阔的应用前景 [5] 。
1.2. SF6分解机理
在电或者热效应的作用下SF6分子中S-F键会在高能电子的撞击下发生断裂,分解出F原子并生成SF4、SF3、SF2等一系列低氟化物。若SF6气体本身是纯净的,不存在其他杂质,则这些低氟化物会迅速与分解出来的F原子发生复合,还原成SF6。但是如果环境中存在微水、微氧、有机物及金属颗粒等杂质时,这些低氟化物会与杂质发生化学反应,并生成其他的硫氟化物。在少量水与氧的作用下,SF6的分解产物中会生成SOF2、SO2F2和SO2。SOF4不是很稳定,一般作为过渡产物会进一步分解生成SO2F2,而SOF2可能会生成SO2 [6] 。这些产物对GIS设备的金属材料和固体绝缘具有较强的腐蚀作用,不仅增加了设备的维护成本的负担,还给电力系统输送电环节的安全可靠带来了威胁 [7] 。
因此,SO2、SOF2和SO2F2这三种气体是实际GIS中SF6气体故障分解的重要特征组分,本文将SOF2作为目标气体,研究TiO2纳米管气体传感器检测SF6分解组分的气敏特性以及气敏机理,如图1所示。
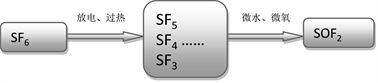
Figure 1. SF6 decomposes and reacts with oxygen and water under discharge or overheating conditions to form SOF2
图1. SF6放电或过热条件下分解与氧、水反应生成SOF2
1.3. TiO2研究现状
德国克劳斯塔尔工业大学的GustusR等学者通过空气、氧气、氮气等气体分别产生不同种类的等离子体用于处理TiO2材料,并利用光电子能谱表征处理效果,发现在TiO2表面层生成可再生结构。日本学者Kenji Yamada等学者通过等离子体表面修饰技术制备了氮掺杂TiO2颗粒,放电功率为100~400 W,处理时间2~20 min,相继用氮气和氩气产生的等离子体处理TiO2颗粒,表征结果表明处理后产生了Ti-N键,可见光活性增强。美国肯塔基大学的Syed Z. Islam等学者研究了N2/Ar混合气体产生的等离子体改性后的TiO2材料在可见光催化方面的性能。在微波等离子体CVD系统中实现氮掺杂,放电功率控制在300 W,频率控制在2.45 GHz,改性时间控制在60~120 min。测试显示,改性时间为150 min的N-TiO2具有最佳的光催化表现。
目前纳米TiO2在气体成分及浓度检测领域的研究都还局限于CO、H2、O2、NH3、NO2、乙醇和丙酮等常见单一成分气体,在检测SF6故障分解气体方面的研究也还很有局限。
2. 实验方法
2.1. 密度泛函理论
基于第一性原理的计算结果包括整体的能量和系统的电荷分布特性,例如吸附体系的电荷密度和态密度等电子分布参数,并且可以由以上计算得到的物理量计算更多具有工程价值的物理参数 [8] ,例如弹性常数,点、面缺陷的形成能等。当考虑的对象仅限于一个电子时,则可以目标电子为计算中心,同时将体系的剩余电子对中心电子的影响近似视为某特定形式的势场,从而通过将多电子的计算归结为单电子的计算问题,即单电子近似或平均场近似 [9] 。上世纪下叶的学者Phohenberg和W Kohn发现能够通过密度泛函表示系统中电子间相关势,还考虑把多种因素纳入设计的算法之中,正式提出意义甚为深远的密度泛函理论(Density Functional Theory, DFT),从而实现基于自洽场近似的手段计算薛定谔方程的手段。
密度泛函理论中的薛定谔方程被改进为K-S方程,公式里面的动能使用的是相互之间并无关联的自由电子动能 [10] ;而公式中的势能包括电子之间的作用能以及电子所处的离子作用下的势能,其余的为交换关联能,如图2所示。
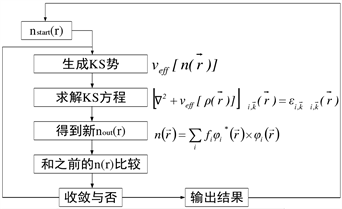
Figure 2. Self-consistent calculation process based on DFT
图2. 基于DFT自恰计算过程
2.2. 能带理论、前沿分子轨道理论
根据能带理论,两个原子在相互之间的距离相当大时可以不考虑其交互影响。对单一原子而言,能级结构可以看作是无差异的。当原子相互间隔越来越小时,它们的作用会不断变大。两个原子的最外层电子的波函数会出现相互交叠且电子波函数的交叠会随原子间的间距变小而越大,与此同时,原来的两个原子各自的数个处于同样能量的能级会发生分裂并形成处于不同能量值范围的数个能级,此时经过能级分裂得到的能级间的能量间距变大,如图3所示。
能带指在允许电子存在的一定能量范围内准连续分布的电子能级;能隙指各能带之间存在的间隔,不允许电子存在,故也称作禁带;满带指一个能带的全部能级都被电子占据;空带与满带相反,整个能带的能级都未填电子;相应价电子填充的能带称作价带;近毗邻价带之上的空带,可以接受从价带跃迁的电子,起到导电作用,故称其为导带。
2.3. 前沿分子轨道理论
前沿分子轨道理论认为前线轨道是最为活跃的部分。当分子发生电子转移时,首先从被占据轨道中能量最高的那个轨道给出电子,并且一定将俘获的电子优先置于具有最低能量的空轨道上,而最高占据分子轨道(HOMO)和最低未占轨道(LUMO)是电子的运动和反应最为活跃的地方。前线轨道与一个反应体系能否产生化学反应息息相关,除前线轨道以外的其他能级的分子轨道作用于化学反应的程度不高,可以暂时不考虑在内。分子的种类不同,则它们的HOMO和LUMO的能级高低也相互有差异。若一种物质的分子具有能量差很大的HOMO和LUMO,则其性质相较能量差值小的分子具有更稳定的性质,相较而言被激发的难度更大。
3. 算例验证
3.1. 计算方法和参数设置
此仿真计算在Materials Studio软件的Visualizer模块建立模型,在Dmol3模块中完成计算和分析。首先,建立锐钛矿型TiO2 (101)模型和SOF2分子的模型,如图4所示。其次分别优化TiO2 (101)和SOF2分子的模型。然后用氮原子取代TiO2 (101)表面氧原子而后再进行优化以使微观模型的结构参数更加接近实际的理化标准。随后对TiO2 (101)吸附SOF2结构进行优化,分别以硫原子、氧原子以及氟原子靠近方式进行三次优化达到稳定吸附结构。最后,计算分析了表面吸附气体分子的稳定吸附体系的物理化学性质。
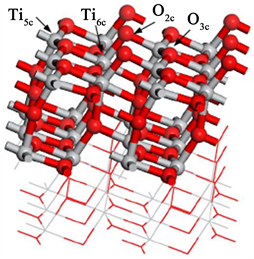
Figure 4. SOF2 and TiO2 (101) model
图4. SOF2和TiO2 (101)模型
由于所构建的锐钛矿型TiO2 (101)表面含有许多原子,并且包含钛原子的d轨道和吸附体系的能隙两种计算,因此采用了具有较高计算精度的一般梯度近似(GGA)代替局部密度近似(LDA)。电子的相互作用效应是由PBE函数完成的。为了得到更精确的计算结果,还用双偏振数值基(DNP)拟合d轨道和p轨道偏振函数来计算原子轨道。能量收敛设置为1.0e−5 Ha,能量梯度为0.002 Ha/Å,原子位移为0.005 Å,自洽场电荷密度收敛精度为1.0e−6 Ha,布里渊k点网格为1 × 1 × 1。利用迭代子空间(DIIS)的直接反演加快自洽场的收敛速度,减少计算时间,提高计算效率。该计算还考虑了分散力,或范德华相互作用,通过使用密度泛函理论方法。
3.2. N-TiO2模型建立
氮掺杂二氧化钛是在优化好的二氧化钛模型上进行原子取代,用一个氮原子取代二氧化钛表面的氧原子形成Ti-N键。
其中,氮掺杂的TiO2,如图5所示,未改性TiO2及N-TiO2晶面的态密度图如图6所示,未改性TiO2晶面的能带,如图7所示。从图6的对比中可以看出,氮掺杂在一定程度上降低了TiO2的能隙。本文研究了纳米TiO2的气敏特性,能隙的减小使价带电子更容易跃迁到导带,电子跃迁可以提高氮TiO2吸附膜的导电性,这意味着对特定气体有更好的敏感性。为了获得更精确的数据,计算了最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO),其中未掺杂TiO2的能隙为1.847 eV,氮掺杂二氧化钛的能隙减小到0.408eV,根据此数据也可表明N-TiO2降低了TiO2能隙。
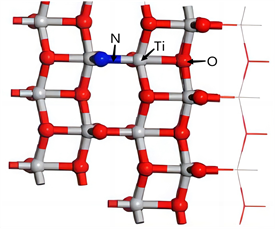
Figure 5. View of nitrogen-doped TiO2
图5. 氮掺杂TiO2视图

Figure 6. The comparison of the density of states of unmodified TiO2 and N-TiO2 crystal planes
图6. 未改性TiO2及N-TiO2晶面的态密度对比图
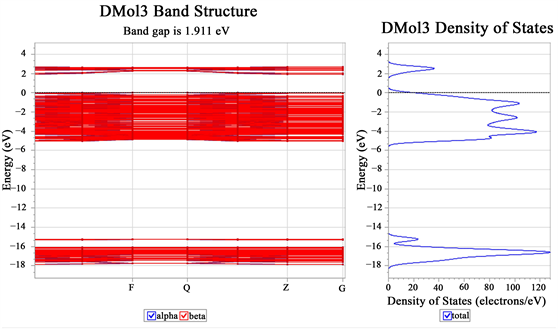
Figure 7. Energy band diagram of unmodified TiO2 crystal plane
图7. 未改性TiO2晶面的能带图
3.3. N-TiO2吸附SOF2的参数计算
为了找到气体分子在N-TiO2晶面上的稳定吸附位置,需要将SOF2分别以不同角度接近N-TiO2,即分别以S原子、S原子和F原子靠近N原子,并计算每个结构的吸附参数。吸附能反映气体分子吸附于晶体表面的能力,是指晶体表面与气体分子吸附过程中总体能量的变化,吸附能用Ea表示,计算公式如下:
Ea = Esur + gas – Egas – Esur (3.1)
其中Egas,Esur和Esur + gas分别是单个气体分子的能量、气体分子被吸附前吸附表面的能量和气体分子被吸附后整个吸附系统的能量。Ea < 0表示过程中释放能量,吸附可以自发的发生;绝对值越大,释放的能量越大,说明吸附作用越强,从而形成更稳定的吸附结构。反之亦然。
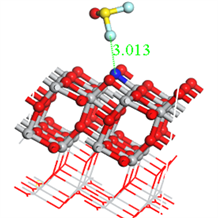
Figure 8. The structure of SOF2 adsorbed on the N-TiO2 crystal plane with different atoms approaching each other
图8. SOF2以不同原子靠近的方式吸附于N-TiO2晶面的结构
为了更好地了解吸附前后电荷数的变化,要计算出晶面与气体分子吸附结构的密立根(Mulliken)电荷分布,气体分子与晶面吸附时与单个分子存在时的电荷变化称为电荷转移量,用Q来表示。当电子从分子转移到晶面时Q为正。气体分子与晶体表面在稳定的吸附结构中最近的距离称为吸附距离。

Table 1. SOF2 adsorption N-TiO2 surface characteristic parameters
表1. SOF2吸附N-TiO2表面特征参数
SOF2分子吸附N-TiO2晶面有三种方式,吸附稳定结构如图8所示。吸附参数如表1所示,以S原子靠近吸附时,吸附能为−1.333 eV,吸附距离为1.483埃。以O原子靠近吸附时吸附能为−1.251 eV,吸附距离为2.642埃。以氟原子靠近时吸附能为−0.735 eV,吸附距离为3.013埃。各个原子靠近吸附能大小比较为S > O > F。各个吸附中气体分子均得电子,吸附表面失电子,电子均从N-TiO2晶体转移到气体分子,增大了电阻性,且电荷转移量相当,几乎为零。吸附距离大小比较为S < O < F。以上比较说明SOF2更易于以S原子靠近方式稳定吸附于N-TiO2晶面。
以分子前线轨道来看,通过计算N-TIO2晶体吸附前和吸附气体分子之后的HOMO与LUMO,可以得出吸附结构的能隙宽度,以1Hartree = 27.2114 eV换算。能隙宽度可以反映吸附后结构中的电子在整个HOMO与LUMO轨道之间转移的难易程度,即电子从价带顶跃迁到导带底端的能力。能隙越小,价带电子越容易跃迁到导带,让吸附基底的导电性能增强,使得气敏特性更好。

Table 2. Orbital parameters of the stable structure on the N-TiO2 crystal surface adsorbed by SOF2
表2. SOF2吸附N-TiO2晶体表面稳定结构的轨道参数
通过分析表2的数据可知,当SOF2分子通过S原子与O原子靠近吸附时,吸附结构的能隙值|HOMO-LUMO|很小,与N-TIO2晶体能隙值相似,几乎对晶体表面的能隙宽度没有影响。而当分子通过F原子靠近吸附时,吸附结构的能隙值则很大,远远超过TIO2晶体能隙的值。
如图9所示SOF2以不同原子靠近的方式吸附于N-TiO2晶面稳定结构的态密度,从气体分子态密度图中可以看出p轨道对气体分子的态密度贡献是最大的,因此将气体分子总的与p轨道的态密度一起展现在图里。
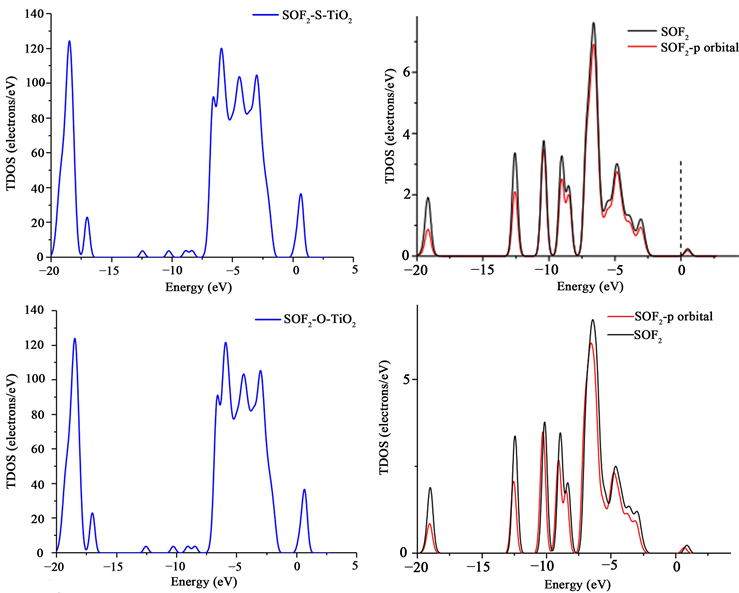

Figure 9. The density of states of the stable structure of SOF2 adsorbed on the N-TiO2 crystal plane in the way of different atoms approaching
图9. SOF2以不同原子靠近的方式吸附于N-TiO2晶面稳定结构的态密度
4. 结论
本文模拟了SF6分解组分SOF2在N-TiO2 (101)表面的吸附过程。根据计算的吸附参数分析了吸附机理;通过与本征和掺金二氧化钛(101)表面的对比,得出N-TiO2 (101)气敏性能的影响,并得出以下结论。
① 经过仿真计算可以看出TiO2晶面的费米能级位于带价顶端,表面为缺失电子的状态,在与气体分子SOF2吸附之后使得表面电荷重新分布,禁带宽度改变。
② 从仿真实验计算出的数据表明,O原子和S原子吸附能明显较高,较F原子而言,O和原子S原子更容易稳定吸附于N-TiO2。
③ SOF2吸附于N-TiO2晶面达到稳定结构以后,电荷均从晶体表面转移到了气体分子,能隙值均变大。电荷转移量以及能隙值的分析结果是一致的。以吸附能、吸附距离、电荷转移量以及能隙值结合分析来看,SOF2吸附N-TiO2使得晶体阻抗增大,导电率减小,气体感应反映减弱。各个原子吸附后气敏特性大小比较为S > O > F。