1. 引言
当传统化石燃料濒临枯竭的同时也为世界带来源源不断的污染,在求生与提高生活质量的强烈愿望推动下,引发了全球寻找可替换的新一代能源设备的浪潮,比如金属-空气电池、可再生燃料电池 [1] [2] [3] 。由于高转换效率、高能量密度、低污染、可直接将化学能转化为电能,燃料电池作为一个有前途且能替代传统发电技术的装置已被广泛接受 [4] [5] [6] 。作为燃料电池中至关重要的一部分,OER催化剂吸引了全世界研究者的关注,同时这一研究也承载了无数的机遇与挑战。
早前一些文献认为Pt [7] [8] 、Ru [9] 、Ir [7] [8] [9] 、Pd [10] 等都有较好的电催化活性,同时这些贵金属元素与一些常见的过渡金属形成合金材料,成为一种较有前途的阳极电催化材料 [11] 。最有效的OER催化剂是IrO2 [12] [13] 和RuO2 [12] 。然而,由于这些贵金属及其氧化物由于其成本高、资源短缺,阻碍了它们的广泛应用,此外这些催化剂也很难长期在碱性介质中稳定存在。因此丰富度很高且相对稳定的钙钛矿 [14] 与过渡金属基的催化剂成为了OER催化剂的代替品。近些年也尝试将纳米碳材料与过渡金属基催化剂形成复合物,表现出更为卓越的催化性能。其中宫建茹老师课题组 [15] 提出了将Fe2O3负载在石墨烯或者碳纳米管上,发现这两种碳材料在提高结构和导电性能的协同作用中对于水解离都起到了很好的促进作用。同时在过渡金属中,尝试将Fe3+离子掺杂在α-Ni(OH)2催化剂中显示出更高的OER活性,但是Fe3+离子在提高OER活性所扮演的角色上还未探索出实质。目前研究人员提出了几种解释,其中包括Fe3+离子增强了NiOOH的导电性,或者另一种解释是Fe3+离子掺杂在α-Ni(OH)2形成NiFe层状双氢氧化物,即NiFe-LDHs结构 [16] [17] [18] 。经过实验证明,镍铁水滑石在电解水过程中表现了高效的催化性能,并且可以成为OER催化剂的廉价替代品。目前,大多数关于LDHs的研究主要是基于实验上的合成、表征及性能测试,理论上仍未探索出反应的根本因素。本课题组两年前曾做过关于NiFe-LDHs催化OER的理论计算,选取(001)晶面研究对象,研究结果发现其能垒比较高,并且没有涉及到金属活性中心作为位点,未涉及吉布斯自由能的计算和过电位的计算 [19] 。而本文旨在通过理论计算DFT + U方法研究NiFe-LDHs (100)晶面暴露出来的金属位点即Fe位和Ni位作为活性中心的催化氧析出反应,计算基元反应步的吉布斯自由能变及过电位,并分析电子的态密度。
2. 计算模型与方法
2.1. 计算模型
通过Materials Studio计算软件搭建了NiFe-LDHs,其中层间插层阴离子为碳酸根离子。其元胞视图如图1所示。搭建的模型大小为10.490Å × 10.490Å × 7.260Å,α = 90˚,β = 90˚,γ = 120˚。结构的Ni、Fe原子个数的比例为2:1,Ni原子为+2价金属,一个元胞中包含8个Ni原子;Fe原子为+3价金属,一个元胞中包含4个Fe原子。其中包含上下两个层板,由于Fe3+的存在,使层板带正电荷,层间用阴离子平衡电荷,元胞中所含原子总数为68个。优化后晶格参数变为10.445Å × 10.541Å × 6.850Å,α = 92.02˚,β = 89.50˚,γ = 120.25˚。
众所周知,不同的晶面具有明显不同的催化活性,对NiFe-LDHs以(100)方向对其优化成功的体相结构进行切面,得到初步NiFe-LDHs (100)晶面模型,需要注意的是,该晶面与本课题组之前研究的晶面不同 [19] 。NiFe-LDHs (100)晶面结构模型的晶面面积为10.54 × 6.85 Å,总共包含8个Ni原子,4个Fe原子,30个O原子,24个H原子,2个C原子,原子总数为68个。为了将此超晶胞结构与上下周期结构隔离,在模型上方增加了厚度为16Å的真空层,总高度为27.86Å。(100)晶面截取时分为两种情况,一种是Fe原子暴露为反应面(如图2),一种是Ni原子暴露为反应面(如图3),设置面模型参数对(100)晶面进行优化。
 (a) (b)
(a) (b)
Figure 1. Model of bulk NiFe-LDHs, side view (a) and top view (b) of the model. Figures depict Fe in purple, Ni in green, O in red, H in white, C in gray
图1. NiFe-LDHs的元胞结构模型图。(a) 主视图,(b) 俯视图,紫色为Fe,绿色为Ni,红色为O,白色为H,灰色为C
 (a) (b)
(a) (b)
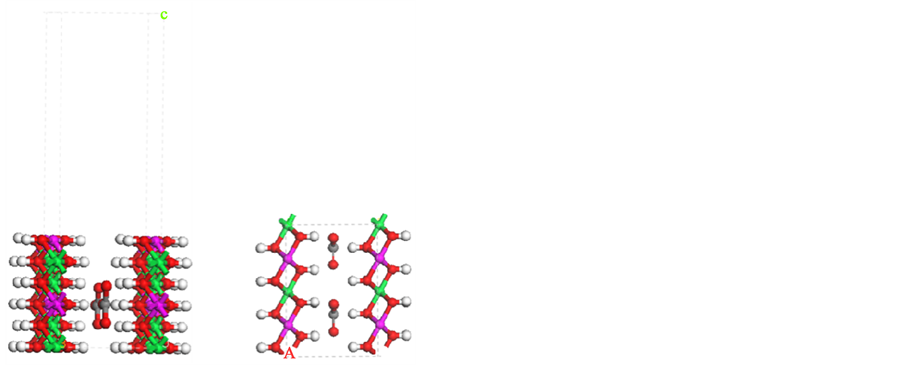
Figure 2. Model of NiFe-LDHs (100) surface with Fe atom exposed, side view (a) and top view (b) of the model
图2. Fe原子暴露的NiFe-LDHs (100)晶面结构。(a) 主视图;(b) 俯视图
 (a) (b)
(a) (b)
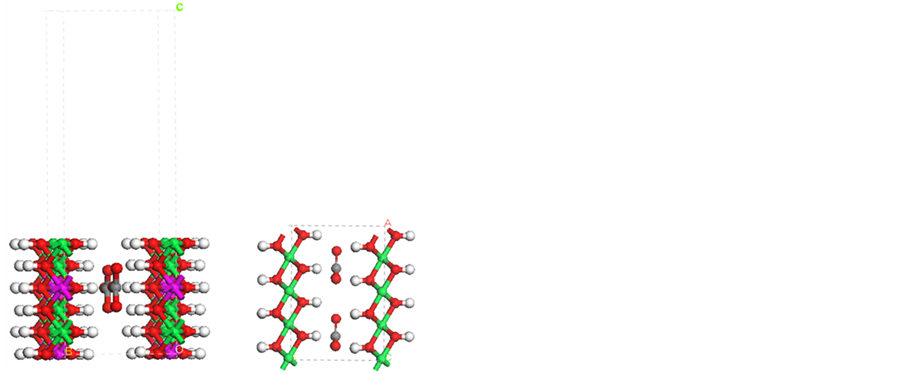
Figure 3. Model of NiFe-LDHs (100) surface with Ni atom exposed, side view (a) and top view (b) of the model
图3. Ni原子暴露的NiFe-LDHs (100)晶面结构。(a) 主视图;(b) 俯视图
2.2. 计算方法
使用自旋极化的密度泛函理论(DFT)和平面波赝势方法进行各反应中间体的结构优化和能量计算。根据最近对于镍铁氢氧化物的计算方法,选择广义梯度近似(GGA)下的PBE泛函进行计算。截断能(cutoff energy)的设置取值为400 eV。对于NiFe-LDHs结构的布里渊区设置,采用了Monkhorst–Pack网格k点空间取样。在研究中,减小d电子的强关联作用,往往使用DFT + U的方法,从而使得计算结果更加可信,DFT + U的方法被认为可以减少DFT-PBE的位移误差并且提高NiFe-LDHs的电子结构描述。根据之前使用密度泛函理论研究的镍、铁氧化物或者氢氧化物的研究,Fe的U值选取的是5.30,Ni的U值选取的是6.45。计算精度上采用了单个原子受力作为标准,结构优化均设置为0.05 eV/Å。系统总能的变化小于1 × 10−4时,驰豫过程结束。
针对NiFe-LDHs (100)晶面,选择Nørskov课题组所简化的在碱性介质中的4电子机理 [20] ,该机理的形成是因为之前的研究通过DFT计算表明在贵金属或者过渡金属表面存在很高的活化势垒,因此考虑一种氧原子通过缔合机理形成氧气的过程,例如通过HOO*物种形成氧分子的经过。后续研究将会进行其他机理的计算,譬如OER分解机理。为了研究在该同一晶面上不同位点的反应活性,每一步基元反应所得到的吉布斯自由能变化(△G)是必要核心参数,本论文中获得△G值的计算方法可以参照由Nørskov组提出的简化的计算方程进行了计算。计算采用了4电子机理:2H2O(l) + * ↔O2 + 4H+ + 4e−。在化学反应过程中吉布斯自由能的变化(ΔG)可以通过ΔE、ZPE、TΔS计算而得,ΔG = ΔE + ΔZPE − TΔS − eU + kbTlnaH+。在这项工作中提出和讨论的自由能假设在标准条件下(pH = 0,T = 298.15 K)进行,ΔE是通过密度泛函理论计算得到的吸附能。零点能(ZPE)也是通过密度泛函理论由频率分析获得。T是温度(298.15 K),熵随温度的变化而改变,计算时采用标准熵 [20] 。eU是当偏压施加在一个电子上的能量转移。kbTlnaH+ = 2.303kbTpH,单位为V,对于酸性介质下,理论中一般将pH值设置为0。因此在本文中,kbTlnaH+此项数值为0。根据标准氢电极(SHE)定义可知,一个质子和一个电子的自由能之和等同于标准氢电极下氢气自由能的1/2 (在pH = 0,p = 1 atm,T = 298 K条件下,1/2H2 → H+ + e−) [21] 。在该方程中,包括四个基元反应步骤,其反应机理与吉布斯自由能的计算公式如下所示:
 (1)
(1)
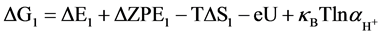 (1a)
(1a)
 (2)
(2)
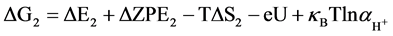 (2a)
(2a)
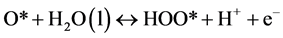 (3)
(3)
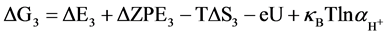 (3a)
(3a)
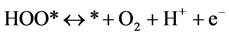 (4)
(4)
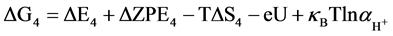 (4a)
(4a)
3. 结果与讨论
3.1. NiFe-LDHs (100)晶面Fe/Ni作位点催化OER的结果
Fe作反应位点,催化OER时各个吸附物种的结构在图4中给出,并按1 - 4的顺序进行编号;Ni作反应位点,催化OER时各个吸附物种的结构在图5中给出,并按5~8的顺序进行编号。以Fe位点催化过程进行描述,当进行OER反应时,起始物即暴露出反应位点,用*表示,结构为图4中的1*。一分子H2O靠近反应位点,经过与反应位点发生碰撞,该过程中失去了一个质子和一个电子,与此同时位点上吸附了一个OH,得到了HO*,见图4中的2 HO*。第二步HO*自身发生反应,失去了一个质子和一个电子,得到了O*,如图4中的3O*。第三步又有一分子H2O靠近HO*,通过碰撞反应,再次失去了一个质子和一个电子,而原本的O*又吸附了一个OH,得到了HOO*,即图4中的4HOO*结构。第四步HOO*结构容易脱去两个O原子,在该过程中失去了一个质子和一个电子,两个O原子变成O2,HOO*又恢复为原始的反应结构,以供下次OER过程的进行。以Ni位点催化OER的过程,在图5中由结构5*、6HO*、7O*、8HOO*表示,反应机理与Fe位点催化过程相同。由表1可以看出每一步基元反应计算得到的ΔE、ΔZPE、−TΔS、ΔG的数值。同时经过优化后得到了稳定的各反应物种的结构,其中优化后结构的Fe-O、Ni-O、O-O的键长与Fe-O-H、Fe-O-O、Ni-O-H、Ni-O-O、O-O-H的键角表示在表2中。

Figure 4. Structures of all the species in the OER on the Fe site of NiFe-LDHs (100) surface. 1-4X* represent the adsorbed species, respectively
图4. NiFe-LDHs (100)晶面Fe作催化位点的OER各反应结构,1-4X*分别代表吸附物种
Figure 5. Structures of all the species in the OER on the Ni site of NiFe-LDHs (100) surface. 5-8X* represent the adsorbed species, respectively
图5. NiFe-LDHs (100)晶面Ni作催化位点的OER各反应结构,5-8X*分别代表吸附物种
表1. NiFe-LDHs (100)晶面两种不同位点每一步基元反应的ΔE、ΔZPE、−TΔS、ΔG,能量单位为eV

Table 2. Bond distance and bond angle for each reaction species on NiFe-LDHs (100) surface
表2. NiFe-LDHs (100)晶面两种不同位点反应物种的键长、键角
3.2. NiFe-LDHs (100)晶面Fe/Ni作位点的吉布斯自由能图
当选取Fe原子作位点时,该反应流程的吉布斯自由能图根据ΔG = ΔE + ΔZPE − TΔS – eU + kbTlnaH+公式,绘制如图6(a)所示。在自由能图中可以看出,以金属Fe作位点的决速步为第二步,即*与一分子H2O反应后得到了HO*,HO*自身失去一个质子和一个电子,得到了O*结构,该步骤ΔG为1.933 eV。当选取Ni原子作位点时,该反应过程的决速步同时也为第二步,该步骤ΔG为2.215 eV。在研究OER过程中,一个重要的参数是不可或缺的,即理论过电位(ƞ),它是衡量电位决速步的重要指标,可以从自由能图中计算而得。在之前很多关于OER的理论研究中,均提及了理论过电位概念。也就是说,本文可以根据OER过程中的过电位决速步的高低判断催化活性的好坏:GOER = max[ΔG1, ΔG2, ΔG3, ΔG4]。公式中的ΔG1-4指的是在标准条件下(pH = 0, T = 298.15 K),且U = 0 V时,不同晶面不同位点上发生OER反应的4个步骤的自由能的变化。ƞOER = (GOER/e) − 1.23 eV。通过此公式计算可得,Fe位点催化OER的过电位是0.703eV, Ni位点催化OER的过电位是0.985 eV。相比而言,可以看出Fe作为OER催化活性位点的效果要相对好一些。Nørskov课题组研究了(Ni,Fe)OOH以Fe或者Ni作为位点进行OER流程,发现Fe的过电位低于Ni的过电位,与本文结论相一致。 [22] 由于参考Nørskov课题组的研究方法,本研究主要讨论了不同金属作为位点的电位决速步(Potential Determination Step, PDS),即可初步证明催化性能的好坏,并未考虑反应能垒的变化。
3.3. NiFe-LDHs (100)晶面Fe/Ni作位点的态密度分析与电荷分析
从图7中可以看出NiFe-LDHs (100)晶面上不同结构的PDOS与DOS图。从图中可以看出,在费米能级处出现band gap,而且带隙不是很大。Fe原子与Ni原子的d轨道态密度图在价带中都呈满带,Fe原子能量主要位于−10~−8 eV之间,说明Fe是三价金属,为3d5高自旋状态;Ni原子能量主要位于−7~ −4 eV之间,说明Ni是二价金属,为3d8低自旋状态。而导带中的都有尖峰,对于电子传递起到了很大的作用。O原子的p轨道在价带中也是满带,而在导带基本没有峰,说明O原子对于电子传递的作用微乎其微。当Fe原子作为OER的反应位点时,费米能级左移,电子有利于从体相移动到表面,对催化反应有利,因此可以说Fe原子作位点相对于Ni原子作位点更容易促进反应的发生。各反应物种作为位点的金属原子的电荷分析如图8所示,Bader Charge表示的是作为位点的金属原子周围的电荷变化,从图8中可以看出Fe原子和Ni原子在反应路径中周围的电荷数都是时刻发生变化的,从而带动了它们的化合价变动。
 (a) (b)
(a) (b)
Figure 6. Free-energy diagram for each elementary steps at the (a) Fe site and (b) Ni site of NiFe-LDHs (100) surface
图6. NiFe-LDHs (100)晶面(a) Fe,(b) Ni作位点的各基元反应自由能图
 (a) (b)
(a) (b)
Figure 7. Density of state on d-band of Fe atom/Ni atom and p-band of O atom at the Fe site (a) and Ni site (b) of NiFe-LDHs (100) surface
图7. NiFe-LDHs (100)晶面Fe (a),Ni (b)作位点的态密度图
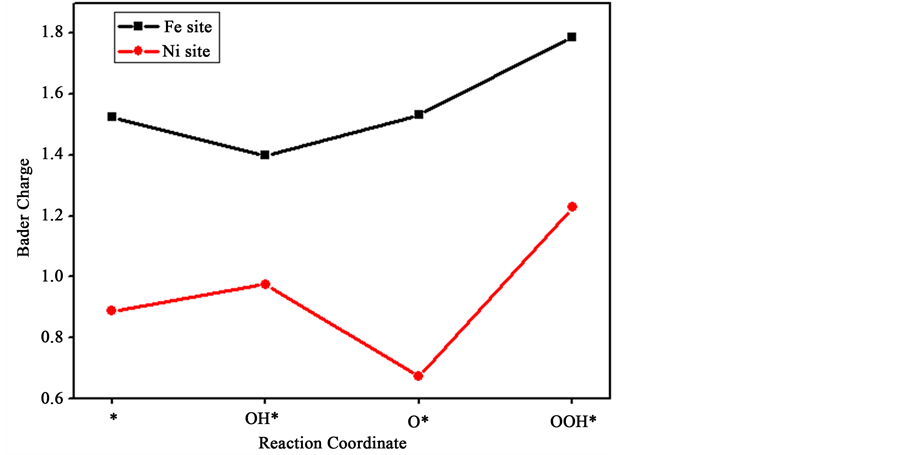
Figure 8. Bader Charge of Fe site (a) and Ni site (b) of NiFe-LDHs (100) surface
图8. NiFe-LDHs (100)晶面Fe (a),Ni (b)作位点的电荷分析图
4. 结论
本文对于NiFe-LDHs (100)晶面应用DFT + U计算方法及不同金属原子暴露在晶面表面作为位点催化氧气析出反应进行第一性原理研究。反应机理分为四步基元反应,通过计算与数据处理,绘制出比较直观的吉布斯能自由图,从而得到了两种不同位点催化的过电位,且Fe作位点催化OER的过电位要低于Ni原子。最后根据态密度分析图,可以看出金属Fe原子比Ni原子在结构中起到了更多的电子传递作用。
NOTES
*通讯作者。