1. 引言
猪瘟病毒(classical swine fever virus, CSFV)是黄病毒科瘟病毒属有囊膜的单股正链RNA病毒 [1] 。病毒基因组编码一个约有4000个氨基酸的多聚蛋白,此蛋白在翻译后可由细胞和病毒蛋白酶裂解生成4个结构蛋白(C、Erns、E1和E2)和8个非结构蛋白(Npro、P7、NS2、NS3、NS
4A
、NS4B、NS
5A
和NS5B) [2] 。结构蛋白E2位于病毒的囊膜表面,参与病毒的感染过程,能诱导产生强有力的保护性免疫,是CSFV的主要保护性抗原蛋白。E2可分为A、B、C、D四个抗原域,其中B、C区域为产生抗原决定簇的主要区域 [3] [4] 。
酵母细胞表面展示系统是一种固定化表达异源蛋白质的真核展示系统,近几年来已被广泛应用于生物催化剂、细胞吸附剂、活疫苗、环境治理、蛋白质文库筛选、高亲和抗体、生物传感器、抗原/抗体库构建、癌症诊断等领域 [5] 。
本研究利用酿酒酵母表面展示系统(以细胞壁甘露糖蛋白а凝集素碳端320个氨基酸域为锚定蛋白)将CSFV E2蛋白BC抗原域展示在酵母细胞表面,用间接免疫荧光方法检测了带有His蛋白标签的BC抗原域融合蛋白的表达,为基于E2蛋白BC抗原域的酵母载体疫苗研制奠定了基础。
2. 材料与方法
2.1. 材料
2.1.1. 菌株、载体
细胞株E. coli DH5α购自北京全式金生物技术有限公司;酿酒酵母(Saccharomyces cerevisiae) W303、表达载体p1V5-AG [6] 及酿酒酵母w303由东北大学杨婷博士提供;pcDNA3.1表达载体、pVEXE2重组质粒(含E2序列)由本实验室保存。
2.1.2. 试剂
限制性内切酶BamH I和EcoR I、DNA Marker DL2000、T4 DNA Ligase、10 × T4 DNA Ligase Buffer、6 × Loading Buffer为TaKaRa公司产品;DNA Marker 5000,2 × Power Pfu MasterMix购自北京BioTeke生物技术有限公司;质粒DNA小量快速制备试剂盒、胶回收试剂盒购自爱思进生物技术(杭州)有限公司;His-probe (AD
1.1.10
) mouse monoclonal IgG和goat anti-mouse IgG-FITC购自Stanta Cruz Biotechnology。引物(Primer)合成和PCR产物测序由中美泰和生物技术(北京)有限公司完成。
2.1.3. 培养基
Yeast Nitrogen Base W/O Amino acids,adenine,L-Trytophan,L-Histidine,L-Leucine为BIOSHARP公司产品;胰蛋白胨、琼脂粉购自北京奥博星生物技术有限责任公司;酵母提取物购自OXUID LTD。Luria-Bertani (LB)培养基含1%氯化钠,0.5%酵母提取物,1%胰蛋白胨。YPDA培养基含有1%酵母提取物,2%胰蛋白胨,2%葡萄糖,0.003% adenine。SD培养基含0.7%无氨基酸酵母氮源(Yeast Nitrogen Base, 2%),葡萄糖,0.003% L-his,0.003% L-trp,0.003% L-leu,0.005% adenine,固体平板添加2%的琼脂。
2.2. 方法
2.2.1. E2蛋白BC抗原域(E2BC)的基因克隆
根据E2BC基因的序列,设计一对上、下游引物。为便于表达蛋白的检测,在上游引物的5'端加入His标签蛋白基因序列,上下游引物序列为:U: 5'-CAAGGATCCCATCATCACCATCACCATCGCGTTATA CCTCATATTGC-3',L:5'-AGCGAATTCACCCTGGTTAAATCCCTCA-3',上、下游引物5'端分别加入酶切位点BamH I、EcoRI (下划线标识,斜体为His标签蛋白)。以pVEXE2重组质粒为模板,利用PCR扩增E2BC基因片段,PCR产物经BamH I和EcoR I双酶切、凝胶回收后,连接于pcDNA3.1载体的相应位点。
连接产物转化E. coli DH5α感受态细胞,涂布于Amp抗性LB固体平板,培养过夜。挑取菌落进行菌落PCR,鉴定阳性转化子。取PCR鉴定阳性的菌落,接种液体LB培养基,提取质粒进行双酶切鉴定。双酶切鉴定正确的阳性转化子进行测序。
2.2.2. 酵母展示表达载体的构建
对测序正确的重组载体pcDNA3.1-E2BC进行BamH I和EcoR I双酶切,将获得的E2BC片段克隆至p1v5AG载体的相应位点,替换载体的v5片段(图1),构建重组载体p1-AG-E2BC,转化E. coli DH5α感受态细胞,制备重组表达载体p1-AG-E2BC。
2.2.3. 表达质粒转化至酿酒酵母
参照文献,将重组载体p1-AG-E2BC转化酿酒酵母 [7] 。取酿酒酵母W303接种于5 ml液体培养基YPAD,
30 ℃
,200 r/min下振荡培养过夜。以5 × 106个/ml的细胞密度接种至50 ml YPAD培养液。置
30 ℃
,200 r/min振荡培养至细胞密度2 × 107个/ml,用50 ml无菌离心管以3000 g离心5分钟,收集细胞。重悬细胞于25 ml无菌水中,再同上离心,弃上清。用1 ml 100 mmol的乙酸锂(LiAc)溶液重悬酵母
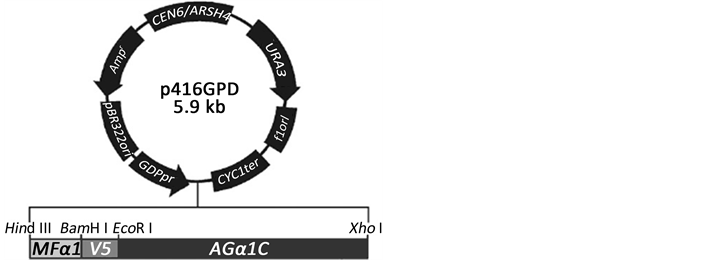
Figure 1. Map of p1v5-AG expression vector
图1. 表达载体p1v5-AG图谱
细胞,并转移至一个无菌的1.5 ml离心管,高速离心5 s沉淀细胞,吸尽乙酸锂。用500 μL 100 mmol的乙酸锂(LiAc)溶液悬浮细胞(2 × 109个/ml),将1 ml ss DNA(单体)样品煮沸5 min,快速在冰水中冷却。振荡细胞悬浮液,取50 μL酵母细胞加到标记的离心管中,离心沉淀细胞,除去乙酸锂。按下列顺序加入基本“转化混合液”:240 μL PEG (50% m/V),36 μL 1.0 mol/L乙酸锂,25 μL,ssDNA (2.0 mg/ml);50 μL水和质粒DNA (0.1 μg到10 μg))。振荡离心管直到细胞完全混匀。置
30 ℃
保温30 min后,置
42 ℃
水浴中热激20到25 min。以6000~8000 r/min的速度离心15 s,除去转化混合液。吸0.2 ml无菌PBS加到离心管中,悬浮菌体,取适量涂布接种于选择性平板培养基(SD)。
2.2.4. 重组酵母E2BC蛋白表达的检测
挑取在SD平板上的酵母转化子接种于10 ml的SDC培养基,培养16 h。以此为种子液接种于100 ml SDC培养基,摇瓶培养48 h。培养液4500 rpm离心5 min收集菌体,用PBS离心洗涤3次后,用PBS重悬菌体至OD600 = 6。取200 µL悬浮液离心,弃上清,再悬浮于200 µL含有1%BSA的PBS中。加入1 µL(工作浓度1:200)一抗(鼠抗His单抗),37℃温育2 h,离心弃上清,用PBS洗涤3次,再悬浮于200 µL含1%(W/V)BSA的PBS中,加1 µL(工作浓度1:200)二抗(羊抗鼠IgG-FITC),避光37℃温育2 h。PBS洗涤3次后悬浮沉淀,然后用荧光显微镜观察 [8] 。
3. 结果
3.1. E2BC基因克隆
以pVEXE2重组质粒为模板,PCR扩增E2BC目的基因片段,图2可见250 bp处有一明亮DNA条带,与E2BC基因预期大小255 bp相符,显示成功获得目的基因E2BC。
将E2BC基因片段连接到真核表达载体pcDNA3.1的BamH I和EcoR I位点,构建重组质粒载体pcDNA3.1-E2BC。用BamH I和EcoRI进行双酶切鉴定,得到了与E2BC大小相应的基因片段。用序列分析软件DNAMAN
5.2.2
将测得的序列与模板序列进行比对分析,显示插入的目的基因E2BC序列与模板序列一致,显示成功构建重组载体pcDNA3.1-E2BC。
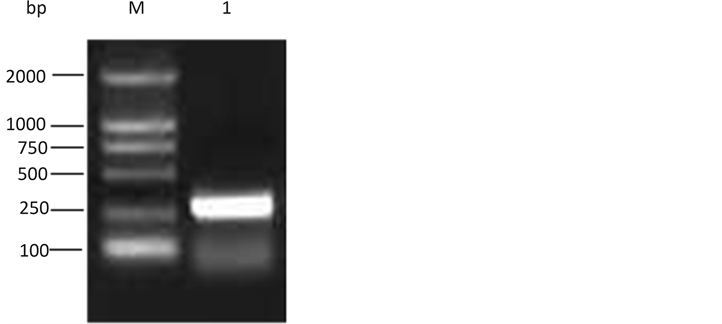 M. DL2000 DNA marker; 1. E2BC gene fragments
M. DL2000 DNA marker; 1. E2BC gene fragments
Figure 2. Amplification of E2BC gene with PCR
图2. PCR扩增E2BC基因
3.2. 酵母展示表达载体的构建
用BamH I和EcoR I双酶切pcDNA3.1-E2BC获得E2BC基因片段,将其纯化后插入p1v5-AG质粒载体的相应位点,替换载体p1v5-AG的v5片段(图1),经BamH I和EcoR I双酶切鉴定,获得与E2BC大小一致的基因片段,显示成功构建了重组载体p1 E2BC-AG (图3)。
3.3. 重组酵母菌E2BC蛋白表达
用间接免疫荧光染色法检测带有His标签的E2BC蛋白是否已经成功展示在酵母细胞表面。以鼠源抗His标签单克隆抗体为一抗,二抗为FITC标记的羊抗鼠IgG。间接免疫荧光染色后,用荧光显微镜观察,阴性对照酵母细胞没有观察到绿色荧光(图4(a),转化重组表达载体p1-AG-E2BC的酵母细胞观察到了绿色荧光(图4(b),表明E2BC蛋白成功表达在了酵母细胞表面。
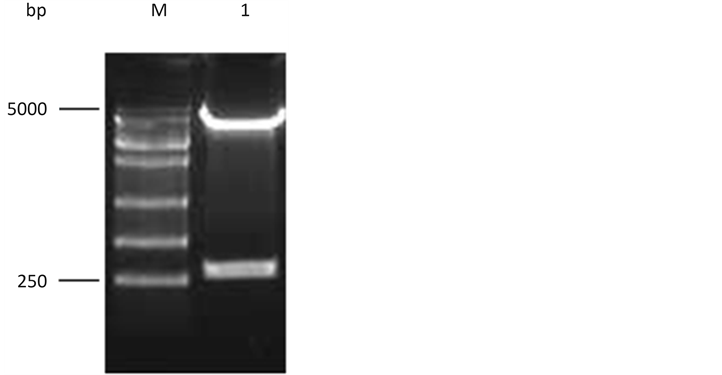 M. DL5000 DNA marker; 1. Digestion of p1E2BC-AGs
M. DL5000 DNA marker; 1. Digestion of p1E2BC-AGs
Figure 3. Digestion of recombinant vector p1E2BC-AG with BamHI and EcoRI
图3. 重组载体p1E2BC-AG双酶切鉴定
 (a) Normal yest cells
(a) Normal yest cells  (b) Recombinant yest cells
(b) Recombinant yest cells
Figure 4. Detection of E2BC expression by IFA
图4. 简接免疫荧光染色检测E2BC蛋白的表达
4. 讨论
酵母展示系统可用来展示病原微生物的抗原,制备疫苗。重组酵母载体疫苗具有生产成本低,应用方便,可口服免疫等优点。酵母细胞壁成分还具有天然的佐剂活性,因此在酵母表面展示的抗原蛋白能够诱导良好的免疫 [9] 。
Wasilenko等 [10] 将高致病禽流感病毒的血凝素蛋白展示于酵母细胞表面,重组酵母菌口服免疫鸡,诱导机体产生了中和抗体。Lei等 [11] 将禽流感病毒H5N1血凝素展示到酵母菌表面,口服免疫小鼠诱导产生了体液和细胞介导的免疫。加强免疫后,可产生高水平的HA特异的IgG1和IG2a抗体。攻毒实验显示,口服疫苗组可全部抵抗致死性H5N1的攻击。Kim等 [12] 将胸膜肺炎放线杆菌血清型2株的ApxIIA毒素表位片段展示于酿酒酵母细胞表面。每次用5 × 107个重组酵母口服免疫小鼠,免疫四次后,小鼠产生了针对胸膜肺炎放线杆菌的保护性特异抗体。免疫小鼠接种胸膜肺炎放线杆菌72小时后,免疫保护率是40%。Zhao等 [13] 利用酵母细胞表面展示技术制备了口服传染性造血组织坏死病毒(Infectious hematopoietic necrosis virus, IHNV))疫苗EBY100/pYD1-bi-G。虹鳟鱼口服该疫苗后,可获得非特异和特异的免疫反应。口服免疫后,在脾、后肠和前肾IFN-1和Mx-1表达水平显著提高,诱导产生了高滴度的中和抗体,攻毒保护率为45.8%。
CSFV的E2糖蛋白是最主要的免疫抗原,能够独立诱导机体产生保护性抗体。E2蛋白可分为A、B、C、D四个功能区,其中B、C区域是主要的抗原决定簇区,能够诱导产生保护性中和抗体。Dong等 [14] 合成制备了E2蛋白BC抗原决定区的五个重叠多肽P1-P5,并分别与牛血清白蛋白(BSA)相偶联。用这些多肽混合铝佐剂免疫猪,产生了强有力的免疫保护力。攻毒试验显示,免疫组全部健康存活,对照组的猪全部很快出现临床症状并死亡。
本研究将CSFV的E2BC基因插入酵母展示表达载体,将E2BC与酵母细胞壁甘露糖蛋白а凝集素融合表达,利用酿酒酵母细胞内蛋白转运到膜表面的机制(GPI锚定)将E2BC蛋白锚定在酵母细胞表面。针对His标签蛋白的间接免疫荧光染色显示E2BC得到表达,并锚定在酿酒酵母细胞的表面。这些工作为基于E2蛋白B、C抗原域的CSFV酵母载体口服疫苗的研制奠定了基础。
基金项目
国家自然基金重点项目(31130052)。