1. 引言
D-果糖是一种功能性单糖,其分子式为C6H12O6,常存在于水果和蜂蜜中,便宜易得。它具备良好的保湿吸湿性、渗透溶解性、降解性、冷冻性等优异性质 [1],普遍应用于食品业、医药业等行业。经现代医学研究发现,D-果糖食用量需要限制,它的大量食用会致使新陈代谢发生紊乱 [2],增加心脑血管疾病出现的几率,甚至提高癌症的发病几率 [3]。因此,精确检测D-果糖浓度具有重要意义。
近年来,国内外常用的测定D-果糖浓度的方法主要有:近红外光谱分析法、液相质谱法、分子印迹法、注射免疫分析法、色谱分析法、荧光方法,但是这些方法往往有费时、费用高、频次低等的缺点 [4] - [9]。核磁共振是一种快速、测量精度高、高频次、使用安全、无损、无侵入的测量手段 [10]。低场核磁共振能有效地研究分子的扩散运动,可用于食品体系中多种(如水、脂肪及糖等)分子的研究 [11] [12]。
本文应用低场核磁共振技术检测了不同浓度的D-果糖溶液,探索其T2谱各峰的横向弛豫时间(T2)、峰面积与浓度之间的相关性,并分析了其影响机理,给出了低场核磁共振技术应用于D-果糖浓度的检测方法,理论上为低场核磁共振技术在食品安全快速检测领域的应用研究提供参考。
2. 实验部分
2.1. 实验原理
处于磁场中的磁矩不为零的原子核,施加特定频率的射频长,自旋核吸收射频脉冲能量,被激励的原子核从低能态跃迁到高能态,这种现象称为“核磁共振” [13]。由于共振吸收,原子核系统达到饱和状态。在射频脉冲停止以后核子将释放所吸收的能量,整个原子核系统将逐渐返回到热平衡状态,该过程所需的时间称为弛豫时间,分为纵向弛豫时间T1和横向弛豫时间T2 [14]。T1和T2都和物质的结构、物质内部的相互作用有关 [15],因此,弛豫时间是核磁共振的一个重要研究方面。本实验主要使用CPMG自旋回波法,自旋回波的脉冲序列为:
其中,
为半回波时间,EchoCount为回波个数,TR为采样重复时间,NS为重复扫描次数。对样品施加CPMG脉冲序列,测量得到被测样品的横向弛豫衰减曲线,对衰减曲线进行反演处理,即可得到样品的T2图谱。
2.2. 实验仪器和材料
仪器:NMI20-Analyst核磁共振成像分析仪,主磁场为0.51 T,上海纽迈电子科技有限公司;电子天平,分度值为0.001 g,梅特勒–托利多仪器(上海)有限公司。
材料:D-果糖,分析纯,C6H12O6 ≥ 99.7%,天津市科密欧化学试剂有限公司;蒸馏水,实验室蒸馏水设备自制。
2.3. 实验方法
2.3.1. D-果糖溶液样品的配制
常温下,D-果糖的溶解度约为77.78% [16]。本文使用D-果糖与蒸馏水配制质量百分数为0~70% (间隔为5.00%)的D-果糖溶液,装入色谱瓶内,贴上标签,样品待测。
2.3.2. 低场核磁共振参数设置
选择CPMG脉冲序列,选择CPMG脉冲序列进行扫描实验,测量温度为(32.0 ± 0.1)℃。检测参数:采样点数TD = 2000100,谱宽SW = 200 kHz,采样重复时间TR = 1000 s,重复扫描次数NS = 16,半回波时间 = 500 μs,回波个数EchoCount = 10000。反演参数:开始时间0.01 ms,截止时间10000 ms,参与反演点数400个,弛豫时间点数400个,迭代次数2,000,000次。
2.3.3. 数据采集与处理
为使样品与磁体间无温度差,达到恒温32.0℃,从而减小测量误差,将待测溶液放入样品管中,静置5分钟,再进行测量。实验中每个样品进行重复采样3次,反演得到各样品的波谱图,将数据取平均值作为该样品的测量结果;利用Origin软件进行数据处理。
3. 结果与分析
3.1. D-果糖溶液的横向弛豫谱分析
按照实验方法测量,得到浓度不同的15个D-果糖溶液样品的T2谱分布如图1所示。
由图1可见,纯水溶液(不加D-果糖)的弛豫谱图中只有一个谱峰(T2 = 2446.41 ms),浓度为5%的D-果糖溶液的弛豫谱图中也只有一个谱峰(T2 = 2231.53 ms)。而在浓度为10%~55%的D-果糖溶液的弛豫谱图中,开始存在两个不重叠的波谱。并且随着浓度增大,第一峰向第二峰靠近,面积增加;第二峰不断左移,横向弛豫时间减小。当浓度大于60%的时候,两个波谱发生重叠。
由于D-果糖分子有很强的渗透溶解性,因而可以形成高渗透性的溶液 [17]。当D-果糖快速溶解在水中时,它所含的亲水性基团(-OH)可以与水发生质子交换,从而改变水分子的流动性 [18]。物质分子的横向弛豫特性与其流动性存在相关性 [19]。通常,低场核磁共振技术是利用两相体系来解释弛豫结果 [20],即可以假设该D-果糖溶液体系中存在“束缚水”和“自由水”来解释样品中水的大部分弛豫数据。
浓度为5%的D-果糖溶液弛豫性质与纯水相似,其谱峰对应水分子可认为属于“自由水”。当浓度为10%~55%时,两个不重叠的波谱的存在,说明了D-果糖溶液中 “束缚水”和“自由水”的流动性不相同。流动性不同的水表现出不同的弛豫特性 [21]。以35%D-果糖溶液为例,如图2,它有两个峰值,分别用T21和T22表示。T21表示“束缚水”的横向弛豫时间,这部分水与羟基(-OH)紧密结合而被束缚,流动性相对较弱,对应的横向弛豫时间较小;T22则表示“自由水”的横向弛豫时间,这部分水处于自由状态,流动性相对较强,对应的横向弛豫时间较大。

Figure 1. T2 spectra of D-fructose solutions with different concentrations
图1. 不同浓度D-果糖溶液的T2图谱

Figure 2. T2 spectra of D-fructose solution with 35% concentration
图2. 35%浓度的D果糖溶液T2图谱
3.2. D-果糖溶液浓度与横向弛豫时间的分析
当D-果糖溶液的浓度增大时,D-果糖分子中的多个亲水基团(-OH)会与水分子中的氢键发生结合,溶液中束缚水的含量增加,自由水的含量减少。而且浓度越高,D-果糖的亲水基团(-OH)结合氢键的能力越强,溶液中的“自由水”就越少,流动性就越差,因此T22不断减小,如图3所示。
图3中,T22表示“自由水”的横向弛豫时间,C表示D-果糖溶液的浓度。C与T22两者之间有很明显的一次线性关系。其关系式为:
(1)
由式(1) R2 = 0.99可以看出,D-果糖水溶液的浓度与其T22成一次线性关系,随着D-果糖水溶液的浓度的增大,其对应的T22逐渐减小。
3.3. D-果糖溶液浓度与峰面积的分析
当D-果糖溶液的浓度小于10%时,仅存在“自由水”的共振峰;而当浓度大于60%的时候,两个波谱发生重叠,无法确定两个共振峰的准确峰面积。因此,取浓度为10%~55%的D-果糖溶液分析D-果糖溶液浓度与峰面积的关系,如图4所示。
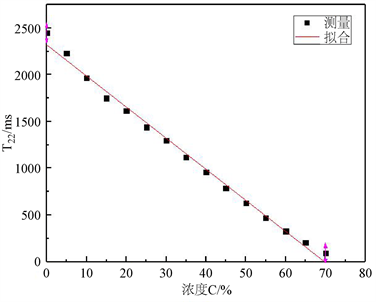
Figure 3. The relationship between the concentration of D-fructose solution and the transverse relaxation time of “free water”
图3. D-果糖溶液的浓度与“自由水”的横向弛豫时间的关系

Figure 4. The concentration and resonant peak area of “bound water”
图4. D-果糖溶液浓度与“束缚水”的共振峰面积的关系
图4中,S1表示“束缚水”的峰面积,C表示D-果糖溶液的浓度,C与S1之间有很明显的一次线性关系。其关系式为:
(2)
由式(2) R2 = 0.98可以看出,D-果糖水溶液的浓度与S1成一次线性关系,随着D-果糖水溶液的浓度的增大,其对应的S1对应增大。
4. 方法总结及验证
4.1. 方法总结
根据上述分析,总结低场核磁共振技术检测D-果糖浓度的两种方法如下:
1. 定标:配制一系列不同浓度的D-果糖溶液样品,设置检测参数,选择CPMG 脉冲序列进行扫描实验。每个样品重复测量多次,反演得到各样品的波谱图,将数据取平均值作为该样品的测量结果。
根据测得的结果,作出T22与C之间的关系曲线,拟合出相应的定标公式:
(3)
其中a、b为常数。
选取浓度小于60%的样品数据,作S1与C之间的关系曲线,拟合出相应的定标公式:
(4)
其中c、d为常数。
2. 测量:设置测量参数与定标时的相同,取待测样品测量其T22和S1。① 方法一:将T22带入定标公式(3),即可算出D-果糖溶液样品的浓度。② 方法二:当所测样品的T2图谱中存在两个不重叠的波谱时,也可将S1带入定标公式(2)中算出该样品的浓度。
4.2. 方法验证
4.2.1. D-果糖溶液浓度与横向弛豫时间
以式(1)做为标定公式为例验证T22测量D-果糖溶液浓度。配制D-果糖溶液浓度分别为17%、23%、27%、33%、37%、43%、47%、53%、57%、63%的D-果糖溶液样品,利用低场核磁共振的方法测出样品的T22,再利用式(1)计算出D-果糖溶液的浓度,检测结果如表1所示。

Table 1. Relationship (1) verification results
表1. 关系式(1)验证结果
由表1可知,实验结果的相对误差 < 1%,表明利用D-果糖溶液的T22可较准确地计算出D-果糖溶液的浓度。
4.2.2. D-果糖溶液浓度与峰面积
以式(2)做为标定公式为例验证T21峰面积测量D-果糖溶液浓度。利用低场核磁共振的方法测出这17%、23%、27%、33%、37%、43%、47%、53%的D-果糖溶液样品中S1,再利用式(2)计算出D-果糖溶液的浓度,检测结果如表2所示。
由表2可知,实验结果的相对误差 < 1%,表明利用D-果糖溶液的S1可较准确地计算出D-果糖溶液的浓度。

Table 2. Relationship (2) verification results
表2. 关系式(2)验证结果
5. 结论
由表2可知,实验结果的相对误差 < 1%,表明利用D-果糖溶液的S1可较准确地计算出D-果糖溶液的浓度。本实验采用低场核磁共振技术,分析不同浓度D-果糖水溶液T2谱特征,找出各峰横向弛豫时间、峰面积与浓度之间的相关性。实验结果表明:随着D-果糖水溶液浓度的增大,对应的T22逐步的减小,二者成较好的一次线性关系。对于浓度为10%~55%的D-果糖溶液,“束缚水”和“自由水”的波谱不发生重叠,随着D-果糖水溶液浓度的增大,对应的S1逐渐的增大,二者成较好的一次线性关系。根据D-果糖溶液的T22或S1与浓度的关系,可利用核磁共振方法来较为准确地测量D-果糖溶液的浓度,理论上可以为低场核磁共振技术在食品安全快速检测领域的应用研究提供参考。
致谢
在本论文的写作过程中,我的指导老师倾注了大量的心血,从最初的选题,到资料收集,到写作、修改,到论文定稿,老师每一步都严格把关,在此我表示衷心感谢。钟鹏老师认真负责的工作态度、严谨的治学风格,使我深受启发和鼓舞,今后无论做人还是做事,都要保持一颗积极进取的心。
基金项目
山东省自然科学基金(ZR2014EMM006),广西大学广西有色金属及特色材料加工重点实验室开放基金(GXKFJ16-09),中国石油大学(华东)大学生创新训练计划项目(201910425013)。
NOTES
*通讯作者。