1. 引言
子宫内膜癌是发达国家最常见的女性生殖道肿瘤,在我国的发病率和病死率逐年升高,且呈年轻化趋势,在我国一些发达地区子宫内膜癌已经成为发病率最高的女性生殖道恶性肿瘤 [1] [2]。子宫内膜癌现阶段治疗方式以手术为主,辅以放、化疗、激素治疗,但是仍有高死亡率及复发。其原因与细胞凋亡过程发生缺陷而导致治疗失败有关 [3],因此寻找重新激活肿瘤细胞凋亡途径的药物,对子宫内膜癌的治疗及预后有重要意义。
硫酸右旋糖苷(Dextrin sulfate, DS),属于大分子右旋糖苷,分子量为5 × 105 kD,被认为是一种低毒性、腹腔吸收慢、作用持续时间长的药物 [4],动物实验提示 [5] DS能够抑制恶性黑色素瘤细胞粘附及细胞周期进展。研究发现DS能够抑制人胃癌细胞的增殖、侵袭、迁移,诱导凋亡 [6] [7] [8]。DS能够抑制宫颈癌及卵巢癌细胞的生物学特性 [9] [10]。但DS对子宫内膜癌细胞生物学行为的影响及相关机制的目前尚未见报道。因此,本研究拟探讨DS对子宫内膜癌细胞增殖、迁移、侵袭及凋亡的影响,并探讨可能的分子机制。
2. 材料与方法
2.1. 材料
1) 细胞株与药品子宫内膜腺癌细胞株Ishikawa购自上海吉凯基因化学技术有限公司、HEC-1A细胞株购自广州赛库生物技术有限公司;DS购自美国Sigma公司。
2) 材料与试剂DME/F12、Mocyy’5A培养基、胎牛血清购自美国HyClone公司;青链霉素购自北京Solarbio公司;0.25%胰蛋白酶、BCA蛋白分析试剂盒、RIPA裂解液、蛋白酶抑制剂购自上海Beyotime公司;Cell Counting Kit-8 (CCK-8)试剂购自美国APExBIO公司;Matrigel基质胶购自美国BD公司;Transwell小室购自上海Corning公司;Annexin V-FITC/PI染色试剂盒购自上海absin公司;SDS凝胶配制试剂盒购自上海雅酶生物科技有限公司;兔单克隆抗体Bax、Bcl-2、β-actin、单克隆山羊抗鼠抗体购自美国CST公司;PVDF膜购自美国Millipore公司。
2.2. 方法
1) 细胞培养与药物处理:复苏子宫内膜腺癌HEC-1A、Ishikawa细胞,分别使用含10% FBS与1%青链霉素的DME/F12和Mocyy’5A完全培养基,置于37℃、5% CO2培养箱(美国Forma Seientifie公司)内培养。在细胞密度达80%~90%时进行传代,在细胞对数生长期收集细胞进行下列实验。取DS溶解于相应培养基中并稀释至0.8%,后续试验按比例稀释至相应的浓度。
2) CCK8实验收集子宫内膜腺癌HEC-1A、Ishikawa细胞,调整细胞密度为5000个/孔接种于96孔板中,细胞贴壁后每一纵列分别更换含有0%、0.2%、0.4%、0.6%、0.8% DS的培养基,分别培养24、48、72小时(37℃,CO2浓度5%),在避光条件在各孔中加入10 μl CCK8溶液,放回培养箱内继续孵育1小时,用酶标仪测量450 nm处的吸光度,计算各组细胞的增殖情况,并计算细胞增殖抑制率:细胞增殖半抑制率(IC50) (%) = [(对照组OD值 − 实验组OD值)/(对照组OD值 − 空白组OD值)] × 100%。
3) 平板克隆形成实验收集子宫内膜腺癌HEC-1A、Ishikawa细胞,调整细胞密度为500个/孔,接种于六孔板中,使其均匀分布,在细胞贴壁后,对照组、实验组分别加入完全培养基和含0.8% DS的培养基,连续培养14天观察细胞生长情况,在显微镜下观察出现50个细胞以上细胞团时停止培养,弃培养基,PBS冲洗,4%多聚甲醛固定、0.1%结晶紫染色,洗去染液,观察集落形成并拍照,计算各组细胞集落形成数量。
4) 划痕实验收集子宫内膜腺癌HEC-1A、Ishikawa细胞,调整细胞密度为1 × 106个/孔,接种于6孔板中,使其分布均匀,细胞贴壁后对照组与实验组分别加入无血清培养基和含0.8% DS的无血清培养基,继续培养至细胞密度至70%~80%时进行划痕,分别于0、24、48 h随机选择9个视野拍照,计算各组细胞24 h、48 h划痕愈合率(%):(0 h划痕面积 − 24/48 h划痕面积)/0 h划痕面积。
5) Transwell侵袭实验:基质胶稀释后均匀铺于上室。基质胶凝固后,收集子宫内膜腺癌HEC-1A、Ishikawa细胞,调整细胞密度为5000个/孔,接种于上室。细胞贴壁后,上室分别更换为100 μl对照组与实验组(0.8% DS)无血清培养基,下室添加600 μl含20% FBS的培养基,继续培养24 h,弃上室细胞与基质胶,PBS冲洗,4%多聚甲醇固定、0.1%结晶紫染色,洗去染液,小心擦去上室膜表面的细胞,轻揭下膜,底面向上晾干后移至载玻片,中性树胶封片后显微镜下观察,随机选取9个视野拍照,计算各组穿膜细胞数量。
6) 流式细胞术收集子宫内膜腺癌HEC-1A、Ishikawa细胞,调整细胞密度为1 × 106个/孔,均匀接种于6孔板中,细胞贴壁后,分别设置空白组、对照组与含0.8% DS实验组处理48、72小时,用不含EDTA的胰酶消化细胞,收集细胞,离心,弃上清,PBS溶液洗涤,离心,弃上清,用300 μl Binding Buffer重悬细胞,避光加入5 μl Annexin V-FITC孵育15 min,再避光加入5 μl PI孵育5 min,上机前补入Binding Buffer 200 μl,轻轻混匀,用流式细胞仪(美国Beckman Coulter公司)检测。
7) WesternBlot收集子宫内膜腺癌HEC-1A、Ishikawa细胞,待细胞生长至50%,对照组、实验组分别加入常规培养基和0.8% DS后继续培养48、72小时。弃净培养基后加入细胞蛋白裂解液,置于4℃刮取,冰上孵育10 min,4℃离心10 min (美国Sigma公司),取其上清液,应用BCA蛋白含量检测试剂盒测定蛋白浓度。加入上清1/4体积的lodding buffer,100℃加热5 min。配胶、上样、SDS-PAGE电泳、转膜、封闭、Bax、Bcl-2、β-actin一抗反应、对应的兔、鼠二抗反应、显影。应用Image J图像分析软件测量条带灰度值,以目的蛋白灰度值与内参蛋白灰度值之比作为目的蛋白的表达量。
2.3. 统计学方法
使用IBM SPSS25.0统计软件分析实验数据,计量资料以均数 ± 标准差表示,两样本均数的比较采用独立样本t检验。检验水准α = 0.05。
3. 结果
3.1. CCK8实验检测DS对子宫内膜腺癌HEC-1A、Ishikawa细胞增殖能力的影响
CCK8实验结果显示,HEC-1A细胞实验组(0.2%、0.4%、0.6%、0.8% DS组)与对照组相比,吸光度值均降低,差异具有统计学意义(P < 0.05,表1),计算DS对HEC-1A细胞增殖的半抑制率(IC50)为0.8%,48 h。Ishikawa细胞实验组(0.2%、0.4%、0.6%、0.8%DS组)与对照组相比,吸光度值均降低,差异具有统计学意义(P < 0.05,表2),计算DS对Ishikawa细胞增殖的IC50为0.8%,72 h。后续实验处理时间及药物浓度均根据IC50选择。结果表明,DS能够抑制子宫内膜腺癌HEC-1A、Ishikawa细胞的增殖能力。

Table 1. CCK8 assay to detect the absorbance value of HEC-1A cells ( x ¯ ± s )
表1. CCK8法检测子宫内膜腺癌HEC-1A细胞吸光度值(
)
注:与对照组相比,**P < 0.01, ****P < 0.0001。

Table 2. CCK8 assay to detect the absorbance value of Ishikawa cells ( x ¯ ± s )
表2. CCK8法检测子宫内膜腺癌Ishikawa细胞吸光度值(
)
注:与对照组相比,**P < 0.01, ***P < 0.0005, ****P < 0.0001。
3.2. 平板克隆形成实验检测DS对子宫内膜腺癌HEC-1A、Ishikawa细胞增殖能力的影响
平板克隆形成实验结果显示,与对照组相比,实验组(0.8% DS)集落形成数量明显减少,差异具有统计学意义(P < 0.05,图1、表3)。结果表明,DS能够抑制子宫内膜腺癌细胞HEC-1A、Ishikawa细胞的增殖能力。

Figure 1. Plate clone formation assay to detect the effect of DS on the proliferation of endometrial cancer cells
图1. 平板克隆形成实验检测DS对子宫内膜癌细胞增殖能力的影响

Table 3. Plate clone formation assay to detect the number of colonies formed by endometrial adenocarcinoma cells ( x ¯ ± s )
表3. 平板克隆形成实验检测子宫内膜腺癌细胞集落形成数目(个) (
)
注:与对照组相比,*P < 0.05, **P < 0.01。
3.3. 划痕实验检测DS 对子宫内膜腺癌HEC-1A、Ishikawa细胞迁移能力的影响
划痕实验结果显示,与对照组相比,实验组(0.8% DS) 24小时及48小时测得划痕愈合率均明显降低,差异均具有统计学意义(P < 0.05,图2)。结果表明,DS能够抑制子宫内膜腺癌HEC-1A、Ishikawa细胞的迁移能力。
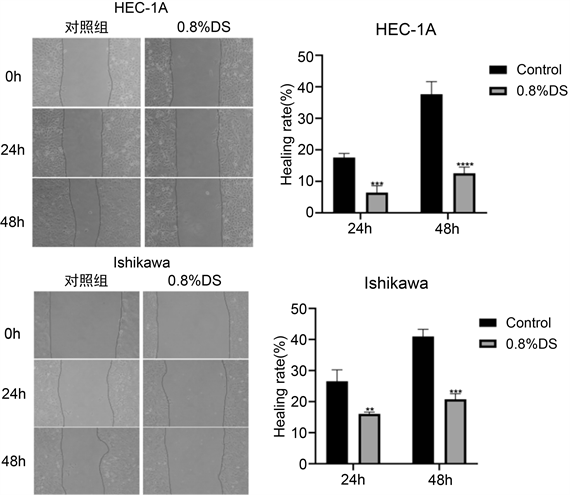 注:与对照组相比,**P < 0.01, ***P < 0.0005, ****P < 0.0001。
注:与对照组相比,**P < 0.01, ***P < 0.0005, ****P < 0.0001。
Figure 2. Scratch assay to detect the effect of DS on the migration ability of endometrial adenocarcinoma cells
图2. 划痕实验检测DS对子宫内膜腺癌细胞迁移能力的影响
3.4. Transwell侵袭实验检测DS对子宫内膜腺癌HEC-1A、Ishikawa细胞侵袭能力的影响
Transwell侵袭实验结果显示,与对照组相比,实验组(0.8% DS)穿过基底膜的细胞数量明显减少,差异具有统计学意义(P < 0.05,图3、表4)。结果表明,DS能够抑制子宫内膜腺癌HEC-1A、Ishikawa细胞的侵袭能力。
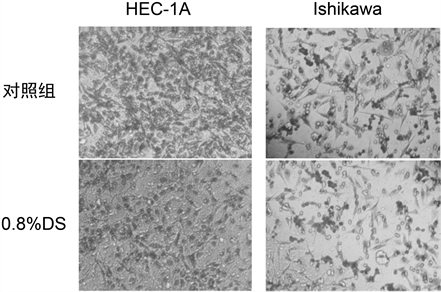
Figure 3. Transwell invasion assay to detect the effect of DS on the invasion ability of endometrial adenocarcinoma cells (×400)
图3. Transwell侵袭实验检测DS对子宫内膜腺癌细胞侵袭能力的影响(×400)

Table 4. Transwell invasion assay to detect the number of endometrial adenocarcinoma cells invaded ( x ¯ ± s )
表4. Transwell侵袭实验检测子宫内膜腺癌细胞侵袭数目(个) (
)
注:与对照组相比,*P < 0.05, **P < 0.01。
3.5. 流式细胞术检测DS对子宫内膜腺癌HEC-1A、Ishikawa细胞凋亡率的影响
流式细胞术结果显示,与对照组相比,实验组(0.8% DS)细胞凋亡率明显升高,差异具有统计学意义(P < 0.05,图4、表5)。结果表明,DS能够促进子宫内膜腺癌HEC-1A、Ishikawa细胞凋亡。

Figure 4. Flow cytometry to detect the effect of DS on the apoptosis rate of endometrial adenocarcinoma cells
图4. 流式细胞术检测DS对子宫内膜腺癌细胞凋亡率的影响

Table 5. Flow cytometry to detect the apoptosis rate of endometrial adenocarcinoma cells (%) ( x ¯ ± s )
表5. 流式细胞术检测子宫内膜腺癌细胞凋亡率(%) (
)
注:与对照组相比,**P < 0.01, ***P < 0.0005。
3.6. Western Blot检测DS对子宫内膜腺癌HEC-1A、Ishikawa细胞Bax、Bcl-2表达的影响
Western blot结果显示,与对照组相比,实验组Bcl-2蛋白表达量降低、Bax蛋白表达量升高,实验组Bax/Bcl-2比值升高,差异均具有统计学意义(P < 0.05,图5)。
 注:与对照组相比,*P < 0.05, **P < 0.01。
注:与对照组相比,*P < 0.05, **P < 0.01。
Figure 5. Western blot to detect the effect of DS on the expression of Bax and Bcl-2 protein in endometrial adenocarcinoma cells
图5. Western blot检测DS对子宫内膜腺癌细胞中Bax、Bcl-2蛋白表达的影响
4. 讨论
子宫内膜腺癌是最常见的子宫内膜癌病理类型,临床上仍采用以手术治疗为主,术后结合放化疗和激素治疗的综合治疗。常用的化疗药物主要通过细胞毒性作用诱导癌细胞凋亡,但晚期易因细胞凋亡缺陷发生化疗耐药,且化疗的靶向性差、有明显的副作用 [11]。激素治疗也存在明显的副作用,不同类型子宫内膜癌对激素反应不同导致治疗失败,出现疾病复发和转移 [12]。
硫酸右旋糖苷是一种来源广、毒副作用少、作用持续时间长的一种大分子右旋糖苷衍生物,多项研究表明其可能影响多种恶性肿瘤细胞的生物学特性。研究表明 [5] DS处理恶性黑色素瘤细胞可通过抑制肿瘤细胞自G1期向S期的细胞周期进展,抑制细胞增殖过程。研究表明,DS抑制不同分化程度胃癌细胞的增殖、迁移和侵袭,其可能是通过影响Wnt、TGF-β/Smad4、Nrf2/HO-1等信号通路,抑制胃癌细胞EMT进而抑制胃癌细胞迁移和侵袭,还通过抑制表观遗传调控因子EZH2表达进而影响胃癌细胞的增殖并诱导凋亡 [6] [7] [8] [13]。研究发现 [9] [10] DS可能通过下调PI3K/AKT信号通路发挥抑制卵巢癌及宫颈癌细胞增殖、迁移及侵袭作用。本研究拟探讨DS对子宫内膜腺癌细胞生物学特性的影响。结果表明,DS能够抑制子宫内膜癌HEC-1A、Ishikawa细胞的增殖、迁移、侵袭能力,促进凋亡。
近年来研究发现,肿瘤的发生发展不仅与细胞过度增殖有关,还和细胞凋亡的失衡密切相关 [14]。细胞凋亡是一种细胞在凋亡信号刺激下由多种基因以及信号通路共同参与调控的程序化死亡过程。抗凋亡基因Bcl-2和促凋亡基因Bax是Bcl-2家族中两个重要成员,两者的蛋白作为正负调节蛋白,共同调节细胞凋亡,在机体中通过二聚体发挥作用 [15] [16],与人体多种肿瘤的发生发展密切相关 [17],其在子宫内膜癌中的表达也得到广泛研究,子宫内膜癌细胞凋亡程度与Bcl-2表达呈负相关而与Bax表达呈正相关 [18],且Bax/Bcl-2比值与肿瘤凋亡的关系尤为密切,决定了促凋亡因子caspase-3的激活程度,Bax/Bcl-2比值越高,促凋亡作用越强 [19]。研究表明 [18] [20] [21],Bcl-2及Bax表达水平及Bax/Bcl-2比值与子宫内膜癌的分化程度及疾病分级有关,并影响子宫内膜癌患者预后。由此可见,Bax和Bcl-2在指导子宫内膜癌的临床治疗中仍具有重要意义。本研究结果提示DS分别作用于子宫内膜癌HEC-1A、Ishikawa细胞48、72 h后,肿瘤细胞的凋亡率增加,Bcl-2蛋白表达下降,Bax蛋白表达上升,且Bax/Bcl-2比值也明显升高,说明DS可能通过抑制Bcl-2基因表达,阻止Bcl-2/Bax二聚体形成,促进Bax发挥功能,增加Bax/Bcl-2比值,激活下游Caspase3,促进子宫内膜癌HEC-1A、Ishikawa细胞的凋亡,为子宫内膜癌的治疗提供了新思路。随分子生物学迅速发展,研究发现肿瘤细胞凋亡受多种信号通路影响,因此,DS促进子宫内膜癌细胞凋亡的具体机制尚需进一步研究。
基金项目
Irisin在宫颈癌进展中的机制及临床意义的研究(项目编号:NO:2020-2-019-YY)。
NOTES
*通讯作者。