1. 引言
胃食管反流病是一种常见的慢性疾病,其症状与并发症造成健康与生活质量严重受损 [1] 。特别是在工业化国家中,约有20%的人口受到胃食管反流病的影响 [2] [3] 。巴雷特食管会出现远端食管的柱状上皮化生,是胃食管反流病的其中一种亚型,也是食管腺癌的癌前病变 [4] 。此外,胃食管反流病诊断测试和治疗造成的社会和经济成本很高,对患者的生活质量和工作效率也产生了负面影响 [5] 。抑郁症已经发展成为一种公共健康危机,造成了巨大的经济和健康负担 [6] 。一项横断面研究招募了2500名年龄在18岁至40岁之间的年轻人,统计数据显示,胃食管反流病受试者抑郁症的患病率为42.6% [7] 。研究证实胃食管反流病和抑郁症经常同时发生,并可能相互影响 [8] [9] [10] [11] 。抑郁症患者可能因生活方式和生理功能障碍而增加胃食管反流病的风险。另一方面,胃食管反流病可能通过慢性粘膜炎症影响中枢神经系统,从而增加抑郁风险。虽然许多研究表明抑郁症与胃食管反流病之间有很强的相关性,但关于抑郁症与巴雷特食管二者关系的研究还很有限。然而,在任何基础和观察性研究中,都不能排除被未知因素混淆的可能性。
我们使用孟德尔随机化(MR)来研究暴露与结果之间的假定因果关系。在估计暴露对结果的因果影响时,以工具变量的形式使用与可修改暴露相关的遗传变异的技术被称为孟德尔随机化方法 [12] 。工具变量的三个假设需要满足如下,以确保通用变量的有效性 [13] 。第一,工具变量与暴露因素密切相关。第二,工具变量不能与任何混杂因素相关联。第三,暴露应该是遗传变异对结果产生影响的唯一途径。
为了探究抑郁症和胃食管反流病之间的双向因果关系,我们使用了双向双样本孟德尔随机化研究。
2. 资料与方法
2.1. 研究设计和数据来源
图1为孟德尔研究设计的示意图。首先,评估抑郁症对胃食管反流病的因果效应,然后评估胃食管反流病对抑郁症因果效应。为了确定抑郁症与胃食管反流病严重程度的关系,将巴雷特食管作为一个亚组进行分析。

Figure 1. The design of bidirectional Mendelian randomization (MR) study. The “×” means that genetic variants are not associated with confounders or cannot be directly involved in outcome but via the exposure pathway. The “√” means that genetic variants are highly correlated with exposure. Solid paths are significant; dashed paths should not exist in the MR study. SNP: single nucleotide polymorphism; GERD, Gastroesophageal reflux disease; BE, Barrett’s esophagus
图1. 双向孟德尔随机化(MR)研究设计。“×”指SNP与混杂因素无关,只能通过暴露途径影响结果。“√”指的是基因变异与暴露高度相关。实线路径很重要;MR研究中不应存在虚线路径。SNP:单核苷酸多态性;GERD,胃食管反流病;BE,巴雷特食管
我们纳入了GWAS的汇总统计数据,其中分别包括602,604例(129,080例病例与473,524例对照组)和56,429例(13,358例病例与43,071例对照)胃食管反流病和巴雷特食管的欧洲血统个体。
抑郁症的汇总统计数据是从GWAS公开获得的,来自英国布里斯托尔大学MRC综合流行病学组(MRC-IEU)纳入了多达462,933名(26,595例病例对436,338例对照组)参与者(GWASID: ukb-b-12064)。

Table 1. Associations of depression with risk of GERD in MR analyses. OR, odds ratio; CI, confidence interval; GERD, Gastroesophageal reflux disease; BE, Barrett’s esophagus
表1. MR分析中抑郁症与胃食管反流病发生风险的关系。OR,优势比;CI,可信区间;GERD,胃食管反流病;BE,Barrett’s食管
2.2. SNP的选择
有80个SNP与胃食管反流病全基因组相关,57个SNP与巴雷特食管全基因组相关(P < 5 × 10−8)。同时,对这些核苷酸多态(SNPs)进行连锁不平衡(LD)测试以聚集SNPs以确定其独立性。对Ld (R2 > 0.001)的遗传变异进行了修剪。从GWAs中提取了两个在全基因组意义上与胃食管反流病相关的独立变异(R2 < 0.001)。
同样,在全基因组意义(P < 5 × 10−8)和独立性(R2 < 0.001)水平上,我们获得了146个抑郁症和SNP。为了评估所选SNP的是否受到了弱工具变量的影响,使用公式F = R2(n – 1 – k)/(1 – R2)k (其中R2表示由遗传变量解释的暴露差异,n表示样本量,k表示工具变量的数量),以确定每个变量的F统计量 [14] 。我们通过搜索PhenoScanner来评估SNPs是否与潜在的混杂因素相关(P < 5 × 10−8)。最后,为了检测和去除具有水平多效性效应的SNPs,应用了MR-PRESO方法。
逆方差加权(IVW)、加权中值、加权模式、简单模式和MR-Egger回归被五种方法用于执行MR分析 [15] 。另外,运用MR-PRESSO来评估水平多效性。Cochran Q统计量被用来标准化工具变量的异质性 [16] 。此外,逐次剔除单个变量,进行了“留一法”敏感性分析。此外,优先考虑IVW结果。P值 < 0.0025 (0.05/20)在说明Bonferroni校正时具有统计学意义,而与P值 ≥ 0.0025和 <0.05的被认为有提示性的意义。
3. 结果
3.1. 胃食管反流病对抑郁症的因果效应
在PhenoScanner数据库中,我们确定了与混杂因素相关的SNP。通过LD测试,提取了胃食管反流病的70个SNPs和巴雷特食管的56个SNPs,以确定它们与抑郁症的关系(图2)。F统计值都在10分以上。
如图3所示,MR分析显示胃食管反流病对抑郁症有统计学意义但很小的因果效应[IVW(OR) = 1.021; 95% CI 1.017, 1.025; P = 9.47 × 10−24]。去除异常值后,效应大小的大小保持相似(rs3863241, rs9542729, rs7241572)。在亚型分析中,去除异常值(rs13195040)后,巴雷特与抑郁症[IVW OR 1.003; 95% CI 1.001;

Figure 2. Forest plot. (a) Forest plots for association of GERD with depression; (b) Forest plots for association of BE with depression
图2. 森林图。(a) 胃食管反流病与抑郁症的因果关系;(b) 巴雷特食管与抑郁症的因果关系

Figure 3. Associations of GERD with risk of depression in MR analyses. IVW, inverse variance weighted; OR, odds ratio; CI, confidence interval; MR, Mendelian randomization
图3. 孟德尔分析中胃食管反流病与抑郁症风险的关系。IVW,逆方差加权;OR,优势比;CI,可信区间;MR,孟德尔随机化
1.004; P = 0.002]。Cochran’s Q检验没有明显的异质性证据。MR-Egger截距分析没有再次显示水平多效性。
3.2. 抑郁症对胃食管反流病的因果效应
在剔除混杂因素后,通过LD测试,分别提取了46个与抑郁症有关的SNP (图4)。
采用逆方差加权(IVW)方法进行初步分析。如表1所示,抑郁症与胃食管反流病有因果关系[IVW OR =
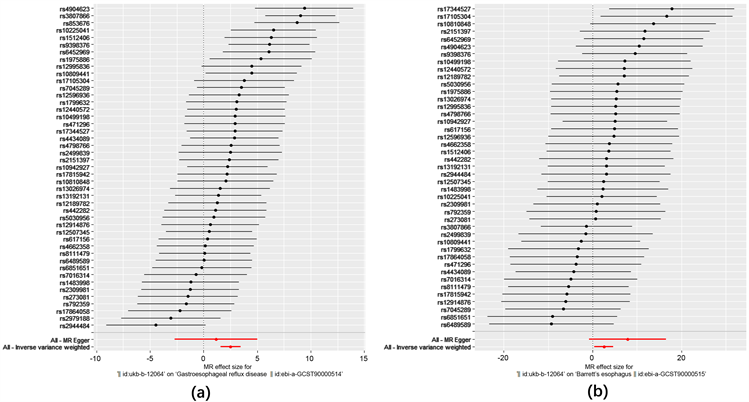
Figure 4. Forest plot. (a) Forest plots for association of depression with GERD; (b) Forest plots for association of depression with BE
图4. 森林图。(a) 抑郁症与胃食管反流病的因果关系;(b) 抑郁症与巴雷特食管的因果关系
1.343; 95% CI 1.175, 1.524; P = 6.449 × 10−7]。删除异常值后,结果仍然显著(rs853676, rs2979188)。此外,抑郁症与巴雷特食管的发生风险具有提示性的意义[IVW OR = 1.823; 95% CI 1.517; 2.142; P = 0.014]。
抑郁症与胃食管反流病的相关性显示出显著的异质性(Q = 73.86, P* = 0.003)。此外,在上述结果中没有发现其他异常值和显著的异质性。
4. 讨论
基因决定的抑郁症与胃食管反流病[IVW (OR) = 1.343; 95% CI 1.175, 1.524; P = 6.449 × 10−7]和巴雷特食管的风险[IVW OR = 1.823; 95% CI 1.517; 2.142; P = 0.014]相关。反向MR分析结果显示胃食管反流病对抑郁症的因果关系较小,但有统计学意义[IVW OR = 1.021; 95% CI 1.017, 1.025; P = 9.47 × 10−24]。另外,我们观察到巴雷特食管对胃食管反流病的临界关联[IVW OR 1.003; 95% CI 1.001; 1.004; P = 0.002]。
目前已经证明,精神心理状态的变化与脑肠轴的功能性食道疾病有关,潜在地影响情绪状态、疼痛以及对胃食管反流病症状严重程度和频率的个体感受 [17] [18] 。一项纵向视角队列研究纳入了3813例胃食管反流病患者和15,252例匹配对照组,结果显示胃食管反流病使后续抑郁的风险增加了三倍 [11] 。尽管几项研究显示抑郁症与胃食管反流病密切相关,然而探索巴雷特食管(或食管腺癌)受心理因素影响或易感性的研究一直受到限制,我们猜想可能是因为样本量的限制。目前,还没有大规模的观察性研究表明抑郁症与巴雷特食管之间存在关系。然而,先前观察到的胃食管反流病症状评分和食管炎严重程度之间的不良关联表明,心理变化可能不会推动疾病发展 [19] 。在这里,我们的结果与此不同,因为它们表明抑郁症对巴雷特风险有影响,尽管P值不是非常显著(0.00125 < P = 0.014 < 0.05)。
反向MR分析观察到胃食管反流病与抑郁症发生风险增加有因果关系。胃食管反流病这种慢性外周炎症可能导致中枢神经系统炎症反应上调,从而在随后的抑郁症进展中发挥关键的病理生理作用 [14] [20] 。此外,当发生胃食管反流病时,胃酸反流会激活自主神经系统并增加迷走神经激活,从而导致支气管收缩,导致睡眠障碍和心境障碍 [15] 。抑郁可能会通过减轻食管下括约肌压力和增加胃酸分泌,当胃酸因食管下括约肌松弛不当而进入食管远端时,进一步刺激食管来增加胃食管反流病的风险 [16] 。此外,它还可以降低感觉阈值,增加对食管刺激的敏感性 [16] 。使用抗抑郁药可能是加重反流的另一个可能因素 [21] 。
研究表明,质子泵抑制剂的疗效可能受到心理因素的影响 [22] [23] 。这表明,胃食管反流病与抑郁症更糟糕的结果之间的关系是递增的,需要更多的治疗策略来打破这种恶性循环。
我们的这项研究有别于之前的一些其他研究。首先,孟德尔随机化研究可以将这项研究从潜在的偏倚和反向因果关系中解放出来。其次,探究巴雷特食管受心理因素影响的研究一直受到样本量的限制,然而,我们利用大样本的数据库通过孟德尔随机化研究,检测因果效应的统计能力已经大大提高。尽管我们的研究有显著的优势,但它也有几个局限性。首先,由于缺乏合适的数据库,我们不能严格区分胃食管反流病的亚型。反流性食管炎、非糜烂性胃食道反流病其他两种分型与抑郁症的因果关系尚需进一步研究。其次,这项研究的样本完全来自欧洲血统,这可能会限制我们的该研究结论对其他种族或民族的推断。
5. 结论
本孟德尔随机化研究表明抑郁症与胃食管反流病之间存在双向因果关系。
NOTES
*通讯作者。