1. 前言
陈皮,原名橘皮,又名桂皮、红皮,是芸香科下的柑橘属和栽培变种的干燥成熟果皮 [1] 。可入药,在临床上用于治疗胸腹胀满、脾虚导致的身体虚弱、消化不良以及恶心呕吐等症状。陈皮所含成分复杂,主要包括挥发油类、黄酮类、生物碱类和多糖类等,具有抗氧化、抗炎、镇咳、降低胆固醇、升压、抗休克及强心等药理作用 [2] 。例如,陈皮中含有生物碱类成分辛弗林可以舒张豚鼠支气管平滑肌,发挥止喘作用;陈皮中的黄酮类成分具有降低心脑血管疾病的发病率的功效;陈皮多糖对心血管系统具有强心、升压、扩张冠脉的作用,也具有杀虫、抑菌作用,且对胃肠运动起调节作用,并且具有抗艾滋、免疫活性、抗氧化作用。目前,对于陈皮中生物活性成分的研究主要集中在黄酮、生物碱等,而对多糖的提取及性质研究鲜少涉及。本文对陈皮多糖的提取工艺进行优化,并对其抗氧化活性进行研究,对陈皮的开发利用提供一定的理论依据。
2. 材料与方法
2.1. 材料
二十年新会陈皮(江门市广盈陈皮柑普茶有限公司)、D-无水葡萄糖标准品(德思特,HPLC ≥ 98%)、石油醚(AR)、无水乙醇(AR)、浓硫酸(AR)、苯酚(AR)、抗坏血酸(Vc)、DPPH、硫酸亚铁(AR)、过氧化氢(AR)、水杨酸(AR)、纯水。
2.2. 仪器
Cary 100Scan紫外分光光度计,电热恒温鼓风干燥箱,SHZ-DⅢ予华牌循环水真空泵,HZ602B电子天平,摇摆式粉碎机,烧杯(500 mL),容量瓶(100 mL),容量瓶(25 mL),锥形瓶(100 mL),10~100 μL DRAGON移液枪。
2.3. 方法
2.3.1. 对照品溶液的制备
选取并称量葡萄糖标准品25 mg,将其放置于干燥洁净的50 mL容量瓶中,向其中加入少量去离子水充分溶解,再加水稀释至该容量瓶刻度线,混匀可得到浓度为0.5 mg/mL的对照品溶液。
2.3.2. 供试品的制备
将陈皮放入烘箱干燥,粉碎,分批取50克陈皮粉末加入放有磁子的500 mL的单口圆底烧瓶,加入其5倍量的石油醚,放在60℃的恒温水浴锅加热回流1.5 h;过滤,挥干石油醚,再与10倍药材量的80%乙醇一同加入圆底烧瓶,在80℃恒温水浴锅加热回流1.5 h;过滤,挥干乙醇,放入80℃烘箱烘干 [3] ,装入洁净干燥的密封袋中后备用。将烘干的陈皮粉过60目筛,装入密封袋,备用。
2.3.3. 葡萄糖标准曲线的制备
将25 mg葡萄糖标准品溶解在烧杯中的纯水中,转移到50 mL容量瓶中,定容。再分别移取定容后的液体1.0、2.0、3.0、4.0、5.0 mL于100 mL的容量瓶中,定容至刻度线,摇匀,放置片刻。取六只干净试管,移取2 mL纯水至未编号试管中,作为空白体系;之后准确移取各浓度标准品溶液2 mL于剩余编号试管中,用移液管依次移取1 mL新配制的5%苯酚溶液和5 mL硫酸至各试管中,静置5 min,待试管冷却至室温后,在490 nm的紫外条件下,测定吸光度,记录并整理数据,见表1,得到葡萄糖标准曲线方程:y = 13.046x − 0.0788,R2 = 0.9996。
由图1可知,葡萄糖浓度在0.01~0.05 mg/mL范围内与吸光度线性关系较好,则可利用该标准曲线进行接下来实验步骤。

Table 1. Effect of concentration of glucose solution on absorbance
表1. 葡萄糖溶液浓度对吸光度的影响
2.3.4. 陈皮多糖含量的测定
采用硫酸–苯酚法测定多糖含量,取1 mL陈皮多糖的提取液定容至25 mL容量瓶内;移取2 mL于试管内,再加入1 mL新配制的5%苯酚,最后再缓慢加入5 mL硫酸,充分振荡,静置5 min,测其吸光度,再根据葡萄糖标准曲线方程求出提取率。依据下列公式计算:
式中:C是多糖的质量浓度,mg/mL;V是多糖定容的体积,mL。
2.3.5. 单因素对照实验
1) 超声时间
称取陈皮粉末五份各1 g放置于锥形瓶中,加入乙醇溶解,设置超声温度为60℃,料液比为1:40,分别超声20 min、30 min、40 min、50 min、60 min,冷却至室温后,抽滤得滤液。按照2.3.4方法测定吸光度,计算多糖提取率,结果如表2。

Table 2. Effect of ultrasonic time on extraction rate
表2. 超声时间对提取率的影响
2) 料液比
称取陈皮粉末五份各1 g放置于锥形瓶中,加入乙醇溶解,设置超声温度为60℃,超声时间为40 min,料液比分别为1:30,1:35,1:40,1:45,1:50,冷却至室温后,抽滤得滤液。按照2.3.4方法测定吸光度,计算多糖提取率,按照2.3.4方法测定吸光度,计算总皂苷提取率,结果如表3。

Table 3. Effect of solid-liquid ratio on extraction rate
表3. 料液比对提取率的影响
3) 超声温度
称取陈皮粉末五份各1 g放置于锥形瓶中,加入乙醇溶解,设置超声温度分别为50℃、60℃、70℃、80℃、90℃,料液比为1:40,超声50 min,冷却至室温后,抽滤得滤液。按照2.3.4方法测定吸光度,计算总皂苷提取率,结果如表4。

Table 4. Effect of ultrasonic temperature on extraction yield
表4. 超声温度对提取率的影响
2.3.6. 体外抗氧化活性实验
称取陈皮粉末5 g,按照最佳条件提取。称取适量陈皮多糖和Vc (阳性对照),分别用纯水配成系列质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的多糖溶液 [4] 。
1) 对DPPH自由基清除率的测定
取5支干净试管,依次加入1 mL相应浓度的多糖待测液,滴加完成后再加入0.2000 mmol/L DPPH-乙醇溶液2.50 mL,振荡均匀,避光静置30 min,测定吸光度Nx。重复上述步骤,用95%乙醇替换DPPH乙醇溶液作为对照,测量对照NT的吸光度;用纯水替换多糖待测液,测量空白吸光度N0,按下列公式计算陈皮多糖对DPPH•的清除率 [5] [6] 。
2) 对羟基自由基清除率的测定
取5支干净试管,依次加入1.00 mL相应浓度的多糖待测液,2.00 mL 6.000 mmol/L硫酸亚铁溶液、2.00 mL 6.000 mmol/L水杨酸–乙醇溶液,静置10 min再加入2.00 mL 6.000 mmol/L过氧化氢溶液,振荡均匀,避光静置30 min,在510 nm下测定体系吸光度Ex,重复上述流程,用纯水替换过氧化氢作为对照,测定对照吸光度ET;用纯水替换多糖待测液作为空白体系,测定空白吸光度E0,按下列公式计算陈皮多糖对羟基自由基的清除率 [7] [8] [9] 。
3. 结果与分析
以陈皮多糖的提取率作为参考标准,分别考察前述三个因素对金边龙舌兰总皂苷提取率的影响。
3.1. 超声时间对提取率的影响
当超声温度为80℃,料液比为1:40时,研究不同超声时间对陈皮多糖提取率的影响。由图2可得,多糖提取率在20~40 min之间,随时间增加而不断提高,40 min达到最高提取率为8.84%,之后开始下降。分析原因可能是因为多糖经长时间加热后发生部分水解,而使其含量降低。
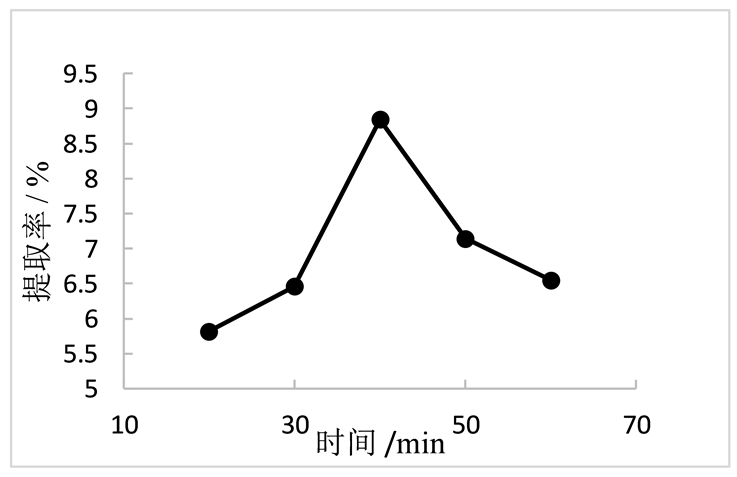
Figure 2. Relationship between ultrasonic time and extraction rate
图2. 超声时间与提取率的关系
3.2. 料液比对提取率的影响
在设定超声时间40 min,温度80℃的条件下,研究不同料液比对陈皮多糖提取率的影响。由图3可得,在料液比1:40以前,多糖的提取率随液料比增大而增大,当水平为1:40时,其值最高达12.33%。分析原因可能是是随着溶剂增加,单位提取液中含有的多糖减少而杂质增加,因此随着溶剂增加,多糖提取率逐渐下降。
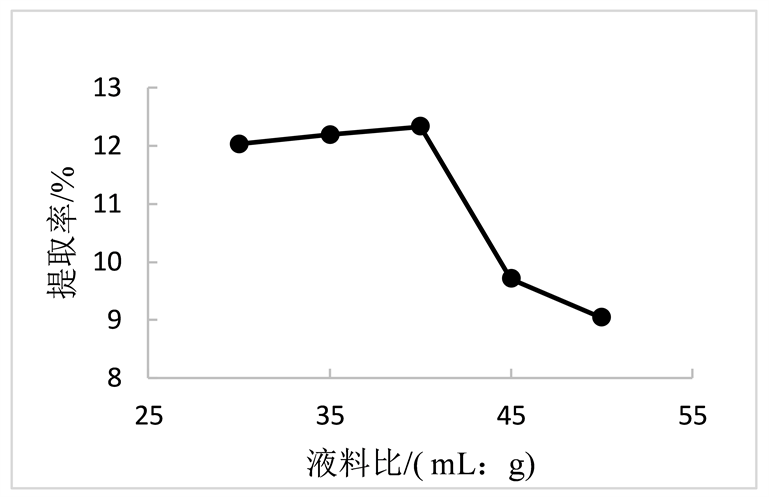
Figure 3. Relationship between solid-liquid ratio and extraction rate
图3. 料液比与提取率的关系
3.3. 超声温度对提取率的影响
在固定超声时间40 min,料液比1:40的水平下,研究不同温度对陈皮多糖提取率的影响。由图4可得,在60℃~80℃下,多糖提取率有所上升,并在80℃达最大值19.79%,随后提取率开始下降,分析原因可能是较高的温度条件会导致多糖结构破坏 [10] 。
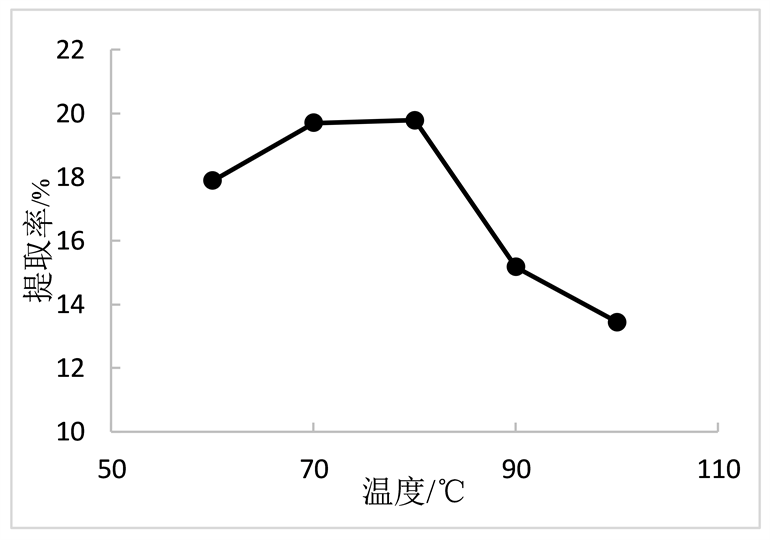
Figure 4. Relationship between ultrasonic temperature and extraction rate
图4. 超声温度与提取率的关系
3.4. 正交实验
3.4.1. 正交实验对金边龙舌兰总皂苷提取条件的优化
基于单因素试验的结果,以多糖提取率作为评价指标,进行三因素三水平正交试验L9(34)。实验因素和水平编码见表5。

Table 5. Orthogonal experimental factors and level table
表5. 正交实验因素与水平表
3.4.2. 正交试验结果分析
通过对表6的直观分析,可以发现,超声时间、料液比、超声温度均对陈皮多糖的含量提取有显著影响,影响程度依次为A > B > C,即超声时间 > 料液比 > 超声温度。通过极差分析得到的理论最优组合为A1B1C2,通过实验验证得此条件下多糖的提取率为22.32%,即超声时间30 min、料液比1:40 (g:mL)、超声温度70℃ [11] 。

Table 6. Orthogonal design and test results table
表6. 正交设计及试验结果表
以最佳提取条件进行3次平行试验,得到多糖提取率为22.32%。说明该提取条件具有较好的合理性和可靠性,表明该优化组合能有效提高陈皮多糖的提取率。
3.5. 实验验证
对正交试验得出的结果进行分析,在所选取的因素及水平范围内,得到当超声时间30 min、料液比1:40 (g:mL)、超声温度70℃时,陈皮多糖的提取效果最佳;接着对最佳提取条件进行验证,进行三次重复试验,得到金边龙舌兰总皂苷的提取率为22.32%,表明在陈皮多糖的提取工艺条件中,正交试验优化后的提取条件适合对陈皮多糖的提取。
3.6. 体外抗氧化活性研究的分析
3.6.1. DPPH自由基的清除能力
从图5可以看出,对DPPH自由基的清除率随着多糖浓度的一起上升。虽低于Vc清除率,但在多糖浓度为1.0 mg/mL时,DPPH自由基消除率可达37.95%,表明陈皮多糖具有良好的清除DPPH自由基效果。
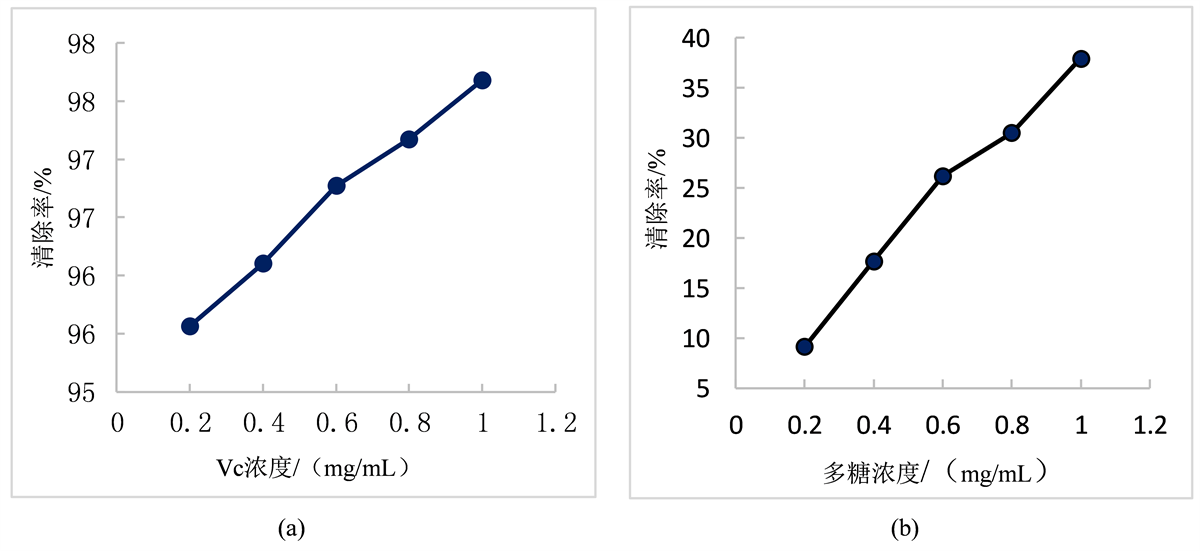
Figure 5. Change of DPPH free radical scavenging ability of samples with different mass concentrations
图5. 不同质量浓度样品对DPPH自由基清除能力的变化
3.6.2. 羟基自由基的清除能力
从图6可以看出,在实验的浓度范围内,陈皮多糖对羟基自由基清除率随多糖浓度一起上升。总体来看,尽管清除效果低于Vc,但在多糖浓度为1.0 mg/mL时,羟基自由基消除率达到6.57%,说明陈皮多糖具有一定的清除羟基自由基的能力。
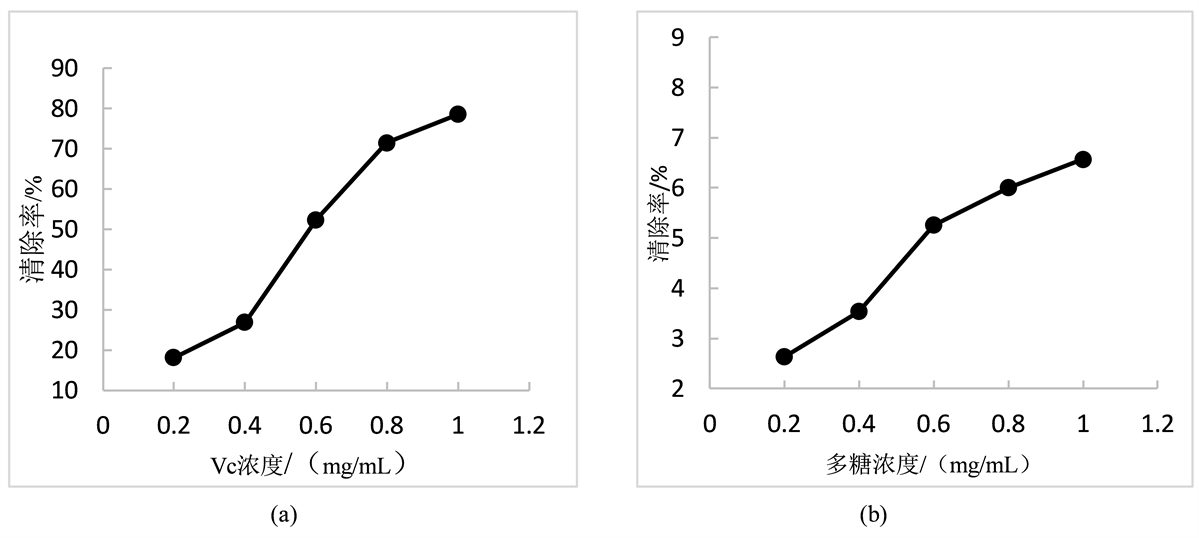
Figure 6. Changes of hydroxyl radical scavenging ability of samples with different mass concentrations
图6. 不同质量浓度样品对羟基自由基清除能力的变化
4. 结论
本实验采用单因素试验和正交试验法对陈皮多糖的提取工艺进行优选,筛选出最佳提取工艺:超声时间30 min,超声温度70℃,料液比1:40,提取率达到22.32%,接近正交试验中的最大提取率,说明优化后的提取条件效果较好。同时,从测定的体外抗氧化实验结果来看,羟基自由基清除率为6.57%,DPPH自由基清除率为37.95%,说明陈皮中的多糖具有较好的抗氧化活性,这为陈皮的深度利用提供了一定的数据依据。
本实验测定陈皮中多糖的含量,并为多糖的开发提供了一些数据基础。但也存在一定局限性:如实验中所提取的多糖,没有进行杂质检测,若要进一步得到准确的数据,需要在测定波长时,鉴定提取的多糖中是否含有蛋白质、色素等杂质。
基金项目
安徽省大学生创新创业训练计划项目(2022CXXL098, 2022CXXL092);滁州学院大学生创新创业训练计划项目(2022CXXL2050115)。
NOTES
*通讯作者。