1. 引言
泡沫是一种由气体与液体分散而成的分散系统,气体是以微小的气泡的方式分散在液相中,液相是一种连续相 [1] 。想要形成泡沫还需要加入发泡剂。常见的发泡剂是表面活性剂。胶体颗粒也能吸附在气/液界面从而稳定泡沫 [2] ,形成热力学超稳定体系,这种由胶体颗粒稳定的泡沫称为Pickering泡沫。
在实际的生活应用中,例如在燃料能源生产、泡沫浮选等领域,经常会有要求泡沫保持暂时稳定的情况,但是在使用过后需要能迅速的消泡 [3] 。这就衍生了一种新型的泡沫:即开关性或刺激–响应性泡沫。在某种程度上可以把它们当作智能体系,具有一定的响应性,因此在当今社会中受到越来越多的关注,发展也越来越迅速。通过开关性表面活性剂,可以制得相应的开关性泡沫,触发机制包括目前已经报道的开关或触发机制有多种,包括电化学开关 [4] [5] 、光开关 [6] [7] 、pH开关 [8] [9] 、温度开关 [10] 和CO2/N2 [11] [12] [13] 开关等。
此外,人们还制得了各种刺激–响应性聚合物,如pH/温度双响应的聚合物 [14] 、光/温度双响应的聚合物 [15] ,它们也可以用于制备开关性泡沫。无论是开关性表面活性剂,还是开关性聚合物,用它们制得的开关性乳状液和泡沫都是热力学不稳定体系,并且需要较高的浓度(>cmc)。另一方面,人们已经设计制备出多种刺激–响应性双亲颗粒,已报道的触发机制有pH、温度、光照、CO2/N2、磁场、离子强度、pH–温度、光照–温度、磁场–温度以及CO2–pH等 [16] [17] [18] ,然而这些胶体颗粒多为功能高分子颗粒,其合成、制备过程一般较为复杂。
尽管这些颗粒具有单一或双重响应性,但它们几乎都是功能性聚合物或是无机/有机杂化物,其合成过程较为复杂和困难。如果能够寻找到更为简单和方便的途径(例如避免复杂的合成)来获得开关性或刺激–响应性表面活性颗粒,则在理论和应用上都具有重要的意义。
本文将研究纳米TiO2颗粒与阳离子表面活性剂CTAB之间的相互作用,通过发泡性能和稳泡性能等数据表征TiO2颗粒稳定的Pickering泡沫。并寻找合适的触发机制,使得泡沫能够在“开”和“关”之间相互转化,探索制备刺激–响应性Pickering泡沫的可行性以及相关的作用机理。
2. 实验
2.1. 实验材料和仪器
纳米TiO2 (99%):北京德科岛金科技有限公司;十六烷基三甲基溴化铵(CTAB, 99%):国药集团化学试剂有限公司;十二烷基硫酸钠(SDS, 99%):美国Sigma;乙醇(95%):上海振兴化工一厂。
超声波处理器:FS-250,上海生析超声仪器有限公司;生物显微镜:TL1530,上海缔伦光学仪器有限公司;分析天平:FA2004,上海津平天平仪器厂;蔡司场发射扫描电镜:Gemini SEM 300,Zeta电位仪:NanoBrook 90Plus Zeta,美国布鲁克海文仪器公司;接触角仪:JGW-360B,承德市成慧试验机有限公司;红外压片机:FW-4,天津光学仪器厂;超声清洗机:JP4820700,深圳市洁盟清洗设备有限公司;电热恒温鼓风干燥箱:DHG-914385-111型,上海圣科仪器设备有限公司。
2.2. 实验方法
2.2.1. SEM扫描电镜测定纳米颗粒
提前一天将适量纳米TiO2粉末样溶解在乙醇里面,然后在超声波清洗机中进行超声分散大约9 min,滴在准备好的硅片上,滴两次,待乙醇挥发之后,将滴过样品的硅片粘在样品台上,第二天通过蔡司场发射扫描电镜(Gemini SEM 300)拍摄图像。
2.2.2. Pickering泡沫的制备
配制不同浓度的表面活性剂溶液,取10 ml至50 ml的具塞量筒中,上下振荡20次手摇发泡,按时拍摄并记录表面活性剂单独发泡情况。
取一系列高6.5 cm、直径2.5 cm的柱形瓶,将提前计算并称量好的0.5% TiO2颗粒倒入,用滴管加入10 ml纯水或表面活性剂,然后用物理超声波破碎仪将纳米颗粒分散1 min。将分散好的分散液在室温(20℃~25℃)下用移液管转移到50 ml容量的具塞量筒中,盖紧塞子,用手摇发泡式的方法上下震荡20次。待所有分散液均震荡完毕后,立即用手机或照相机拍下外观照片并记录泡沫体积,然后分别记录30 min、1 h、2 h、6 h、12 h、24 h、48 h时的外观照片以及泡沫体积。
2.2.3. 显微照片的拍摄
把10 cm3的分散液倒入柱形瓶中,手摇震荡20次,用滴管吸取一滴泡沫中部气泡,滴在载玻片上,并准备一滴管的纯水准备稀释。调整光学显微镜进行观察,目镜选择5倍,光源选择下光源,调节焦距至图像清晰可见,在显微镜连接的电脑上及时捕获图片并保存。
2.2.4. Zeta电位的测定
将0.5%的纳米TiO2分散于10 mL CTAB或纯水中,静置12 h后用NanoBrook 90Plus Zeta电位仪测定Zeta电位。注意,测量电位时,要先用去离子水清洗样品池和电极至少3遍,然后再用待测液润洗样品池和电极3遍,最后再加入约样品池2/3的待测液,把电极插入样品池,要保证电极能全部浸入在溶液中。将样品池放入电位仪中进行测定。
2.2.5. 接触角的测定
配制好10个不同浓度的CTAB溶液,用压片机将纳米TiO2粉末压成薄片,用微量进样器每次吸取10 uL CTAB溶液滴于纳米TiO2薄片上,用JGW-360B接触角测定仪测定接触角,并记录数据。
3. 结果与讨论
3.1. 纳米TiO2的形貌
纳米TiO2颗粒的直径约为30~50 nm,且有一定的聚集性,图1为其扫描电镜图(SEM)。

Figure 1. SEM image of powdered TiO2 nanoparticles
图1. 纳米TiO2的扫描电镜图
3.2. TiO2颗粒/CTAB制备Pickering泡沫
3.2.1. TiO2颗粒单独制备泡沫
将0.5%纳米TiO2颗粒分散在水中,作发泡实验后发现瞬间泡沫体积几乎为零,分散液呈现浑浊状,如图2所示。通过照片可以观察无论如何增加浓度,单独的纳米TiO2都不能发泡,表明单独的TiO2颗粒没有表面活性,不能吸附在气–液界面上。

Figure 2. Digital photographs of aqueous foams stabilized by TiO2 nanoparticles alone at different concentrations, taken immediately (A) and 24 h later (B) TiO2 nanoparticles concentrations from left to right are 0.1%, 0.3%, 0.5%, 1%, 2%
图2. 纳米TiO2单独发泡的外观照片。(A) 震荡后立即拍照;(B) 震荡后24 h拍照;纳米TiO2浓度(从左到右) 0.1%,0.3%,0.5%,1%,2%
3.2.2. CTAB单独制备泡沫
对于CTAB单独制备泡沫的体系,通过观察发现当CTAB的浓度<6 × 10−4 mol/L时,泡沫产生的量非常少,甚至在前两个浓度时,几乎没有泡沫产生。但当浓度>6 × 10−4 mol/L,即接近cmc时,溶液具备一定的发泡能力,且随着浓度的增加,泡沫体积越来越多。但体系的稳泡能力比较差,泡沫在2 h后变得较为稀疏,24小时后几乎全部消失,如图3所示。

Figure 3. Digital photographs of aqueous foams stabilized by CTAB alone at different concentration, taken immediately (A), 2 h later (B) and 24 h later (C). CTAB concentration from left to right: 1 × 10−5, 3 × 10−5, 6 × 10−5, 1 × 10−4, 3 × 10−4, 6 × 10−4, 1 × 10−3, 3 × 10−3, 6 × 10−3 and 1 × 10−2 mol/L
图3. CTAB单独发泡体系的外观照片。(A) 震荡后立即拍照;(B) 震荡后2h拍照;(C) 震荡后24 h拍照。CTAB浓度(从左到右) 1 × 10−5,3 × 10−5,6 × 10−5,1 × 10−4,3 × 10−4,6 × 10−4,1 × 10−3,3 × 10−3,6 × 10−3,1 × 10−2 mol/L
3.2.3. TiO2颗粒/CTAB共同稳定Pickering泡沫
从图4(A)可以看出,当0.5% TiO2颗粒分散在不同浓度的CTAB水溶液后,当CTAB的浓度较低时(6 × 10−5 mol/L),就可以产生较为丰富的泡沫,且随着CTAB浓度的增加,泡沫的体积呈显著增加的趋势。12小时之后,稳泡性能依旧较好,如图4(B)所示,48 h后泡沫基本完全消失(图4(C))。

Figure 4. Digital photographs of aqueous foams stabilized by 0.5 wt.% TiO2 nanoparticles in combination with CTAB at different concentrations, taken immediately after shaking (A), 12 h later (B) and 24 h later (C). CTAB concentrations from left to right: 1 × 10−5, 3 × 10−5, 6 × 10−5, 1 × 10−4, 3 × 10−4, 6 × 10−4, 1 × 10−3, 3 × 10−3, 6 × 10−3 and 1 × 10−2 mol/L
图4. 0.5% TiO2颗粒和不同浓度的阳离子表面活性剂CTAB共同稳定的Pickering泡沫,(A) 震荡后立即拍照;(B)震荡后12 h拍照;(C) 震荡后48 h拍照。表面活性剂CTAB的浓度(从左到右)为:1 × 10−5,3 × 10−5,6 × 10−5,1 × 10−4,3 × 10−4,6 × 10−4,1 × 10−3,3 × 10−3,6 × 10−3,1 × 10−2 mol/L
单独的TiO2颗粒不能发泡,相同浓度的CTAB,混合体系中产生的泡沫比单独CTAB制备的泡沫更多而且更加稳定。这些结果表明,TiO2颗粒/CTAB体系良好的发泡性和稳泡性源自于纳米TiO2颗粒与表面活性剂CTAB之间的相互作用,TiO2颗粒在CTAB的作用下具有了表面活性,从而能够吸附在气–液上稳定Pickering泡沫。
如图5是0.5% TiO2颗粒和表面活性剂CTAB混合体系所产生泡沫的显微照片。从图中可以看到,气泡的平均大小随表面活性剂浓度的增加而减小。比如1 × 10−4 mol/L时最大的气泡直径达到350 mm,而3 × 10−3 mol/L时最大的气泡直径下降到250 mm。
3.3. Pickering泡沫的刺激–响应性
选取一个发泡体系(0.5% TiO2 + 3 × 10−4 mol/L CTAB)震荡20次后得到丰富的泡沫,泡沫体积约30 cm3,如图6(A)所示。随后,在加入SDS水溶液(所加入的SDS与体系中的CTAB摩尔数相等),充分震荡后,泡沫几乎完全消失,如图6(B)所示。再向其中加入0.1 g(cm3)浓度为3 × 10−2 mol/L的CTAB水溶液,震荡后泡沫重新产生,且泡沫体积和首次发泡所得泡沫体积差不多,如图6(C)所示。如此反复进行五个循环。每次在“开”的状态下,得到的泡沫体积基本相同。由此可见我们获得了从图6(A)~(J)的刺激–响应性Pickering泡沫。
在加入和体系中CTAB等量的SDS,并且充分震荡后,发现具塞量筒中泡沫几乎完全消失。这一情况充分表明了阴离子表面活性剂SDS的存在会阻碍阳离子表面活性剂CTAB与纳米TiO2颗粒的相互作用,使得纳米TiO2颗粒不再能被原位疏水化,表面活性消失,而由于SDS和CTAB自身同时产生了强相互作用,生成离子对(阴离子/阳离子复合物),也不能稳定泡沫,所以泡沫消失。再加入游离的CTAB,使体系中CTAB的浓度和初始保持相同,震荡之后,泡沫又会重新生成,体积也会和初始时基本相同。Pickering泡沫的开关实验一共进行了5次,这种消泡–发泡循环还能够继续做下去,其中每次发泡时泡沫体积基本相同,但随着体系中积累的阴离子表面活性剂SDS越来越多,消泡时的效率也会随之而下降。当实验到第四次和第五次时发现,消泡不能完全进行,会有少许泡沫残留。
3.4. 作用机理分析
经测定TiO2颗粒在纯水中的Zeta电位 = −23.2 mV,表明其在水中带负电,CTAB是带正电的阳离子表面活性剂,当颗粒与阳离子表面活性剂混合时,CTAB能够吸附于颗粒表面,颗粒表面的负电荷不断被中和,当CTAB的浓度增加时,Zeta电位越来越大,由负变零再变为正,如图7所示。TiO2颗粒表面越来越多的负电荷被中和,更多的纳米TiO2颗粒表面改性,泡沫体系也变得更加稳定。

Figure 7. Zeta potentials of 0.1% TiO2 nanoparticles dispersed in aqueous CTAB solutions as a function of initial CTAB concentration
图7. 含0.1%纳米TiO2颗粒分散在不同浓度CTAB水溶液中,Zeta电位值随CTAB初始浓度的变化
图8是CTAB水溶液在TiO2颗粒表面的接触角随CTAB浓度的变化。每个接触角是至少三个不同位置上测定的平均值。测得纯水在颗粒表面的接触角为12.48˚,表明TiO2颗粒比较亲水。从图8可见,随着CTAB浓度的增加,接触角缓缓增加,最终达到一个最大值(55.89˚)。这些数据表明,阳离子表面活性剂CTAB通过静电作用,吸附到颗粒表面,形成单分子层。吸附方式为带正电荷的头基朝向颗粒表面,中和负电荷;尾基(烷基链)朝向空气。随着CTAB浓度不断增加,吸附在颗粒表面的CTAB分子越来越多,疏水性越来越强,所以接触角越来越大。这种相互作用使纳米TiO2颗粒表面的亲水性减弱,疏水性增加,成为表面活性颗粒 ,因此能够吸附到空气/水界面,稳定Pickering泡沫。
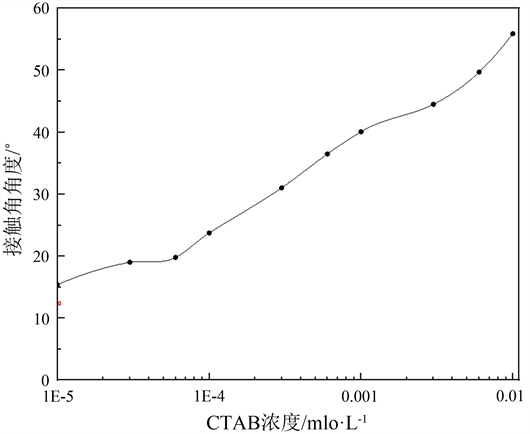
Figure 8. Contact angle of CTAB aqueous solutions on TiO2 film in air as function of initial CTAB concentration
图8. CTAB溶液在TiO2薄膜上的接触角随溶液中CTAB初始浓度的变化
4. 结论
(1) 无机纳米TiO2颗粒能够和微量(小于1/10 cmc)的常规阳离子表面活性剂例如CTAB相互作用,稳定Pickering泡沫。
(2) 在纳米TiO2颗粒和微量阳离子表面活性剂稳定的Pickering泡沫中加入与阳离子表面活性剂等摩尔量的阴离子表面活性剂,例如SDS。这样即可导致体系消泡,再次加入相同浓度的游离阳离子表面活性剂,震荡后泡沫又产生并保持稳定。Pickering泡沫因此可以在稳定–不稳定之间循环变化,即“开”与“关”的循环呈现,得到刺激–响应性Pickering泡沫。
(3) 原始的纳米TiO2颗粒表面活性较低,不能吸附在气–液界面。其在水溶液中带负电,阳离子表面活性剂如CTAB通过静电作用,亲水基吸附在颗粒表面,疏水基朝向空气,使得颗粒被原位疏水化,变为表面活性颗粒,从而吸附在气–液界面,形成稳定的Pickering泡沫。
参考文献
NOTES
*第一作者。
#通讯作者。