1. 引言
脂肪酶又称三酰基甘油水解酶(EC 3.1.1.3),是一类能在油水界面或非水相系统中催化酯类物质发生水解、酯化、酯交换以及合成等化学反应的生物催化剂,广泛存在于动植物和微生物中,其中微生物脂肪酶是工业用脂肪酶的主要来源。脂肪酶被广泛应用于食品、医药、化妆品、饲料、生物柴油制备等领域,但很多工业用脂肪酶在实际生产中由于耐热或耐酸性能差而失活,或酶作用的最适温度和pH值不在生产要求范围内而受限制。目前,酸性脂肪酶在国内还没有工业化,对酸性脂肪酶的需求依然依赖于进口[1] -[4] 。因此,获得一株性状优良、适合工业生产需求的高产脂肪酶菌株已成为脂肪酶应用研究开发的关键,在加紧寻找野生型高产脂肪酶菌株之外,诱变育种也是获得高产脂肪酶菌株的一种有效手段[5] [6] 。
诱变育种是利用物理或化学诱变剂诱发微生物基因突变,改变遗传结构与功能,然后采用简单、快速和高效的筛选方法,从中筛选出产量高、性状优良的突变株[7] [8] 。本研究以产脂肪酶菌株A-16为出发菌株,通过紫外线(UV)和甲基磺酸乙酯(EMS)的复合诱变选育,获得产脂肪酶活力显著提高且传代稳定性良好的突变株,并对其进行产酶条件优化,为该菌株的工业化生产提供实验指导。
2. 材料与方法
2.1. 材料
2.1.1. 菌种
以橄榄油为单一碳源,通过溴甲酚紫平板初筛和三丁酸甘油酯琼脂平板鉴定法从含油土壤中分离并保存的野生型产耐高温酸性脂肪酶菌株A-16,作为出发菌株。
2.1.2. 试剂
橄榄油,西班牙原装进口;吐温-80,英国进口;甲基磺酸乙酯(EMS),SIGMA公司;聚乙烯醇(PVA-1750),国药集团化学试剂有限公司;溴甲酚紫,硫代硫酸钠均为国产分析纯。
2.1.3. 主要仪器
Eppendorf 5417R台式高速冷冻离心机,德国产品;SW-CJ-2F型双人双面净化工作台,苏州净化设备有限公司;DK-8D型电热恒温水槽,上海精宏实验设备有限公司;HZQ-F160全温振荡器,哈尔滨东联电子有限公司;99-1型大功率磁力搅拌器,常州国华电器有限公司。
2.1.4. 培养基
斜面培养基(g/L):牛肉膏3.0,蛋白胨10.0,K2HPO4 1.0,NaCl 1.0,(NH4)2SO4 2.0,MgSO4∙7H2O 1.0,琼脂15.0,橄榄油10.0 mL/L,pH 5.0。
溴甲酚紫平板筛选培养基[9] 。
种子培养基(g/L):蛋白胨10.0,K2HPO4 1.0,NaCl 1.0,(NH4)2SO4 1.0,MgSO4∙7H2O 1.0,葡萄糖15.0,橄榄油10.0 mL/L,pH 5.0。
发酵培养基(g/L):蛋白胨10.0,酵母膏10.0,蔗糖10.0,(NH4)2SO4 2.0,K2HPO4 1.0,NaCl 1.0,MgSO4∙7H2O 1.0,橄榄油10.0 mL/L,pH 5.0。
2.2. 实验方法
2.2.1. 菌株活化
按照无菌操作的要求,将低温冰箱(−80℃)保存的产耐高温酸性脂肪酶菌株A-16进行划线传代培养,然后选取Hc值[10] (菌落水解圈直径与菌落直径之比)较大的菌落接种到种子培养基中,于45℃、180 r/min摇床培养24 h。
2.2.2. 菌悬液的制备
移取1 mL新鲜培养物于盛有9 mL无菌生理盐水(0.6%)的培养皿中,加入无菌玻璃珠振荡20 min。然后配制菌悬液,并用血球计数板计数,调整菌体浓度为106~107 CFU/mL。
2.2.3. 紫外诱变
超净工作台内,照射前开启紫外灯预热20 min。取10 mL菌悬液于直径为9 cm的无菌培养皿中,放入2 cm长无菌转子,将培养皿置于磁力搅拌器上,紫外灯功率为30 W,照射垂直距离为20 cm,分别照射60、90、120、150、180、210、240s。照射结束后在红光照射下操作,将紫外照射过的菌悬液和未经紫外照射的菌悬液分别进行梯度稀释(10−4~10−6),移取各梯度稀释液0.1 mL涂布于平板筛选培养基,每种稀释液涂3个平板,用黑布包裹,置于45℃暗箱中培养48 h,观察菌落生长情况并计算不同UV照射条件下的致死率和正变率。
致死率(%) = (诱变前菌落数 − 诱变后菌落数)/诱变前菌落数 × 100%
正变率(%) = Hc值增大的菌落数/诱变后菌落总数 [11] -[14] 。
2.2.4. 甲基磺酸乙酯(EMS)诱变
选取经紫外线照射后酶活最高的突变株为出发菌株,按2.2.2节方法制备菌悬液。取5 mL菌悬液,加入15 mL磷酸缓冲液和不同体积的EMS溶液,使EMS终浓度分别为:1.0%、1.5%、2.0%、2.5%、3.0%。在45℃、180 r/min下分别振荡处理10、15、20、25、30 min后,立即取5 mL处理液于无菌试管中,加入1 mL 25%硫代硫酸钠溶液终止反应。对菌体进行稀释后,涂布于平板筛选培养基上,45℃培养48 h,并以没有经过EMS处理的菌液作对照。根据对照平板上的菌落数,计算致死率和正变率 [15] [16] ,计算方法同上。
2.2.5. 突变菌株的筛选
初筛:将诱变后长出的菌落以点种方式转接到平板初筛培养基上,以出发菌株为对照,计算各突变株Hc值,挑选高于同批对照菌株Hc值的突变株供复筛备用。
复筛:挑取初筛得到的突变株接种于种子培养基中,45℃、180 r/min培养24 h后,按2% (V/V)接种量接种到发酵培养基中,45℃、180 r/min条件下培养48 h,测酶活,筛选出高产脂肪酶突变株。
2.2.6. 酶活力测定
按GB/T 23535-2009 [17] 测定。酶活力单位定义为:1 mL液体酶,在40℃和pH 7.5条件下,每分钟水解橄榄油产生1 μmol可滴定的脂肪酸,即为1个酶活力单位(U),以U/mL表示。
2.2.7. 突变株的遗传稳定性测定
将产脂肪酶最高的突变株连续5代传代培养,将各子代突变株转接到发酵培养基中,测其产脂肪酶能力的稳定性。
2.3. 产酶条件优化
以相对酶活为指标,研究发酵条件初始pH值、温度以及吐温-80添加量对菌株产酶的影响,每个试验点做3个平行,试验结果用平均值±标准偏差表示。在单因素试验的基础上,以pH值(A)、温度(B)以及吐温-80 添加量(C)为变量,相对酶活为响应值,设计了3因素3水平共17个试验点的响应面分析试验 [9] 。实验因素与水平见表1。
3. 结果与分析
对产脂肪酶菌株A-16进行酶学性质研究,结果发现:该酶的最适温度为50℃、pH 4.5,并且在70℃范围内热处理1 h后酶活力还保持在78%以上;同时该酶在酸性环境中保温1 h后可保持70%以上的酶活力。因此,说明该酶具有良好的热稳定性以及在酸性条件下稳定性较好。
3.1. 紫外诱变结果
菌株A-16经紫外诱变处理后,致死率、正突变率与照射时间的关系见图1。
由图1可知:致死率随着紫外照射时间的延长而逐渐增大,但正变率并不是随着照射时间的延长而增大的,在照射时间180 s内,正变率随着照射时间的延长而增大,当超过180 s后,正变率逐渐降低。因此,选择照射时间为180 s。将诱变处理后的菌悬液经平板初筛,摇瓶复筛,得到12株产酶活力高于原始出发菌株的突变菌株。通过对这12株正突变株的遗传稳定性测定,结果见表2,由表2可知,突变株U-08相对酶活

Table 1. Factors and the level of response surface experiment
表1. 响应面试验因素与水平

Table 2. The results of UV mutagenesis strains
表2. 紫外诱变菌株的筛选结果
最高,较原始菌株提高了21.8%,且酶活力为12415.5 U/mL。以U-08突变株为出发菌株进行EMS诱变。
3.2. 甲基磺酸乙酯诱变结果
以菌株U-08为出发菌株,采用不同浓度的EMS处理不同时间,菌株致死率、正突变率随处理时间的变化见图2。
由图2可以看出,菌株对甲基磺酸乙酯诱变极为敏感,致死率随着EMS浓度的增大及处理时间的延长而逐渐增加,当EMS终浓度在2.5%、3%时,处理10 min致死率达到80%,处理20 min菌体几乎无存活。但正变率与EMS浓度以及处理时间并不满足线性关系,当EMS终浓度为1%、1.5%时,菌株的正变率都随着EMS处理时间的延长而增加;当EMS终浓度为2%时,菌株的正变率随着EMS作用时间的延长先上升后下降;当EMS终浓度为2.5%、3%时,菌株的正变率都随着EMS作用时间的延长而降低。综合EMS在不同诱变条件下对出发菌株的诱变效果,选择EMS终浓度为2%,作用时间为20 min,此时正突变率达到最大值。将诱变处理后的菌悬液经平板初筛,摇瓶复筛,得到8株Hc值高于出发菌株的突变菌株,对其遗传稳定性测定,结果见表3,由表3可知,突变株UE-03相对酶活最高,较原始菌株提高了73.6%,且酶活力为17695.6 U/mL。
3.3. 突变株UE-03的遗传稳定性
将选育到的突变株UE-03在斜面培养基上连续5次传代培养,并转接到发酵培养基培养48 h,观察各子代产脂肪酶能力的稳定性,结果见图3。
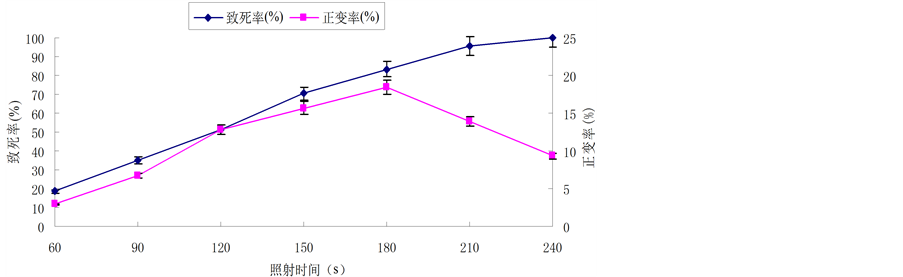
Figure 1. The effect of different mutation time on mutagenic rate and death ratio
图1. 不同照射时间对正变率和致死率的影响

Figure 2. Mutagenic effects of different EMS concentrations
图2. 不同EMS浓度的诱变效果
由图3可以看出UE-03突变株经过5次连续传代后,产脂肪酶活力无显著差异,说明其具有良好的遗传稳定性。
3.4. 不同初始pH值对菌株产酶的影响
不同的pH值对菌体的生长和发酵产酶影响较大,将UE-03菌株在不同pH值(3.0~7.0,间隔一个pH单位)、45℃、180 r/min条件下培养48 h后,离心,取上清液测脂肪酶活力,以初始 pH 4.0 时的发酵液酶活为基准,计算相对酶活,结果如图4所示。从图4中可以看出,pH值4. 0时,菌体产酶量达到最大。
3.5. 不同温度对产酶的影响
温度也是影响菌体生长和产脂肪酶的重要因素之一。将菌体分别置于不同温度下(30℃~60℃,间隔5℃)培养,以发酵温度为45℃时的发酵液酶活为基准,计算相对酶活,结果见图5。由图5可知,菌株在45℃时,相对酶活最高。

Table 3. The results of EMS mutagenesis strains
表3. EMS诱变菌株结果

Figure 3. The stability of mutant No.UE-03
图3. UE-03的遗传稳定性

Figure 4. The effect of pH on the production of lipase from UE-03
图4. pH对UE-03产脂肪酶的影响
3.6. 表面活性剂吐温-80 添加量对菌株产酶的影响
由于表面活性剂具有增加细胞膜的通透性作用,因此在培养基中加入表面活性剂可以促进菌体产脂肪酶。在最佳温度、pH条件下,研究不同吐温-80添加量对菌体产酶的影响。以培养基未添加吐温-80时的发酵液酶活为基准,计算相对酶活,结果如图6。从图6可以看出,吐温-80添加量在0%~0.15% w/v时,尽管相对酶活有所升高,但对菌体产酶影响不大。
3.7. 响应面法优化实验
根据单因素试验条件,pH值(A)、温度(B)以及吐温-80添加量(C)为变量对菌株产酶影响比较显著。因此,以pH值(A)、温度(B)以及吐温-80添加量(C)为变量为变量,菌株相对酶活为响应值,用Design Expert8.0 Trial软件通过中心组合法寻求最优发酵工艺参数[18] ,实验设计及结果见表4,方差分析见表5,根据回归方程作出不同因子的响应面分析图见图7。
试验数据使用Design-Expert8.0 Trial软件进行二次回归拟合后,得到以下回归方程:Y = 105.88 + 2.28A − 2.75B + 2.18C − 2.35AB + 0.47AC − 0.13BC − 8.00A2 − 7.34B2 + 0.70C2,式中:Y为相对酶活;A为温度;B为初始pH;C为吐温-80添加量。
运用Design Expert8.0 Trial软件进行回归分析,回归方程的方差分析见表5,由表5可知,模型的P值<0.0001,说明模型显著。同时模型中自变量一次项A,B,C,二次项AB,A2,B2显著(α = 0.01)。模
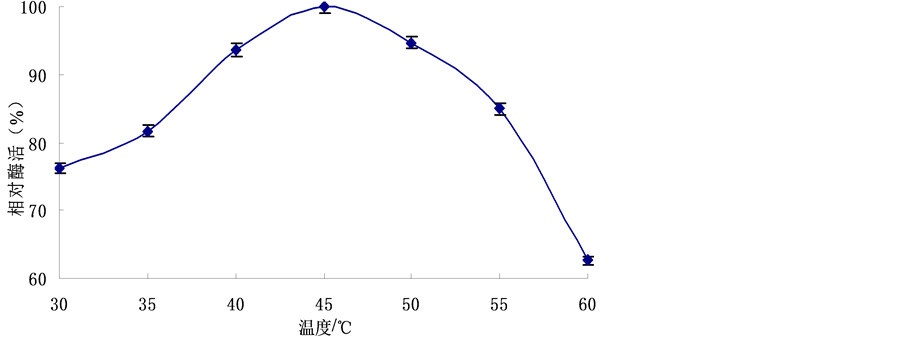
Figure 5. The effect of temperature on the production of lipase from UE-03
图5. 温度对UE-03产脂肪酶的影响

Figure 6. The effect of tween-80 concentration on the production of lipase from UE-03
图6. 吐温-80添加量对UE-03产脂肪酶的影响
 (a) (b) (c)
(a) (b) (c)
Figure 7. The three-dimensional chart of response surface analysis; interact of (a) temperature and pH; (b) temperature and tween-80; (c) pH and tween-80
图7. 响应面立体分析图;(a) 温度和pH交互作用;(b) 温度和吐温-80添加量交互作用;(c) pH和吐温-80添加量交互作用

Table 4. The design and results of response surface experiments
表4. 响应面试验设计及结果
型失拟项的P值>0.05,说明模型选择合适。因此可用该回归方程代替试验真实点对实验结果进行分析[9] 。同时,由软件分析得到模型的校正决定系数R2 = 0.9884,说明该模型最多只有约1.16%的变化不能用此模型来解释。本实验偏差系数(CV)为1.08%,其值较低,能由该模型解释,进一步说明模型拟合优度较好[19] 。
对回归方程进行分析,得出最佳产酶条件(见表6)为:pH 4.28,温度46.8℃,吐温-80添加量0.15% w/v,相对酶活为109.29%。采用最优发酵条件进行产酶实验,重复三次,相对酶活为(109.27 ± 0.16)%,与模型预测值接近,说明该模型较可靠。
4. 结论
随着现代蛋白质工程技术的快速发展,基因改造已经用于菌种选育,但传统的理化因素诱变育种方法具有简便、快速、高效等优点,因而在实际生产中仍被广泛使用。本研究以实验室保藏的产耐高温酸性脂肪酶菌株A-16作为出发菌株,通过紫外线和EMS的复合诱变选育,得到1株产脂肪酶活力较高的突变株UE-03,其产脂肪酶活力为17695.6 U/mL,比原始菌株提高了73.6%。对于生产菌株来说,只有具备良好的遗传稳定性才能在工业生产上广泛应用,本文所筛选到的突变株UE-03连续5代传代培养后发现产酶较稳定。试验结果表明紫外线和EMS的复合诱变可以显著提高菌株产脂肪酶能力,同时也表明了传统的理化因素诱变在微生物诱变育种中效果较显著。
表5. 方差分析表
注:Prob > F值小于0.05表明模型或考察因素影响显著;Prob > F值小于0.01说明影响极显著。

Table 6. Optimum conditions of response surface optimization
表6. 响应面优化最佳条件
通过单因素试验和Box-Benhnken响应面分析法对UE-03菌株发酵条件进行了优化,得到优化发酵条件为:pH 4.28,温度46.8℃,吐温-80添加量0.15% w/v,相对酶活为109.29%,在最优发酵条件下,产酶活力达到19339.5 U/mL,为该菌株工业化生产提供优良菌种和技术参考。
基金项目
广西高校科学技术研究项目(KY2015YB281);百色学院校级科研项目(2013KB01)。