1. 引言
苯甲醛 [1] - [6] 是一类非常重要的精细化工中间体,因其分子中含有化学性质活泼的醛基,可以合成出多种衍生产品,广泛应用于医药、染料、化妆品、食品添加剂等工业领域。苯甲醇氧化是合成苯甲醛的主要方法之一,传统上多采用MnO2、CrO3等作为氧化剂,对环境造成很大的污染,而以分子氧为氧化剂的催化氧化法 [6] [7] 不仅绿色环保,而且具有高活性、高选择性等特点,其中负载型非均相催化过程还具有催化剂可分离和循环使用等优点,因而受到人们的普遍关注。
CeO2是一种重要的稀土氧化物材料,具有良好的热稳定性和化学稳定性。由于Ce3+与Ce4+之间存在电子转移并伴随氧空位的产生和消除,使得CeO2具有很多特殊的性能 [8] ,除应用于燃料电池、电容器、光学及医药等领域外 [9] [10] ,还被广泛用作催化剂载体。CeO2负载的Pt [11] 、Au [12] 、Ag [13] 、Ru [14] 等贵金属催化剂,已有许多文献报道。CeO2载体不仅能够分散贵金属、抑制其二次生长,而且与贵金属间产生强相互作用,使得催化活性进一步增强。这类催化剂在CO氧化、甲烷水蒸汽重整、NO与NO2的氧化还原等方面得到了广泛应用 [15] [16] ,为减少环境污染以及缓减能源压力做出了重要贡献,近年来也作为芳香醇绿色氧化的负载型非均相催化剂得到研究。
苯甲醇沸点较高,其催化氧化反应通常是液–固混合体系,基于过滤分离的催化剂回收方法效率较低,且易造成催化剂和活性组分的流失 [17] 。赋予催化剂适当的磁性,使催化剂在外加磁场下可与液相体系快速分离,可显著提高催化剂的回收效果。本文以Fe3O4磁性颗粒为催化剂磁源,介孔CeO2(mCeO2)为磁源包覆层和催化剂载体,Ru为催化剂活性组分,制备磁响应催化剂Ru/Fe3O4@mCeO2,通过X射线衍射(XRD)、傅里叶变换红外光谱(FT-IR)、X射线光电子能谱(XPS)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、N2低温物理吸附和电感耦合等离子发射光谱(ICP-AES)等手段,对Ru/Fe3O4@mCeO2的组成和结构进行分析,并以苯甲醇氧化为探针反应,探究Ru负载量、反应温度等条件对反应的影响,并考察催化剂的磁分离和循环使用情况。
2. 实验部分
2.1. 实验试剂与仪器
六水氯化铁,三氯化钌(阿拉丁试剂有限公司);乙二醇,乙醇,无水醋酸钠,聚乙二醇,氨水,浓盐酸,聚氧乙烯月桂醚(Brij),十六烷基磺酸钠(国药集团化学有限公司);十六烷基三甲基溴化铵(CTAB) (天津光复精细化工研究所);硝酸铈铵(上海展云化工有限公司);氧气(上海浦江特种气体有限公司)。
中国飞利浦公司Philips PW3040/60型粉末衍射仪;日本日立高科公司HITACHI S-4800型扫描电子显微镜;日本电子JEM-2100F型透射电子显微镜;美国尼高力公司NEXUS型智能傅里叶变换红外光谱仪;美国IRIS Intrepid ⅡXSP型号电感耦合等离子体原子发射光谱(ICP-AES);中国赛默飞世尔科技公司ESCLALAB250Xi型X射线光谱仪和中国Autosorb-I-MP型自动吸附比表面和孔隙度分析仪。
2.2. 催化剂的制备(图1)
2.2.1. Fe3O4磁性纳米粒子的制备
磁性Fe3O4纳米颗粒按如下溶剂热法制备 [18] :1.35 g FeCl3∙eC2O溶于40 ml乙二醇中,超声10 min再搅拌15 min至溶液呈橙红色澄清状;加入聚乙二醇(PEG, MW = 2000),超声40 min使之完全溶解;向上述溶液中加入无水NaAC 3.60 g,所得均匀橙红色悬浊液转移至反应釜,473 K下保温8 h,自然冷却至室温后,通过外加磁场分离出黑色固体产物,用乙醇和水多次洗涤,于333 K下真空干燥8 h,即得Fe3O4磁性纳米粒子。
2.2.2. 磁性载体Fe3O4@mCeO2的制备
一定量Fe3O4磁性纳米颗粒分散在0.1 M HNO3溶液中超声15 min,取出后用蒸馏水洗涤至中性;先将0.7 gBrij和0.05 g CTAB,后将Fe3O4超声分散于20 ml水加20 ml乙醇的混合溶液A中;0.5 g (NH4)Ce(NO3)6溶于20 ml水得到浅黄色溶液B;把溶液A与溶液B混合,搅拌30 min,逐滴加入氨水至pH = 9.0,在室温下继续搅拌5 h。离心分离出固体,用蒸馏水和乙醇多次洗涤,最后置于100 ml乙醇溶液中,323 K下索式提取24 h后,333 K真空干燥8 h。
2.2.3. 催化剂Ru/Fe3O4@mCeO2的制备
称取一定量Fe3O4@mCeO2磁性载体,分散到三氯化钌溶液中搅拌2 h,加入1 mol/l的NaOH溶液至pH = 13.0。继续搅拌12 h后过滤,所得固体以蒸馏水洗涤至中性,333 K下干燥8 h,573 K下H2气氛还原3 h,制得活化催化剂Ru/Fe3O4@mCeO2。
2.3. 催化氧化反应
苯甲醇氧化在装配回流冷凝管的常压浴式反应器中进行。取5 ml苯甲醇和100 mg催化剂置于25 ml
三颈烧瓶中混合。反应开始前O2由导气管通入反应液液面以下并以鼓泡方式进入烧瓶中。反应液温度通过油浴控制,温度波动为±1 K。反应7 h后,外加磁场分离催化剂,反应混和液在带有FID检测器的岛津GC-2014型气相色谱仪上分析,进样量为0.4 μl,采用内标法计算反应物的转化率及各产物选择性。
3. 结果与讨论
3.1. 催化剂表征
图2(a)为Fe3O4的XRD谱。30.2˚、35.5˚、36.8˚、43.2˚、53.5˚、57.2˚和62.7˚等处出现明显的(220)、(311)、(222)、(400)、(422)、(511)和(440)衍射峰,与Fe3O4标准谱图吻合,说明所测物质为Fe3O4且结晶度良好。图2(b)显示,包覆CeO2后,Fe3O4的衍射峰强度有所降低,28.6˚、33.1˚、47.6˚、56.5˚和59.3˚处出现CeO2的特征衍射峰。图2(c)表明,负载贵金属Ru以后,Fe3O4衍射峰强度进一步降低,在44。处出现弱而弥散的衍射峰,归属为六方相Ru的(101)晶面(PDF No. 070-0274)。根据Scherrer公式和严重宽化的衍射峰推断,所负载的Ru可能以小粒径的纳米颗粒形式存在。
Fe3O4、Fe3O4@mCeO2和3.3 wt% Ru/Fe3O4@mCeO2的FT-IR谱如图3(a)~(c)所示。图3(a)中,581 cm−1处有很强吸收峰,归属为Fe-O [19] 的伸缩振动。1000~1300 cm−1和3456 cm−1处出现较强峰,归属为O-H的伸缩振动,表明溶剂热法制备的Fe3O4颗粒表面含有丰富的-OH,这有利于Fe3O4颗粒在水中的分散和

Figure 1. The flowchart of catalysts prepared
图1. 催化剂的制备流程图

Figure 2. X-ray diffractograms of (a) Fe3O4, (b) Fe3O4@mCeO2 and (c) 3.3 wt% Ru/Fe3O4@mCeO2
图2. (a) Fe3O4,(b) Fe3O4@mCeO2和(c) 3.3wt% Ru/Fe3O4@mCeO2的XRD谱图
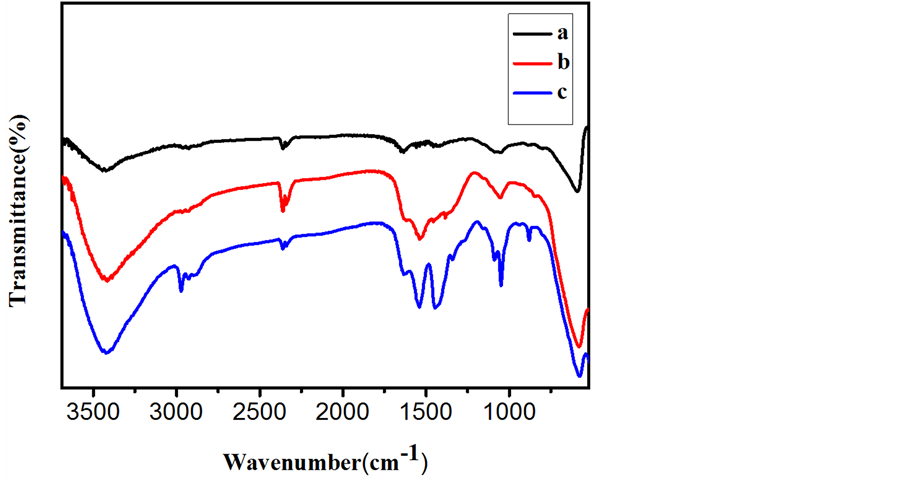
Figure 3. FT-IR spectra of (a) Fe3O4, (b) Fe3O4@mCeO2 and (c) 3.3 wt% Ru/Fe3O4@mCeO2
图3. (a) Fe3O4,(b) Fe3O4@mCeO2和(c) 3.3 wt%Ru/Fe3O4@mCeO2的红外谱图
后续包覆。图3(b)显示,Fe3O4被包覆后在1500 cm−1出现一个新峰,对应于Ce-O的伸缩振动,进一步证明包覆层为铈氧化物。催化剂负载后,未检测到Ru-Cl的振动吸收峰,表明RuCl3在H2还原时反应较为彻底。
Fe3O4、Fe3O4@mCeO2和3.3 wt%Ru/Fe3O4@mCeO2的N2低温物理吸附和孔径分布曲线分别如图3所示,测得的比表面积、平均孔径和孔容见表1。由图4和表1可知,通过添加模板剂的方法制备的CeO2,其比表面积达到195.41 m2/g,平均孔径为2.92 nm,迟滞环属于H4模型,表明CeO2中孔道以介孔为主。当把CeO2包覆到Fe3O4上以后,迟滞环为H3类型,比表面积减至125.57 m2/g,孔容略增,而平均孔径则显著增加至5.07 nm。这是由于利用溶剂热法制备的磁性Fe3O4核比表面积很小,而包覆层中可能存在CeO2颗粒沉积所造成的较大间隙或孔道。在CeO2包覆层上负载Ru以后,比表面积进一步降低至99.28 m2/g,孔容和平均孔径较Fe3O4@mCeO2减小,表明部分贵金属Ru可能已负载到包覆层介孔内。
图5显示Ru负载量为3.3 wt%的催化剂的XPS全谱和高分辨谱,高分辨谱通过XPS Peak Fit4.1分峰拟合,并以碳元素峰位进行矫正。图5(a)全谱揭示,所测样品含有Fe、Ce、O、Ru四种元素。图5(b)的Ru3d高分辨谱中,结合能284.1 eV和279.7 eV处出现的峰,分别对应于零价态Ru的3d3/2和3d5/2分裂峰。谱中未发现其它价态的Ru元素,证实活性组分负载时H2较彻底地把前驱体Ru3+还原成0价态。图5(c)为Ce的3d高分辨谱,结合能917.4 eV(a1)、908.5 eV(a2)、905.2 eV(a3)和901.7 eV(a4)处出现Ce的3d3/2分裂峰,结合能898.8 eV(β1)、889.9 eV(β2)、887.3 eV(β3)和883.1 eV(β4)处则为Ce的3d5/2分裂峰,其中,a1/b1、a2/b2和a4/b4均对应于Ce4+,a3/b3对应于Ce3+。Ce3+来源于制备过程中乙醇对部分Ce4+的还原,通过XPS半定量分析测得Ce3+含量约占Ce元素总含量的27.7%。图5(d)是O元素的分峰拟合图,结合能529.5 eV和531.5 eV分别对应于晶格氧和吸附氧,晶格氧主要来自Fe3O4和氧化铈,吸附氧主要为材料表面吸附的CO2和H2O。
图6为磁性纳米颗粒Fe3O4(a, b)、磁性纳米复合载体Fe3O4@mCeO2(c, d)以及3.3 wt% Ru/Fe3O4@mCeO2(e, f)

Table 1. BET surface area, pore volume and average pore size of mCeO2, Fe3O4@mCeO2 and 3.3wt% Ru/Fe3O4@mCeO2
表1. CeO2,Fe3O4@mCeO2,3.3wt% Ru/Fe3O4@mCeO2的比表面积,孔容,孔径分布图
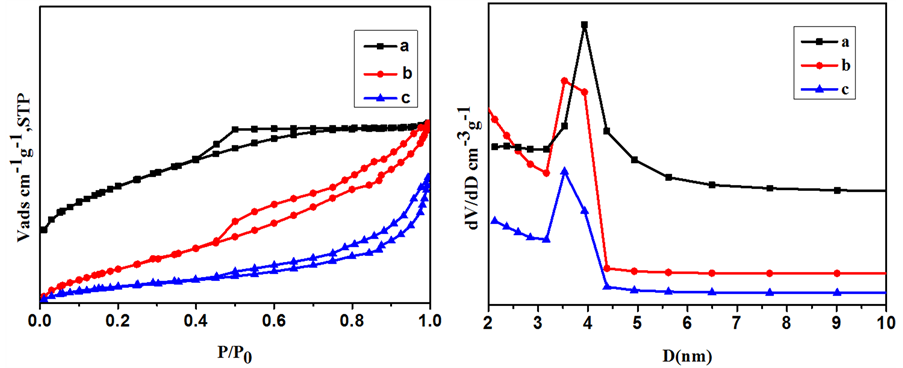
Figure 4. N2 adsorption-desorption isotherms and BJH measurements of (a) mCeO2, (b) Fe3O4@mCeO2 and (c) 3.3 wt% Ru/Fe3O4@CeO2
图4. (a) mCeO2,(b)Fe3O4@mCeO2和(c)3.3 wt% Ru/Fe3O4@mCeO2的N2低温物理吸附和孔径分布图
磁性催化剂的TEM图。由图6(a)与图6(b)可见,Fe3O4粒子呈椭球形且大小均一,粒径约为380 nm。图6(c)和图6(d)显示,Fe3O4颗粒包裹CeO2后粒径变化不大,包覆层厚度约为20 nm,由一系列细小的CeO2纳米颗粒聚集而成,颗粒间孔隙有可能使Fe3O4@mCeO2的孔容和平均孔径较单纯的CeO2增加,与N2吸附分析结果吻合。图5(d)的高分辨TEM图中,CeO2纳米粒子晶格间距为0.32nm,对应于CeO2(111)晶面。图6(e)和图6(f)显示,通过化学吸附法在磁性CeO2载体上负载的3.3 wt% Ru纳米颗粒,其粒径约为3.5 nm,晶格间距0.21 nm对应于暴露的一部分Ru(101)晶面。相关文献报道,Ru(101)晶面有利于吸附O2,从而促进苯甲醇催化氧化反应形成的氢分子从金属活性位上快速移除,释放活性位,使反应能够持续进行 [20] 。
利用SQUID磁强计测定了Fe3O4,Fe3O4@mCeO2和催化反应前后3.3 wt% Ru/Fe3O4@mCeO2纳米颗粒的磁性质。如图7所示,所有的磁滞回线都经过原点,表明样品都呈现超顺磁性。Fe3O4的饱和磁化强度值约为78.8 emu/g,当CeO2包覆到Fe3O4表面以后,该值下降到23.5 emu/g,这是由于CeO2包裹降低了材料中Fe3O4的质量比。进一步负载Ru后,3.3wt% Ru/Fe3O4@mCeO2催化剂的饱和磁化强度略有下降,但是依然满足在外部磁场下催化剂快速分离回收的要求。该催化剂在循环使用5次以后,饱和磁化强度几乎不变。
3.2. Ru/Fe3O4@mCeO2对苯甲醇氧化的催化作用
3.2.1. Ru负载量的影响
苯甲醇的转化率:
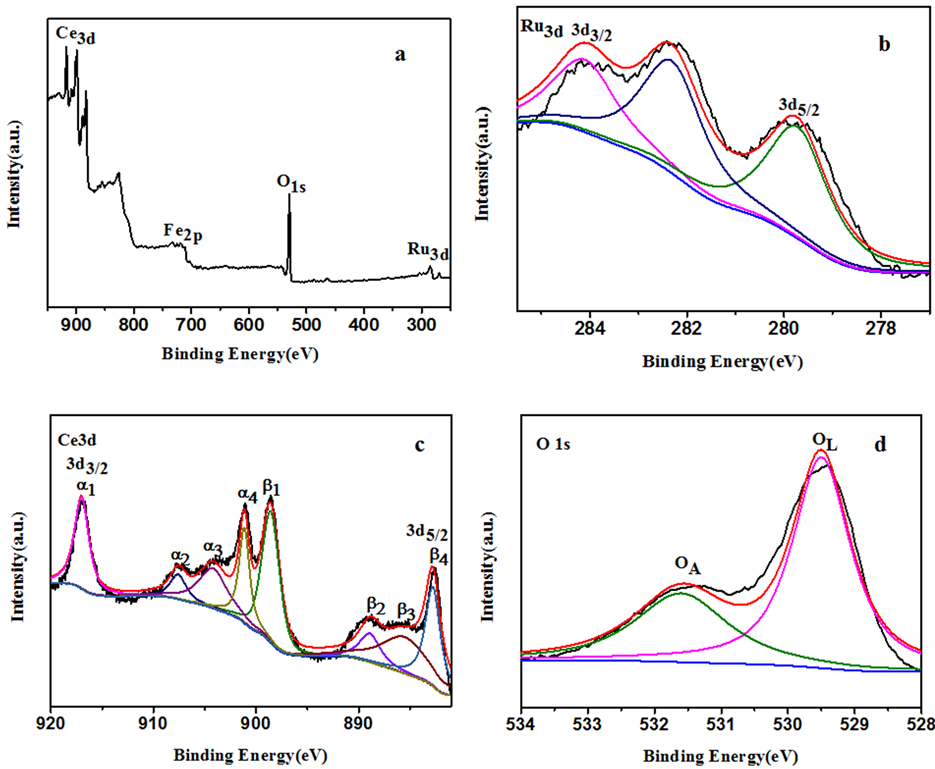
Figure 5. XPS spectra of the 3.3 wt% Ru/Fe3O4@mCeO2 microspheres catalyst: (a) full spectrum, (b) Ru3d, (c) Ce3d and (d) O 1s
图5. 3.3 wt% Ru/Fe3O4@mCeO2的XPS谱图:(a) 全谱图,(b) Ru3d谱图,(c) Ce3d谱图,(d) O 1s谱图


Figure 6. TEM and HR-TEM images of (a) (b) Fe3O4, (c) (d) Fe3O4@mCeO2 and (e) (f) 3.3wt%Ru/Fe3O4@mCeO2
图6. (a) (b) Fe3O4,(c) (d) Fe3O4@mCeO2和(e) (f) 3.3 wt% Ru/Fe3O4@mCeO2的TEM和HR-TEM图
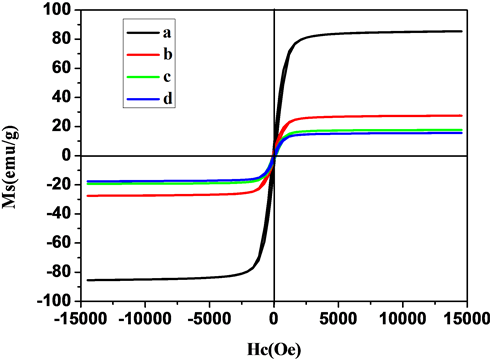
Figure 7. Magnetization curves of samples measured at 298 K: (a) Fe3O4, (b) Fe3O4@mCeO2, (c) 3.3 wt% Ru/Fe3O4@mCeO2 (before reaction) (d) 3.3 wt% Ru/Fe3O4@mCeO2 (after reaction)
图7. (a) Fe3O4,(b) Fe3O4@mCeO2,(c)催化反应前和(d)催化反应后3.3 wt%Ru/Fe3O4@mCeO2的磁化曲线
苯甲醛的选择性:
m0:反应物苯甲醇的量;m1:剩余的苯甲醇的量。
ms:产物苯甲醛的量;m2:生成所有产物所消耗的苯甲醇的量。
催化剂用量固定时Ru负载量对苯甲醇催化氧化反应的影响列于表2。随着负载量的逐步提升,苯甲醇的转化率逐步提高,苯甲醛的选择性呈现先增加后降低的趋势。当负载量为3.30%时,苯甲醇转化率和苯甲醛选择性分别为68.7%和84.7%,比速率值达到最高,表明此时Ru基催化剂利用率最高。
3.2.2. 催化剂用量的影响
表3是载Ru量为3.3 wt%时催化剂用量对苯甲醇无溶剂催化氧化的影响。由所测数据可知,随着催化剂用量的增加,苯甲醇的转化率逐渐提高,苯甲醛的选择性增加到85%左右并基本保持稳定,而比速率值出现先增后降的趋势。催化剂用量为0.10 g时比速率值最高(435.6 h−1),表明这时Ru的催化利用率最高。鉴于此我们初步确定催化剂的理想用量为0.10 g。
3.2.3. 反应温度对苯甲醇氧化反应的影响
温度对苯甲醇氧化反应有显著影响。表4结果显示,常压下当反应温度从293 K增加到393 K时,苯甲醇转化率逐步提升,苯甲醛选择性一直保持在80.8%~85.6%之间。反应温度增加至373 K后,苯甲醇转化率增速变缓,说明增加反应温度可以有效提高反应转化率,但反应温度过高时,目标产物的选择性反而降低,推测可能是副反应增多的结果。
3.2.4. 载体及催化剂的影响
如表5所示,为了进一步考察载体和催化剂对苯甲醇氧化反应的影响,我们比较了分别添加Fe3O4、Fe3O4@mCeO2和Ru/Fe3O4@mCeO2时苯甲醇的氧化反应。只添加Fe3O4时,未发现苯甲醇被氧化,表明磁核本身对苯甲醇氧化并无催化活性。添加包裹了CeO2的Fe3O4后,有少量苯甲醇氧化为苯甲醛,说明CeO2这种稀土金属氧化物对苯甲醇氧化有一定程度的催化作用,与CeO2对CO氧化的催化作用有相似之处。文献报道,CeO2通常含有大量的氧缺陷,故对CO氧化反应具有较好的催化活性 [21] 。当CeO2负载了Ru后,苯甲醇转化率提高到68.7%,苯甲醛选择性提升到84.7%,表明催化苯甲醇氧化的主要活性位是贵金属Ru,但CeO2与Ru之间可能形成一种催化协同作用。普遍认为,醇的催化氧化机理是氧化

Table 2. Ru content effect on oxidation of benzyl alcohol
表2. Ru负载量对苯甲醇氧化反应的影响
反应条件:苯甲醇量V = 5 ml,氧气流速Q = 20ml/min,反应温度T = 353K,催化剂质量m = 0.1 g,反应时间t = 7 h。

Table 3. The influence of catalyst amount for benzyl alcohol reaction
表3. 催化剂用量对苯甲醇氧化反应的影响
反应条件:苯甲醇量V = 5 ml,氧气流速Q = 20 ml/min,Ru负载量w = 3.30%,反应温度T = 353 K,反应时间t = 7 h。

Table 4. The influence of different temperature to benzyl alcohol oxidation
表4. 不同反应温度对苯甲醇氧化反应的影响
反应条件:苯甲醇量V = 5 ml,氧气流速Q = 20 ml/min,催化剂用量:0.1 g,Ru负载量:w = 3.3%,反应时间:t = 7 h。

Table 5. Support and catalyst effect on oxidation of benzyl alcohol
表5. 载体及催化剂对苯甲醇氧化反应性能的影响
反应条件:苯甲醇V = 5 ml,氧气流速:Q = 20 ml/min,Ru负载量:w = 3.30%,催化剂质量:m = 0.1 g,反应时间:t = 7 h。

Figure 8. Catalytic stability tests over 3.3 wt% Ru/Fe3O4@mCeO2; C: Conversion, S: Selectivity
图8. 3.3wt% Ru/Fe3O4@mCeO2催化剂的催化稳定性;C:转化率,S:选择性
脱氢,包括醇分子在纳米金属粒子活性位的脱氢和活性位的除氢再生。富含氧缺陷的CeO2壳层,除提高Ru纳米颗粒的稳定性,抑制其在高温氧化条件下的迁移和烧结外,更重要的是从Ru表面除氢,并可暂时储存反应产生的部分氢,使金属表面活性位获得较快再生,提高了催化剂的综合性能。
3.2.5. 催化剂在苯甲醇氧化反应中的循环稳定性
图8显示负载量为3.3 wt%的Ru/Fe3O4@mCeO2催化剂在苯甲醇氧化反应中的循环性能。催化剂在循环使用5次以后,苯甲醇转化率和苯甲醛选择性均无明显下降,表明催化剂具有较好的稳定性。
4. 结论
1) 制备了核壳结构的Ru/Fe3O4@mCeO2磁性催化剂,Fe3O4磁核的存在使得催化剂在液相体系中可快速分离。
2) 考察了Ru/Fe3O4@mCeO2对苯甲醇绿色氧化的催化作用,发现Ru负载量为3.3%时,苯甲醇转化率为68.7%,苯甲醛选择性为84.7%,催化剂利用率最高。重复使用5次以后,催化剂活性与选择性基本保持不变,具有较好的稳定性。
3) 通过对比考察载体及催化剂对苯甲醇氧化性能的影响发现,CeO2这种稀土金属氧化物因其含有大量的氧缺陷,在催化氧化苯甲醇时,载体与催化剂之间会存在一定的催化协同效应。
基金项目
国家自然科学基金支持项目,KYZKJY14133。