1. 引言
N,N-二烷基乙醇胺类化合物是重要的精细化工产品,广泛用于生产医药、涂料、表面活性剂等 [1] [2] ,也可作为脱碳、脱硫剂 [3] 等使用。常用的品种有N,N-二乙基乙醇胺、N,N-二丙基乙醇胺、N,N-二丁基乙醇胺等。近年来,关于它们的高效、清洁的合成工艺受到人们高度的重视。
N,N-二烷基乙醇胺类化合物合成方法可分为:仲胺的羟乙基化和乙醇胺的N-烷基化两大类。由于N,N-二烷基乙醇胺的合成研究工作进展总结并不多见,因此,本文分别对这两种常用的合成工艺及研究状况进行了分析总结。
2. 合成方法
2.1. 仲胺羟乙基化法
以仲胺为母体,对其氨基进行烷基化,可制备N,N-二烷基乙醇胺,根据所用的羟乙基化试剂的不同,分别总结如下。
2.1.1. 卤乙醇法
卤乙醇与仲胺反应可制备N,N-二烷基乙醇,反应式如下:

早在1943年,Hartman [4] 就用氯乙醇与二甲基胺反应制备N,N-二烷基乙醇胺,收率达60%~70%。氯乙醇是较廉价的羟乙基化试剂,当氯原子活性不足、反应温度太低时,可选溴乙醇或碘乙醇,但价格较高。
Zhao, Y.Q.等 [5] 以及Prasad等 [6] 分别以溴乙醇和碘乙醇为原料,在90℃下,与苯胺反应6 h后得到N-苯基乙醇胺,收率为89%。而Rad等 [7] 以咔唑和溴乙醇为原料,在室温下,以DMF为溶剂,加入氢氧化钠反应12 h得到88.7%产物的N-(2-羟乙基)咔唑。
卤乙醇与仲胺反应的副产物为卤化氢 [8] ,需要加入当量的碱作为缚酸剂除去,生成环境不友好的含盐废水。
2.1.2. 环氧乙烷法
环氧乙烷能与仲胺发生亲电加成反应生成N,N-二烷基乙醇胺,该法具有步骤少、原子利用率高、产物易分离、环境较友好等优点,适合工业化生产。反应式如下:

Headlee [9] 以环氧乙烷与二甲胺为原料,在100℃下,高压釜中反应1 h即可得到产物N,N-二甲基乙醇胺,收率为81%,少量水能促进此反应,但增加产物分离的难度。
陈爱民等 [2] 发明了一种N-取代乙醇胺的催化合成方法:仲胺和环氧乙烷在金属杂原子改性的MCM-41分子筛介孔催化剂作用下,反应温度为60℃~190℃、压力为1~3.5 MPa下反应40~100 min,原料转化率达90%以上。
Melder等 [10] 以水作为介质,在90℃~160℃、5~70 bar和5~35 wt%水,仲胺:环氧乙烷 = 1.2~10:1条件下,N,N-二烷基乙醇胺收率达80%以上。
2.1.3. 乙二醇法
仲胺也能与乙二醇反应,生成产物N,N-二烷基乙醇胺,反应式如下:

因乙二醇的活性较弱,此反应一般需要在金属催化剂作用和较高的反应温度下进行。乙二醇价格低廉,同时该反应的副产物仅为水,因此在原料成本与清洁生产方面有优势。
仲胺与乙二醇反应机理一般为“借氢机理” [11] (见图1)。首先,醇羟基上氢被转移至金属催化剂M表面,同时醇转换为更为活泼的醛(步骤a);随后,醛与胺发生胺化脱水反应,生成亚胺中间体(步骤b);之后,亚胺中间体从负载了转移氢的金属催化剂MH2上夺取活泼氢,被还原成饱和的目标产物,催化剂也得到再生(步骤c)。许多金属催化剂已被证明可用于催化醇与胺的胺化反应,如钯 [12] 、铂 [13] 、铱 [14] 等过渡金属。
Hamid等 [15] 详细研究了钌催化下醇与胺的反应,发现钌催化剂对于催化伯胺、仲胺的N-烷基化效果明显,当以乙醇胺和仲胺为原料时,产物收率为70%。反应式如下:
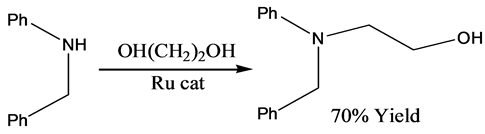
Andrushko等 [16] 制备了一种铱复合物催化剂,当反应温度为100℃~120℃时,仲胺能与二醇反应,收率大于96%,选择性达99%以上。
Marsella [17] 在研究仲胺与乙二醇反应时,制备了一种钌复合催化剂RuCl2(PPH3)3,并对反应条件进行了探究,发现在100℃~120℃下,以RuCl2(PPH3)3为催化剂时,原料转化率近100%,产物选择性在79%~91%。
2.2. 乙醇胺的N-烷基化
以乙醇胺为母体,经氨基的N-烷基化合成目标产物。常用N-烷基化方法总结如下。
2.2.1. 羰基的还原N-烷基化
伯胺或仲胺可以与醛、酮发生还原胺化反应(见图2)。还原胺化反应历程为 [18] :1) 醛、酮与胺发生加成反应生成氨基醇化合物;2) 氨基醇化合物随后脱水形成亚胺中间体(希夫碱);3) 亚胺通过加氢反应得到产物,反应关键步骤是亚胺中间体的生成。根据加氢步骤不同,又可分为(1)催化加氢烷基化和(2)化学还原烷基化(还原剂有金属氢化物、甲酸等)。
1) 催化加氢烷基化
催化加氢法是氢气在过渡金属等催化下还原亚胺中间体,使之转化为产物。
过渡金属催化剂催化加氢优点在于产物收率较高,且副产物仅为水。此法适合工业大规模生产,但缺点是金属催化剂价格较高,同时高压操作对设备要求较高。有时,当原料含有如碳碳双键、氰基等不饱和键时,也会被还原,导致选择性降低。
Istvan等 [19] 发明了一种合成低级N,N-二烷基乙醇胺的方法,以钯、铂、铑等过渡金属为催化剂,氢气作为还原剂,低级醛(C ≤ 4)与乙醇胺在醇溶剂中制成N,N-二烷基乙醇胺,在高压(≥40 bar)的管式反应器中进行,产物收率在90%以上。
葛新等 [20] 研究了在RANEY Ni催化下,甲醛与胺发生胺化还原反应,在115℃、1.6 MPa条件下,发生N-甲基化反应生成N,N-二甲基乙醇胺,反应四小时收率可达90%。反应式如下:

金属络合物催化剂由过渡金属和配体络合而成,其优点在于可使用氢源试剂代替氢气,在常压下即可实现催化加氢,同时具有原料转化率和产品选择性高的选点。但均相金属络合物催化剂存在难回收、重复利用率低、后处理较复杂等问题。
Clerici等 [21] 发现仲胺在TiCl3/t-BuOOH作用下,与醛和甲醇缩合完成N-羟乙基化,并可采用“一锅法”在较温和条件下制得N,N-二烷基乙醇胺。反应式如下:

2) 化学还原烷基化
金属氢化物、甲酸、硼烷等还原剂也可对亚胺还原步骤进行还原,从而得到目标产物。
常用的金属氢化物有NaBH4 [22] ,LiAlH4,NaBH3CN [23] 等。它们的还原特点是反应过程简单且条件温和,产物收率高,由于价格高,常用于实验室制备中,较少用于工业生产。加入Lewis酸或Brönsted酸与NaBH4形成的还原体系如NaBH4-ZnCl2,NaBH4-NiCl2体系等,催化活性和选择性都得到提高。这是因为加入酸或者助剂不仅能加快亚胺的生成还同时能提高亚胺的反应活性,进而提高反应选择性。
Sundaravel等 [24] 以乙醇胺(1eq)和吡啶-2-甲醛(2eq)为原料,THF为溶剂,待加成反应结束后,加入NaBH(OAc)3(2eq)和冰醋酸,合成2-(N,N-二(2-吡啶基甲基)氨基)乙醇的收率达85%。
甲酸也可以作为还原氢的供体,此反应被称为Leuckart-Wallach反应。反应式如下:

Kaluszyner等 [25] 研究了在甲酸催化下,乙醇胺与甲醛的甲基化反应,在反应物料比乙醇胺:甲醛:甲酸 = 1:5:5下,回流反应5 h,N,N-二甲基乙醇胺收率达90%~95%。
甲酸催化优点在于来源广,价格便宜,副产物仅为水和二氧化碳,但有些系统的产物选择性较差 [26] 。此工艺在工业上有所应用,有时酸性条件对反应不利,常用三乙胺调节反应系统的pH值。甲酸也常用于转移氢化反应,常调节系统的碱性以改善反应效果。
2.2.2. 卤代烃取代法
乙醇胺与卤代烃能反应生成 N,N-二烷基乙醇胺。反应式如下:

此合成路线操作简单,可采用廉价的氯烷作为烷化剂,当氯烷烃活性不足时,采用溴代烃来提高产物产率。然而,由于乙醇胺与卤代烃反应是不可逆的连串反应,在获得目标产物的同时,会有多烷基化产物生成,不仅降低产率,还增加了分离难度,同时,该方法的副产物HX对环境不友好,还需要加入当量碱中和,提高了生产成本。
殷慧清等 [27] 发现在CuCl催化下,芳卤与醇胺能在温和的实验条件下反应,并取得了很高的收率,芳卤反应活性为碘苯 > 溴苯 > 氯苯。在10 mol% CuCl/2eq KOH催化下,碘苯与乙醇胺在室温下反应即可获得99%收率;溴苯反应活性不及碘苯,当反应温度升至90℃和相同催化剂条件下,产品收率也可达到99%。
2.2.3. 脂肪醇烷基化
脂肪醇与乙醇胺也可在固体酸催化剂,如纳米沸石、Al-MCM-41分子筛等 [28] 催化下可发生亲核取代反应可以制得N,N-二烷基乙醇胺化合物。反应式如下:

该工艺的反应原料脂肪醇廉价易得,同时由于仅有水为副产物,相对于卤代烃的合成路线,该法绿色环保,是合成N,N-二烷基乙醇胺化合物的绿色化发展方向之一。
陈爱民 [3] 制备了一种Cs-B-Zr多功能固体酸催化剂,并对乙醇胺与低级脂肪醇、芳香醇进行了实验探究。实验表明,此催化剂对低级脂肪醇(C ≤ 5)均有良好的催化效果,转化率和选择性均在90%以上。对于甲醇与乙醇胺的N-烷化反应,在220℃、4.3 MPa条件下,反应转化率可达93%,当反应温度高于550℃时,该催化剂活性快速下降。
Oku等 [29] 探讨了超临界甲醇与乙醇胺在Cs-P-Si三组分固相催化剂催化下烷基化反应,在300℃,8.2 Mpa,乙醇胺:甲醇 = 1:10.8条件下的固定床反应器中反应,产物收率可达86%,选择性达94%。
2.3. 其他N-烷化反应
杨玉峰 [30] 以乙醇胺和硫酸二甲酯,在常温常压下反应生成N,N-二甲基乙醇胺,并对反应条件进行了优化实验,发现在硫酸二甲酯:乙醇胺 = 2.2:1,反应温度80℃,溶液pH = 9.5,反应时间3.5 h条件下,产物收率达95%。
Sun W. M.等 [31] 研究了以聚苯乙烯磺酰氯树脂作为载体,二醇以及N, N-二烷基胺反应生成烷基醇胺类化合物的固相有机合成路线。二醇与二甲胺反应的转化率达80%。固相合成具有后处理简单、催化剂重复性好等优点,但该方法目前主要用于小规模的实验室制备,应用于实际生产过程,还需要做大量的改进与优化工作。
3. 结论
本文介绍和总结了 N,N-二烷基乙醇胺化合物现有合成工艺与特点,其主要合成方法有:仲胺的羟乙基化和乙醇胺的 N-烷基化,对相关工艺的评价总结于表1。相比较而言,以环氧乙烷为原料合成N,N-二烷基乙醇胺在工业上应用较为广泛,但同时也存在一些问题,如原料较贵,生成危险系数较高等;而

Table 1. Summary of synthetic process of N,N-dialkylethanolamine
表1. N,N-二烷基乙醇胺的合成工艺特点总结
脂肪醇N-烷基化方法由于原料来源广、工艺简单和绿色环保等优点,在合适的催化剂作用下,即可代替环氧乙烷法,用于制备N,N-二烷基乙醇胺,是合成N,N-二烷基乙醇胺化合物的绿色化发展方向之一。
鉴于N,N-二烷基乙醇胺是一类重要的精细化工中间体,随着化学研究的不断深入,未来化工工艺必定向着绿色、高效的方向发展。合理地利用直接或间接的N-烷化方法来制取N,N-二烷基乙醇胺,在保证高选择性、高收率前提下,发展绿色经济的合成路线将会为该类化合物的进一步应用奠定重要基础。
基金项目
四川省省级科技计划项目(2016GZ0382);四川省预算内基本建设投资计划“有机胺功能材料工程实验室”。
*通讯作者。