1. 引言
随着社会的飞速发展,能源问题已成为人们面临的首要问题,随着不可再生能源的持续消耗,清洁、可再生的新型能源渐渐成为了人们关注的焦点 [1] 。氢能由于利用率高、储运方便和来源广泛等特点为解决能源危机提供了希望。而太阳能取之不尽,用之不竭,利用半导体进行光催化分解水制氢成为可行的制氢方法,为人们利用氢能提供了一种有效的途径 [2] 。
Bi2S3纳米材料是一种重要的半导体,拥有良好的光氧化和还原能力,以及优异的光催化性能 [3] 。由于良好的形貌和晶体结构,合适的禁带宽度以及卓越的化学稳定性使其在催化方面应用广泛,是一种非常有潜质的催化材料,尤其是在光催化析氢领域得到很多研究 [4] 。然而Bi2S3本身的一些缺陷限制了其发展,单一半导体在光催化过程中存在非常严重的电子和空穴再复合的问题,往往会使得量子产量比较低,很难得到稳定良好的光催化析氢性能 [5] [6] 。通过对半导体进行改性是提高其光催化性能的有效方法 [7] 。WO3的禁带宽度约为2.7 eV [8] ,因为其优异的性能,近几年来受到广泛关注,通过WO3与Bi2S3复合对Bi2S3进行改性,可以促进光生电子和空穴的分离,从而提高材料的光催化性能。
本文针对目前Bi2S3半导体的研究现状,聚焦于Bi2S3半导体的复合改性研究,采用水热法制备Bi2S3-WO3复合材料,并对其光催化析氢性能进行研究。
2. 实验
2.1. 主要试剂
五水合硝酸铋(Bi(NO3)3∙5H2O,分析纯)、硫代乙酰胺(CH3CSNH2,分析纯)、二水合钨酸钠(Na2WO4∙2H2O,分析纯)、氯化钠(NaCl,分析纯)、盐酸(HCl,37%,分析纯)、无水乙醇(C2H5OH,分析纯)、去离子水(H2O,自制)等。
2.2. 实验
2.2.1. Bi2S3纳米材料的制备
水热法制备Bi2S3半导体纳米材料的一般流程 [9] :称取0.3600 g五水合硝酸铋,加入到60 ml去离子水中,搅拌至完全溶解,然后称取0.1800 g硫代乙酰胺加入到溶液中,放入到超声清洗仪器中超声处理5 min,得到红棕色溶液,继续搅拌10 min后,转移并密封到100 ml反应釜中,使用烘箱在200℃的条件下水热反应24 h。反应结束自然冷却至室温,将反应产物转移至50 ml离心管中,加入适量的去离子水和乙醇,使用高速离心机8000 rpm/min离心10 min,并在离心、洗涤3次后将沉淀产物在70℃的烘箱中恒温干燥6 h。
2.2.2. WO3纳米材料的制备
水热法制备WO3半导体纳米材料的一般流程 [10] :称取0.5500 g的二水合钨酸钠,加入到50 ml的去离子水中,搅拌至完全溶解,称取0.1933 g氯化钠溶解到溶液中,持续搅拌10 min直至溶液变为澄清无色液体,随后将1 M的稀盐酸缓缓滴加到溶液中,直至溶液的pH变为2.0。将溶液转移并密封到100 ml反应釜中,使用烘箱在180℃的条件下水热反应24 h。反应结束后自然冷却至室温,将反应产物转移至50 ml的离心管中,加入适量的去离子水和乙醇,使用高速离心机8000 rpm/min离心10 min,并在离心、洗涤3次后将得到的沉淀产物在60℃的烘箱中恒温干燥6 h。
2.2.3. Bi2S3-WO3纳米材料的制备
本实验以Bi2S3为基底进行WO3的半导体复合。以WO3摩尔含量为90%的样品为例(表1),称取0.8661 g的二水合钨酸钠,加入到50 ml的去离子水中,搅拌至完全溶解,然后将0.3044 g的氯化钠加入到溶液中,持续搅拌至溶液变为澄清无色液体,然后将事先制备的0.1500 g Bi2S3加入到溶液中,继续搅拌10 min使其混合均匀。随后实验操作与水热法制备WO3半导体相同。通过调节原料配比,得到WO3摩尔含量占总摩尔含量10%到90%的Bi2S3-WO3复合物。
2.3. 实验表征
使用Bruker D8 Advance X射线衍射仪进行X-射线衍射表征,CuKα辐射,扫描范围2θ = 10˚~70˚,扫描速率为4˚/min。使用JEM 1200透射电子显微镜进行形貌表征,加速电压为100 kV。
2.4. 光催化析氢性能测试
利用CEL-SPH2N-S9双反全自动光催化制氢系统进行光催化析氢性能的测试。光化学反应仪主要由光催化反应器、气相色谱分析仪和全自动控制器组成,其中反应器部分采用300 W的氙灯作为可见光光源,并配有直径12 cm的石英玻璃盖,控制部分采用软件进行全自动控制。

Table 1. The raw material dosage during Bi2S3-WO3 composites synthesis
表1. Bi2S3-WO3复合材料合成的原料配比
在进行光催化析氢测试时选用无水亚硫酸钠和九水硫化钠作为牺牲试剂,首先在反应器中加入100 ml的去离子水,并将3.5 g的无水亚硫酸钠和8.4 g的九水硫化钠加入到反应器中,通过磁力搅拌器对溶液进行搅拌,使牺牲试剂充分溶解,然后加入25 mg光催化剂,在整个反应过程中对液体进行持续搅拌,使样品在溶液中保持悬浮状态,反应器的器口与光源间距为5 cm。
2.5. 光催化析氢稳定性测试
将光催化析氢反应6 h后的样品进行离心、洗涤,并在60℃的烘箱中恒温干燥6 h。称量干燥后的样品,加入同种样品直至反应样品质量为25 mg,并将称取好的样品进行光催化析氢性能的测试,重复上述操作步骤3次,在实验测试过程中其他试剂用量和测试条件保持一致。
3. 实验结果分析
图1为采用水热法合成的Bi2S3、WO3和不同比例的Bi2S3-WO3复合样品的XRD谱图。从图中可以看出Bi2S3样品与标准图谱相对应,图中显示在2θ为15.8˚、17.6˚、22.4˚、23.7˚、25.1˚、27.4˚、28.6˚、31.8˚、46.6˚和52.7˚的衍射峰与辉铋矿斜方晶系的Bi2S3 (JCPDS:17-0320)相对应,产物的主要衍射峰比较尖锐,并且谱图中没有明显的杂峰,表明制备得到了纯的Bi2S3样品。图1中WO3的衍射峰与JCPDS:33-1387相一致,衍射峰清晰且没有杂峰,表明生成了纯的WO3样品,样品属于六方晶系。从图1复合样品的衍射峰可以看出,复合产物表现出相似的XRD谱图,并且复合物的衍射峰均可以在Bi2S3 (JCPDS:17-0320)和WO3 (JCPDS:33-1387)中找到。谱图中,复合产物的衍射峰比较清晰,没有多余的杂峰,产物结晶性良好,表明合成的样品均由Bi2S3和WO3这两种半导体所组成。
图2为水热合成的Bi2S3、WO3以及不同比例的Bi2S3-WO3复合样品的TEM照片。图2(a)为Bi2S3样品的照片,可以看出样品为棒状结构,纳米棒的直径约为20~50 nm,长度约为400~700 nm,产物的形貌均一,结构比较规则,并且直径波动范围较小,产物整体分布较为均匀。图2(b)为WO3样品的照片,可以看出WO3为棒状结构,形貌清晰且表面光滑,长度均在几微米左右,直径约90~100 nm,样品具有良好的分散性。图2中复合的Bi2S3-WO3的TEM照片显示,复合产物由两种棒状结构的材料组成,结合XRD分析这些棒状的结构为Bi2S3和WO3。在图中,比较长且直径较小的为Bi2S3半导体,较短且直径较大的为WO3半导体,这些棒状结构分散杂乱,Bi2S3和WO3彼此交叉重叠,一般在Bi2S3棒的周围交织生长着大量的WO3棒,这种相互支撑的结构增加了半导体的接触面积,为提高光催化析氢性能提供了可能。
XRD和TEM表征证明本实验成功制得了Bi2S3-WO3纳米半导体复合材料。
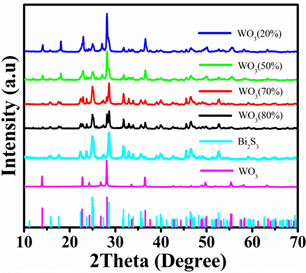
Figure 1. XRD patterns of Bi2S3-WO3 nanocomposites
图1. Bi2S3-WO3纳米复合材料的XRD图谱
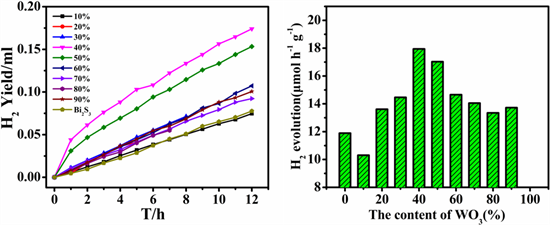
图3(a)为Bi2S3-WO3纳米半导体复合材料的光催化析氢曲线图,从图中可以看出,样品的光催化析氢性能比较稳定,且在光催化析氢10 h后仍然能够分解水产生氢气。复合样品Bi2S3-WO3(40%)和Bi2S3-WO3(50%)的光催化析氢曲线位于其他样品曲线的上方,其光催化析氢性能要高于其他比例的样品和Bi2S3半导体。图3(b)为根据图3(a)计算的样品光催化析氢速率图,从图中可以看出,Bi2S3表现出较低的光催化析氢性能,随着复合物中WO3含量的不断增加,Bi2S3-WO3的光催化析氢性能先提高后降低,在WO3的摩尔含量为40%的时候达到最大值,为17.95 μmol∙h−1g−1,这一光催化析氢速率约为纯Bi2S3的1.5倍。导致这一结果的原因可能为当WO3含量较低时,随着含量的增加,WO3与Bi2S3的接触面积变大,电子传输的效率提高,提高了光生载流子的分离效率,从而光催化析氢性能有所提高;但随着WO3的含量继续变大时,由于WO3材料的不透明性,阻碍了Bi2S3对光的吸收,反而减弱了复合样品的光催化性能。
图4为Bi2S3-WO3 (40%) 半导体复合材料的光催化析氢循环测试曲线,可以看出,半导体的光催化析氢性能较为稳定,随着循环次数的增加,样品的光催化效率逐渐降低,在进行4次循环后其光催化分解水的产氢量由36.04 μmol∙g−1降到了32.05 μmol∙g−1,光催化效率只降低了约11.1%,复合材料表现出较好的光催化析氢稳定性。

Figure 2. TEM images of Bi2S3-WO3 nanocomposites. (a) Bi2S3; (b) WO3; (c) Bi2S3-WO3 (20%); (d) Bi2S3-WO3 (40%); (e) Bi2S3-WO3 (70%); (f) Bi2S3-WO3 (80%)
图2. Bi2S3-WO3纳米复合材料的TEM照片。(a) Bi2S3; (b) WO3; (c) Bi2S3-WO3 (20%); (d) Bi2S3-WO3 (40%); (e) Bi2S3-WO3 (70%); (f) Bi2S3-WO3 (80%)
 (a) (b)
(a) (b)
Figure 3. (a) Photocatalytic H2 evolution over the Bi2S3-WO3 nanocomposites; (b) Dependence of the rate of H2 evolution upon the content of WO3 in the composite
图3. (a) Bi2S3-WO3纳米复合材料的光催化析氢性能图;(b) 复合材料中WO3的含量与光催化析氢速率的关系图
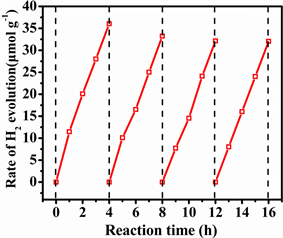
Figure 4. Cycling runs for the photocatalytic hydrogen evolution over the Bi2S3-WO3 (40%) nanocomposite
图4. Bi2S3-WO3(40%) 纳米复合材料的光催化析氢循环测试曲线
4. 结论
通过WO3与Bi2S3复合对Bi2S3进行改性,采用水热法制备了Bi2S3-WO3纳米半导体复合材料,并对样品的组成、形貌和光催化析氢性能进行了研究。结果表明:制备的Bi2S3和WO3半导体具有良好的结晶性,呈棒状,形貌比较规则,复合产物由这两种半导体组成,Bi2S3纳米棒和WO3纳米棒彼此交叉重叠。复合材料具有较强的光催化析氢性能,当WO3的摩尔含量为40%时析氢效率可达到17.951 μmol∙h−1g−1,约为纯Bi2S3的1.5倍,样品表现出较好的光催化析氢稳定性,4次循环后光催化效率只降低了约11.1%。