1. 引言
具有光学活性的手性醇是合成许多天然产物和药物的重要医药中间体 [1] [2] [3],如1-苯基-1-丙醇是一种利胆药能促进胆汁的分泌,有利消化,增加食欲,排除结石,降低胆固醇,适用于胆囊炎,胆道感染,胆结石,胆道术后综合症,高胆固醇血症 [4] [5]。传统的制备法是从消旋的芳香醇经多级拆分得到,该方法不仅步骤繁琐,且浪费试剂。另外,也可以直接通过芳香酮的不对称氢转移氢化,一步合成单一对映体的芳香醇,较前者这种方法简化了生产步骤,节省成本,具有很大的经济效益。
除此之外,由手性催化剂催化的二乙基锌对醛的不对称加成反应也是合成手性醇的重要方法 [6] [7] [8]。该方法的关键就是设计和合成具有高效催化活性的手性配体和手性催化剂 [9] [10] [11]。近年来人们设计并合成许多高效的手性配体来催化该类反应。1989年日本东京大学Yoshioka [12] 课题组首次报道了金属锌钛与环己二胺磺酸络合物催化的二乙基锌对苯甲醛的不对称乙基化反应。该催化体系催化的炔基锌对苯甲醛的加成反应能以优秀的收率和对映选择性得到1-苯基-1-丙醇。接着很多催化体系被应用于此类加成反应,1997年美国麻省理工大学Fu [13] 课题组报道了由含二茂铁结构的手性醇催化的二乙基锌对醛的加成;1999年Seebach [14] 课题组采用自主装固载手性配体与Ti(OiPr)2Cl2作用得到相应的固载催化剂(PTADDOL-Ti),并用该催化剂催化二乙基锌对苯甲醛的加成反应,得到几乎定量的产率和优秀的对映选择性,值得一提的是该固载催化剂在重复使用二十次后,催化该反应所得产物的对映选择性几乎不变;1999年美国俄亥俄州立大学Paquette [15] 课题组报道了由苯并双桥环磺酰胺配体催化的二乙基锌对醛的加成反应,该反应在手性配体与Ti(O-iPr)4作用得到相应的催化剂。2001年Schinnerl [16] 将手性噁唑啉配体应用于二乙基锌对苯甲醛的加成反应之中,获得了优秀的催化效果。2003年Yus [17] 课题组将1,3-二苄胺和樟脑磺酸手性醇的双磺酰胺配体应用于二乙基锌对酮的加成反应。2004年Rozenberg [18] 合成了系列面手性Salen配体,并用该配体催化二乙基锌对苯甲醛的加成。鉴于L-脯氨酸是天然的廉价的手性源,我们课题组尝试由L-脯氨酸衍生一系列手性硫脲氢键催化剂,并首次应用于二乙基锌对醛的不对称加成烷基化反应,目前以良好的收率和中等的对映选择性得到1-苯基-1-丙醇化合物(图1)。
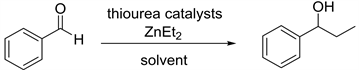
Figure 1. 1,2-Addition reation of diethylzinc to benzaldehyde
图1. 二乙基锌对苯甲醛的1,2-加成反应
2. 实验部分
2.1. 仪器与试剂
本实验操作是首先对反应瓶进行充分干燥后,然后充入氮气再分别加入反应物进行反应。合成催化剂以及催化反应所涉及的溶剂,例如甲苯、四氢呋喃、乙醚、二氯甲烷、正己烷均按照试剂手册处理的方法进行标准干燥处理后使用 [19]。
本实验合成的催化剂1H NMR、13C NMR波谱的鉴定是采用美国瓦里安公司的UNITY INOVA 400型400 MHz和NMRststem型300 MHz核磁共振谱仪在上测定,使用CDCl3或者d6-DMSO作为溶剂。对映体过量通过Waters 1525型HPLC测定;比旋光在美国鲁道夫公司的Autopol型旋光仪上测定。质谱是使用Micromass公司的TOF-MS型EI电离源高分辨质谱仪或者美国瓦里安公司的Saturan2200型离子阱质量检测器LC-MS测定。
2.2. 实验方法
反应管经过烘箱加热,在双排管氩气置换条件下,加入L-脯氨酸衍生的硫脲催化剂1 (0.02 mmol),然后反复置换氮气数次,再加入正己烷(0.2 mL)溶解手性催化剂,然后将上述溶液降温至0℃并缓慢逐滴加入加成烷基化试剂Et2Zn (0.8 mL, 0.8 mmol, 1.0 M正己烷溶液),氩气氛围中加入苯甲醛(0.2 mmol),搅拌半小时后,反应温度逐渐升至室温,室温条件下搅拌约24小时,TLC检测原料基本消失,加入2 mL水淬灭该反应,加入乙酸乙酯萃取反应液 (10 mL × 3),合并上层有机相,使用无水Na2SO4干燥,旋蒸浓缩反应液后硅胶柱层析分离产品(流动相PE/EA = 30/1),得到无色油状产物。
3. 结果与讨论
3.1. 反应条件的优化与筛选
3.1.1. 反应媒介的筛选
我们首先对空白反应进行了考察,也就是在不加入任何手性催化剂条件下,对二乙基锌和苯甲醛两反应底物的反应进行试验。我们发现无催化剂加入条件下,以正己烷为溶剂常温下反应一天,仅能以10%的产率得到目标化合物1-苯基-1-丙醇(表1中6)。在其它的反应条件不变的情况下,我们使用苯基取代的L-脯氨醇硫脲1h作为催化剂,发现能以80%的产率和32%的对映选择性得到目标产物(表1中4)。由于反应媒介对反应的活性和立体选择性有很大的影响,因此我们对反应的溶剂进行了考察(表1)。经过对反应溶剂的初步筛选,我们发现正己烷作反应溶剂时的催化结果是最好的,其它的有机溶剂如甲苯、四氢呋喃、乙醚、二氯甲烷均不如正己烷理想。然而当使用钠丝处理过的无水四氢呋喃作为反应溶剂时,该反应催化活性是最高的,能以84%的产率得到最终产物1-苯基-1-丙醇。值得注意的是,它的对映选择性却与二氯甲烷、正己烷、乙醚等其他溶剂的对映选择性是相反的,原因可能是在反应过程中四氢呋喃与催化剂或者反应中间体作用,导致产物的对映选择性发生了改变(表1中2)。
3.1.2. 反应条件的筛选
我们以正己烷为反应溶剂,以苯基取代的L-脯氨醇硫脲1h作为催化剂,然后对反应中的烷基化加成底物二乙基锌的用量进行了筛选(表2)。二乙基锌用量从一当量到八当量,在筛选过程中,我们观察到当二乙基锌使用量是苯甲醛底物使用量的四当量时,该反应的催化结果是最好的,反应以82%产率和33%对映选择性得到产物(表2中4)。继续增加底物烷基化加成试剂二乙基锌用量时,该反应的催化活性没有发生明显变化,反应的对映选择性也没有增加(表2中5和6)。

Table 1. Screening of different solvents a
表1. 对反应溶剂进行的筛选a
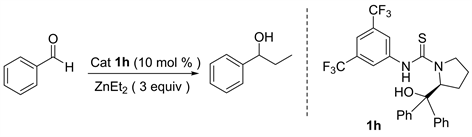
a催化剂1h (0.02 mmol, 10 mol %),二乙基锌(0.8 mmol),苯甲醛(0.20 mmol),正己烷(0.4 mL),室温下搅拌24小时。b分离产率。c手性HPLC检测。d相反的对映异构体。e没有加催化剂。

Table 2. Screening of the amount of ZnEt2 a
表2. 对二乙基锌用量进行的筛选a
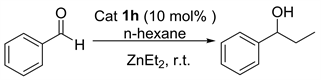
a催化剂1h (0.02 mmol, 10 mol %)、二乙基锌、苯甲醛 (0.20 mmol)、正己烷(0.4 mL) 室温下搅拌24小时。b分离产率。c手性HPLC检测。
我们以10 mol %的L-脯氨醇硫脲1h作为催化剂,正己烷为反应溶剂,反应底物二乙基锌和苯甲醛的用量比为四当量的前提条件下,继续考察底物的浓度对反应结果的影响(表3)。我们通过改变溶剂正己烷的用量来调整底物浓度,发现当正己烷用量为0.2毫升,也就是底物浓度是0.2 M时催化效果比较好能以85%的产率和33%的对映选择性得到目标产物(表3中1)。继续降低底物的浓度时,反应的对映选择性和产率都会随之降低(表3中2~4)。

Table 3. Screening of substrate concentrations a
表3. 对反应底物浓度进行的筛选a
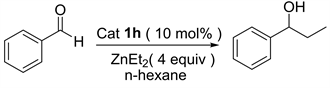
a催化剂1 (0.02 mmol,10 mol %)、二乙基锌(0.8 mmol)、苯甲醛(0.20 mmol)、正己烷(0.2~0.8 mL),室温下搅拌24小时。b分离产率。c手性HPLC检测。
我们以10 mol %的催化剂用量,正己烷为反应溶剂,反应底物二乙基锌和苯甲醛的用量比为四当量的反应条件下,然后对我们课题组现有的其它手性骨架的硫脲催化剂进行了考察(图2)。(1R,2S)-2-氨基-1,2-二苯基乙醇骨架的硫脲最高能以52%的产率和7%的对映选择性得到目标产物。茚胺醇和金鸡纳碱骨架的硫脲催化产物的对映选择性更低,几乎是消旋的产物。总之,其它骨架的硫脲催化的对映选择性都没有L-脯氨酸衍生的硫脲催化效果好。
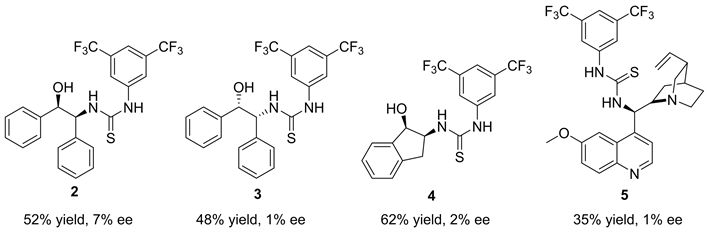 a催化剂2~5 (0.02 mmol, 10 mol %)、二乙基锌(0.8 mmol)、苯甲醛(0.20 mmol)、正己烷(0.2 mL),室温下搅拌24小时。b手性HPLC检测。c相反的对映异构体。
a催化剂2~5 (0.02 mmol, 10 mol %)、二乙基锌(0.8 mmol)、苯甲醛(0.20 mmol)、正己烷(0.2 mL),室温下搅拌24小时。b手性HPLC检测。c相反的对映异构体。
Figure 2. Screening of different chiral catalystsa
图2. 对不同手性骨架的催化剂进行初步考察a
3.1.3. L-脯氨酸衍生的硫脲催化剂的进一步考察
我们以正己烷为反应溶剂,反应底物二乙基锌和苯甲醛的用量比为四当量,底物苯甲醛的浓度为0.2 M和10 mol %的催化剂用量条件下,对L-脯氨酸衍生的硫脲催化剂苯环上取代基的电子效应和空间位阻进行了细致的考察。首先,我们想通过增加苯环上取代基的体积来影响产物的对映选择性,但是,当取代基为大位阻的3,5-二苯基苯基(1a)和2-萘基(1g)取代基时,该催化反应的反应活性没有降低,但是对映选择性反而大幅度降低,分别为11%ee和15%ee (表4中1和7)。然后,我们考察了取代基的电子效应,发现1f中吸电子基团3,5-双三氟甲基苯基作为取代基时,反应仅能以26%的产率和26%的对映选择性得到最终产物1-苯基-1-丙醇(表4中6)。然后我们设想,能否可以通过降低苯环取代基的体积来提高反应的立体选择性呢?于是我们合成了二乙基催化剂1b和3,5-双甲基苯基催化剂1d,并立即应用于催化该烷基化加成反应,我们观察到降低取代基体积,仍然没能达到提高该反应对映选择性的目的,其对映选择性仅有8%和25% (表4中2和4)。然后我们将催化剂1h的羟基经过三甲基硅基一步保护后,就方便转变成催化剂1e,然后将该催化剂应用于催化该反应。令我们高兴地是,我们发现该催化剂在不影响反应活性的情况下,反应产物的产率为88%,反应的对映选择性从30%提高到45% (表4中5)。然后我们进一步研究了该类L-脯氨酸衍生的硫脲催化剂骨架上的羟基部分对反应的对映选择性的影响,然后我们合成了不含羟基的催化剂6,然后将该催化剂应用于催化该反应,我们发现仅能以4%的对映选择性得到产物。在不改变手性骨架情况下,从催化的结果比较可以看出,羟基上的氧原子配位作用对反应的对映选择性上发挥了很大的作用(表4中9)。
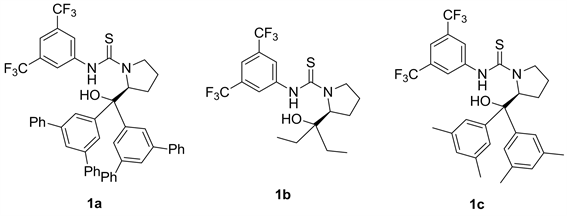


Table 4. Screening of L-proline derived thiourea catalysts a
表4. 筛选L-脯氨酸衍生的硫脲催化剂a
a催化剂1 (0.02 mmol, 10 mol %)、二乙基锌(0.8 mmol)、苯甲醛(0.20 mmol)、正己烷(0.2 mL),室温下搅拌24小时。b分离产率。c手性HPLC检测。d相反的对映异构体。
4. 结论
总之,本文报道了L-脯氨酸衍生的新型硫脲催化剂催化苯甲醛与二乙基锌的不对称加成烷基化反应,在最优化的反应条件下,可以实现88%的收率和45%的对映选择性得到光学活性的1-苯基-1-丙醇化合物。我们将L-脯氨酸衍生的新型硫脲催化剂与常见的手性骨架的硫脲催化剂进行了对比,发现明显优于其它手性骨架的硫脲催化剂。通过对L-脯氨酸衍生的新型硫脲催化剂的电子效应和位阻效应进行了初步的考察,发现通过三甲基硅基保护羟基的催化剂给出最好的催化效果。该类型手性催化体系具有成本低、效率高、反应条件温和等特点,为进一步用该方法合成手性醇类化合物提出了一条方便的合成路线。
基金项目
国家自然科学基金资助项目(21272166)。
NOTES
*通讯作者。