1. 引言
氢被认为是最具吸引力和发展力的能源之一,可以有效缓解能源短缺、环境污染以及其他与气候变化相关的问题 [1]。自1972年Honda和Fujishima [2] 首次发现TiO2在紫外光照射下可以实现水分解后,光催化产氢技术逐渐成为研究热点 [3]。在大量制氢技术 [4] 中,基于半导体的光催化技术更有潜力,经济,可再生且安全 [5]。TiO2具有生物和化学惰性、强氧化还原能力、环境友好和低成本等优点,广泛应用于光催化产氢领域 [6]。由于电子传输缓慢、电子–空穴复合速度快、表面缺乏有效的产氢活性位点等原因,纯相TiO2实际的光催化产氢效率并不高。提高TiO2表面的光生电荷的转移速率、抑制光生电子和空穴在TiO2表面的快速复合以及提高电子的有效利用率是提升其光催化效率的关键 [7]。
在半导体表面引入助催化剂被认为是一种有效提升材料光催化效率的手段 [8]。通过负载助催化剂可以促进载流子的迁移和分离,同时为表面的光催化反应提供活性位点 [9]。通常,负载贵金属助催化剂,例如Pt [10]、Ru [11] 和Au [12] 等,可有效促进光生电子和空穴分离,降低产氢过电位,达到促进光催化产氢的目的。然而,贵金属助催化剂的高成本和低自然丰度严重限制了其大规模应用。因此,寻找低成本且含量丰富的替代助催化剂十分重要。迄今为止,各种非贵金属的碳化物、硫化物和磷化物 [13] [14] [15] [16] 已被证实可以作为促进光催化产氢的高效助催化剂。然而,到目前为止,生态友好的过渡金属硼化物(TMB)尚未广泛用作光催化产氢的助催化剂。目前,已有文献报道过渡金属硼化物(MoB [17],FeB2 [18],NiFeB [19],Ni3B [20] )具有优异的电催化产氢能力,主要是由于TMB可以实现有效的电子转移,同时硼化物中的活性硼能够保护活性金属位点免受氧化 [21]。例如Cao等人在g-C3N4上引入Ni2B纳米颗粒 [22],Ni2B作为氮化碳层间的隔离物来增加了比表面积,减小了层的厚度,并且还作为导电材料,进一步提高了材料的导电性。同时,氮化碳与Ni2B之间的协同作用有助于减少中间物的吸附能并降低电催化所需的过电势,最终提升了氮化碳的电催化产氢活性。
近年来,逐渐有研究将TMBs用作光催化产氢的助催化剂 [23] [24] [25]。如Li等人构建了石墨烯和CdS纳米粒子以及过渡金属硼化物组成的三元光催化剂体系,其中非晶态过渡金属硼化物(NiB或NiCoB)作为助催化剂,其最高可见光催化产氢活性达到了144.8 mmol h−1g−1,是纯CdS的36倍 [26]。然而,由于CdS的高毒性和低稳定性,这些TMB修饰的CdS复合体系无法广泛应用于实际的光催化产氢。因此,本文引入非晶态硼化镍作为环保型助催化剂,修饰环境友好的二氧化钛,并对材料的光催化产氢性能进行研究,同时结合助催化剂引入前后材料的光电性能变化,讨论助催化剂引入对于活性提升的作用。
2. 实验部分
2.1. 实验试剂
四水合醋酸镍(Ni(CH3COO)2∙4H2O),乙醇(C2H5OH),甲醇(CH3OH),硫酸钠(Na2SO4),氯化钾(KCl)均购自国药集团化学试剂。铁氰化钾(K3[Fe(CN)6])、亚铁氰化钾(K4[Fe(CN)6])采购自阿拉丁试剂。Nafion溶液购自北京鸿海天科技。二氧化钛(P25)购自德固赛。硼氢化钠(NaBH4)购自上海凌峰试剂。以上所用试剂均为分析纯,无须进行其他处理即可直接使用。
2.2. 催化剂的制备
首先称取0.0249 g (0.1 mM)醋酸镍溶解到40 mL的去离子水中,持续搅拌。称取0.0113 g (0.3 mM)硼氢化钠,加入到10毫升冰水中。将NaBH4溶液缓慢滴加到醋酸镍溶液中,滴加过程中溶液颜色逐渐变黑,且有气泡不断冒出,反应过程中保持冰水浴。持续搅拌至无气泡产生后,用去离子水和乙醇洗涤后离心,在30℃下真空干燥得到样品NiB。NiB/P25的制备需要在配置的醋酸镍溶液中加入0.5 g P25,其他操作步骤同上,真空干燥得到的样品记为NB-1,NiB/P25样品的制备过程如图1所示。改变加入醋酸镍和硼氢化钠的量,得到的样品标记为NB-3、NB-5、NB-7,具体参数如表1所示。商业P25使用硼氢化钠进行同样的处理,处理过程如下:0.5 g P25加入40 mL的去离子水中,持续搅拌并保持冰水浴。称取0.0113 g硼氢化钠溶于10毫升冰水中。将配制的NaBH4溶液缓慢滴加到P25的混合液中,最后用去离子水和乙醇洗涤,离心烘干得到处理好的样品。
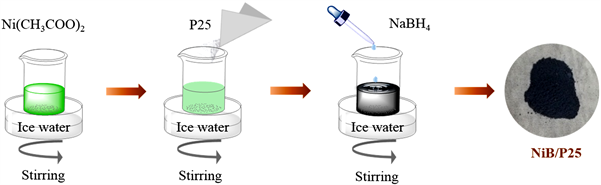
Figure 1. Schematic diagram of the preparation process of NiB/P25 samples
图1. NiB/P25样品的制备过程示意图

Table 1. The raw material components of NiB/P25
表1. NiB/P25制备过程中的原料组分
2.3. 催化剂的表征
样品的粉末X射线衍射(XRD)使用配备有Cu Kα辐射源的Bruker axs D8 Discover型粉末X射线衍射仪(德国布鲁克)进行测试。使用Hitachi UH4150型固体紫外漫反射仪(日本日立)对样品的UV-vis漫反射光谱进行测试。使用GeminiSEM 300型场发射扫描电镜(德国卡尔蔡司)对样品的形貌进行分析,同时配备的能量色散能谱仪(EDS)对样品的成分进行测定。使用Hitachi F4600型荧光分光光度计(日本日立)测试样品的荧光发射光谱(PL)。
2.4. 样品的光催化产氢活性测试
光催化产氢活性测试是在与密闭玻璃气体循环系统(中教金源,北京,CEL-SPH2N)相连的上照式玻璃反应容器中进行的。以300 W全波谱氙灯作为光源(距离光催化反应器1厘米),将光催化剂(0.01 g)加入到装有100 mL甲醇水溶液(20 vol%)的反应器中,在光照射之前,用真空泵将反应物溶液抽真空,以除去系统中残留的空气以及反应溶液中的溶解氧。在光催化反应过程中,通过流动的冷却水将反应溶液的温度保持在10 ℃。通过在线气相色谱仪(中教金源,北京,GC7920)来确定产生的氢气量,该色谱仪配备有热导检测器(TCD)和5 Å分子筛柱,使用氩气作为载气。
2.5. 光电性能测试
样品的光电化学测试实验在CHI 760型电化学工作站(上海辰华)上进行,在传统的三电极系统中,将Pt丝用作对电极,甘汞电极用作参比电极。将80 µL 10 mg/mL的样品悬浮液(每1 mL悬浮液加入0.01 mL Nafion膜溶液)滴涂到1 × 1 cm−2铟锡氧化物(ITO)导电玻璃基板上作为工作电极,自然风干。以0.2 mol/L的硫酸钠溶液作为电解质,50 W全光谱氙灯作为光源,间隔固定时间进行照射,获得光电流响应曲线。线性扫描伏安曲线(LSV)是以Ag/AgCl电极作为参比电极,滴涂样品的ITO导电玻璃片作为工作电极,在扫描范围为0~−1.0 V,扫描速度为50 mV·S−1的条件下测得。电化学阻抗谱(EIS)则是将8 µL样品悬浮液滴涂到玻碳电极上作为工作电极,以25 mmol/L的铁氰化钾/亚铁氰化钾混合溶液作为电解质,其中还加入了0.1 mol/L的氯化钾,测试频率范围为1~10 KHz。
3. 结果与讨论
3.1. 催化剂的表征
图2(a)为NiB样品的粉末X射线衍射谱图,图中不存在尖锐的结晶峰,表明制备得到的催化剂为结晶度较低的非晶型物质。其中,2θ = 45˚处的宽峰归属于非晶态硼化镍,2θ = 22˚附近的小鼓包则归属于非晶态氧化硼,据文献报道,该氧化硼是在水溶液中进行还原反应时形成的 [27] [28]。将制备的非晶态NiB样品在N2氛围,250℃下进行热处理3小时,图2(b)为热处理后的样品的粉末X射线衍射谱图,图中出现了部分尖锐的结晶峰,表明热处理使得NiB样品的结晶度提升,并且这些衍射峰均能与Ni3B的标准卡片相一致,表明硼化镍样品的成功制备。图3为所制备的NiB样品的SEM-EDX图像,SEM图表明NiB样品为蓬松银耳状,结合X射线能谱分析(EDX)对样品的组成元素和分布进行分析,Ni和B元素均匀的分布在材料上,这与XRD的结果一致。
图4为P25及NiB/P25样品的粉末X射线衍射谱图,图中所有衍射峰均能与P25中两种不同晶型的二氧化钛,即四方晶系锐钛矿型(ICSD 00-004-0477)和金红石型(ICSD 01-076-0318)二氧化钛的标准卡片对应上,表明制备过程并未影响P25的晶相结构。谱图中没有除TiO2之外的多余的衍射峰,各样品的谱图之间也没有观察到显著差异,这可能是由于引入的NiB的低含量和低结晶度。通过扫描电镜以及能量色散X射线(EDX)对样品的组成进行分析,图5为NB-3样品的扫描电子显微镜图像以及元素分布图,结果显示样品含有Ti、O、Ni、B元素,且Ti、O元素的分布密度明显高于Ni、B元素,证实了样品为NiB修饰的P25复合材料。

Figure 2. XRD pattern of NiB before (a) and after calcination (b)
图2. NiB(a)和热处理后的NiB(b)的XRD图谱

Figure 3. The FESEM image (a), selected area EDX elemental mappings of Ni, B (b-e) of NB-3
图3. NiB样品的场发射扫描电子显微镜图像(a),EDX(b-e)

Figure 4. XRD pattern of P25 and NiB/P25
图4. P25和NiB/P25的XRD图谱

Figure 5. The STEM image (a) and selected area EDX elemental mappings of Ti, O, Ni, B (b-f) of NB-3
图5. NB-3样品的扫描图像(a)及EDX元素分布图(b-f)
图6(a)为NiB、P25和NiB/P25样品的UV-Vis漫反射光谱,NiB表现出了一个较高的光吸收。除NiB之外,其他样品在400 nm左右均表现了出相似的吸收边,并且随着引入的NiB量的增多,样品的颜色也逐渐加深(图6(b)),NiB/P25样品对光的吸收强度增加,同时材料的吸收边逐渐红移。这意味NiB的引入提升了样品的光响应范围,增大了材料的光吸收,使得样品可以吸收更多的光子,从而产生更多的光生电子–空穴对。

Figure 6. UV-Vis diffuse reflectanse spectra (DRS) (a) and image of samples (b)
图6. 样品的紫外–可见漫反射光谱(a)和图片(b)
3.2. 催化剂的光催化性能
以20 vol%甲醇作为牺牲剂,在全波谱光照射下测定样品的光催化产氢性能(图7)。如图7(a),图7(b)所示,控制实验结果表明纯P25的光催化产氢量较少,4小时的总产氢速率仅为24 µmol g−1 h−1。NiB修饰后的样品表现出了明显提升的光催化产氢活性,随着NiB修饰量的增加,样品的光催化产氢活性呈现先增加后下降的趋势。其中NB-3的产氢活性最高,4小时的总产氢速率为2651.6 µmol g−1 h−1,约为相同条件下纯P25的110倍。在相同测试条件下,测试了纯NiB以及NaBH4处理后的P25样品的光催化产氢性能,如图7(c),图7(d)所示,发现纯NiB样品并不具有光催化产氢的能力,这表明NiB引入后仅作为助催化剂发挥作用。NaBH4处理后的P25表现出了非常低的光催化产氢活性,在4小时内的产氢速率仅为17 µmol g−1 h−1,这表明硼氢化钠处理后的P25载体的变化并不会对光催化产氢活性起到促进作用,样品的光催化活性的提升是由于NiB的引入。而值得注意的是,将NB-3样品在N2氛围,250℃下进行热处理3小时后,其光催化产氢活性明显降低,这表明非晶态的NiB更有利于促进P25的光催化产氢性能的提升。
NiB/P25光催化剂的的稳定性通过24小时连续光催化产氢实验进行测试。以NB-3作为实验对象,以20 vol%甲醇作为牺牲剂,全波谱光照射下持续光照24小时,反应过程中不补加牺牲剂。测试结果如图7(e)所示,NB-3样品的光催化产氢量随着光照时间的延长逐渐平稳增加,这表明材料具有较好的抗光腐蚀性。图7(f)中,样品的产氢速率在0~5小时内快速增加,后些微降低逐渐达到平稳,这可能是由于光催化剂在最初的几个小时内和溶液中的牺牲剂分子快速结合,氢气在材料表面快速的产生和脱去,此后两者结合以及离去的速率逐渐达到平衡,产氢速率逐渐平稳,而产氢速率的些微降低可能是由于溶液中的牺牲剂分子的不断消耗。24小时连续光催化产氢实验结果表明NiB/P25材料在光催化产氢过程中具有良好的稳定性。
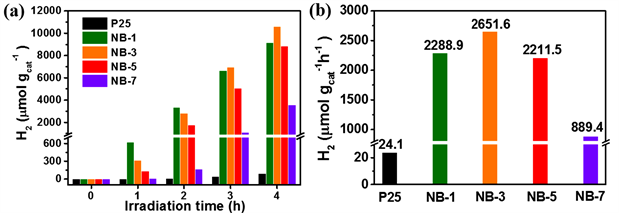
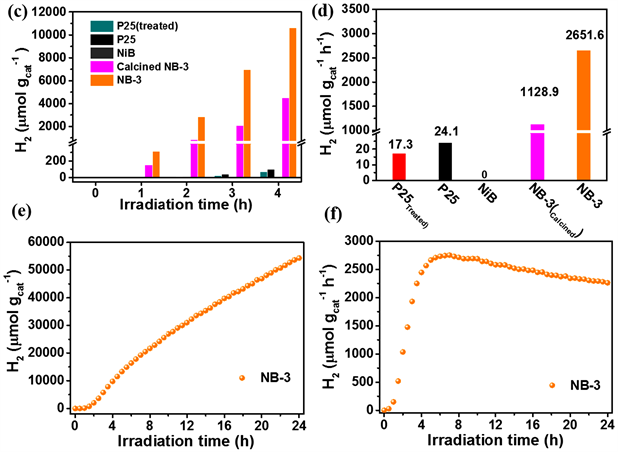
Figure 7. The plots of H2 production versus time and total H2 evolution rate of samples (a - f)
图7. 样品的氢气产量与时间的变化曲线和总产氢速率(a - f)
3.3. 光催化产氢机制
通过测试样品的荧光(PL)光谱对样品的光生电荷的分离和迁移进行分析。图8为P25和NiB/P25在250 nm激发光下的荧光光谱图,可以发现,修饰前后的样品出现了相同的荧光发射峰型,这主要是来自于P25受激发后电子–空穴复合而产生的荧光。而引入NiB后的样品的荧光强度明显降低,这表明NiB引入后,电子可以从TiO2转移到NiB上,抑制了电子–空穴重组,从而降低了荧光强度,而这部分转移到NiB上的电子可以用于后续光催化产氢反应,这也是NiB引入后其活性提升的主要原因。但是值得注意的是,NB-7的荧光强度最低,这与光催化产氢的活性顺序并非一致,表明载流子分离效率并非是影响光催化活性的唯一因素。

Figure 8. Photoluminescence spectra (PL) (excition wavelength is 250 nm) of sample
图8. 样品的荧光光谱
通过测试材料的瞬态光电流响应和电化学阻抗谱来进一步研究NiB的引入对于改善材料电荷分离和迁移的影响。图9(a)为P25及NB-3样品在等时间间隔下瞬态光电流响应曲线,P25及NB-3在光照下均产生了显著的光电流信号。与纯P25相比,修饰后的材料的光电流密度明显增加。这说明NiB助催化剂的引入可以有效促进载流子的分离,增强电子的浓度,这与荧光光谱的结果一致。图9(b)为P25及NB-3的电化学阻抗图谱,与P25相比,NB-3材料的电荷转移电阻明显更小,这表明高导电性的硼化镍的引入使得材料的电阻减小,增强了电荷迁移的速率,也说明硼化镍引入后可以通过促进电荷转移来提升光催化产氢速率。测试样品的线性扫描伏安(LSV)曲线来分析NiB助催化剂在光催化反应中的作用。图9(c)为P25和NB-3样品从0到−1.0 V(相对于Ag/AgCl)进行负向扫描时的极化曲线,结果显示两者均出现了明显的阴极电流,表明析氢反应(HER)发生。修饰后的NB-3的阴极电流密度明显提升,这意味着NiB助催化剂可以大大提高电子浓度。同时,NB-3比P25表现出了更小的起始电位,这意味着NiB可以降低产氢过电位,有效促进质子还原反应的发生。

Figure 9. Photocurrent responses (a), electrochemical impedance spectroscopy (EIS) (b), and linear sweep voltammograms (LSV) (c) of sample
图9. 样品的光电流响应曲线(a),电化学阻抗谱(b),线性扫描伏安图(c)
基于以上实验结果,提出了NiB/P25复合材料可能的光催化产氢机制,如图10所示。在光照下,P25吸收光子并激发产生光生电子和空穴,电子从价带(VB)跃迁到导带(CB),此时CB中的大部分电子和VB中的空穴快速复合发出荧光,少部分电子和空穴分别参与还原和氧化反应,导致纯P25的光催化产氢活性较低。但是,将NiB引入之后,由于P25和NiB之间的紧密接触,跃迁到P25的CB上的光生电子可以迅速转移到NiB助催化剂上,促进了电子–空穴对的分离和转移效率,抑制了电子和空穴的复合,从而降低了荧光强度,提升了光生电子的有效利用,最终显著提高了材料的光催化产氢活性。

Figure 10. Schematic diagram of carrier migration in the photocatalytic hydrogen production process of P25 and NiB/P25 samples
图10. P25及NiB/P25样品的光催化产氢过程的载流子迁移示意图
4. 结论
以硼氢化钠为硼源,通过简单的方法合成得到了硼化镍修饰的P25材料,通过调控加入的硼源和镍源的量可以对NiB的修饰量进行简单调控。XRD结果显示NiB以非晶态存在。NiB的引入明显提升了材料的光催化产氢活性。最佳修饰量的材料的光催化产氢速率为2651.6 µmol g−1 h−1,约为纯P25的110倍。样品的紫外可见吸收光谱、荧光光谱、光电流响应、电化学阻抗以及线性扫描伏安图等光电性能测试结果表明NiB的修饰提升了材料的光响应,促进了光生电子和空穴的分离,并且降低了载流子迁移的阻力,降低了产氢过电位,因而极大的促进了材料的光催化活性的提升。除此之外,24小时连续光催化产氢测试表明该催化剂具有良好的稳定性。
致谢
感谢国家自然科学基金资助项目(项目编号:50902110)。
NOTES
*通讯作者。