1. 引言
南美白对虾虾肝肠胞虫病(Enterocytozoon hepatopenaei, EHP)是近年来全球对虾养殖生产影响较严重的疾病之一,虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)是一种专性细胞内寄生的微孢子虫,属于真菌界(Fungi)微孢子虫门(Microsporidia)单倍期纲(Haplophasea)壶孢目(Chytridiopsida)肠胞虫科(Enterocytozoonidae)肠胞虫属(Enterocytozoon),是导致斑节对虾(Penaeus monodon)和南美白对虾(Litopenaeus vannamei)肝胰腺微孢子虫病(Hepatopancreatic microsporidiosis, HPM)的病原。患病虾主要表现出白便综合症(White Feces Syndrome, WFS)及生长迟缓综合症(Monodon Slow Growth Syndrome, MSGS)等症状 [1] [2]。2009年在泰国生长缓慢的斑节对虾中被首次发现分离而命名,EHP易感染斑节对虾和凡纳滨对虾,2013年EHP在国内首次发现,2017年,我国超过一半的对虾养殖户出现亏损,经济损失达3亿元,虾肝肠胞虫寄生已成为影响我国沿海地区南美白对虾产业发展的一大障碍 [3] [4]。
由于虾肝肠胞虫病给虾类养殖业带来的严重危害及巨大经济损失,因此,非常有必要建立一种准确、快速、灵敏的检测方法对其进行监控,从而保证虾类养殖业的健康发展。目前,已知报道的虾肝肠胞虫检测方法主要有:组织病理学、套氏PCR法、重组酶介导核酸扩增方法、原位杂交、环介导等温扩增(LAMP)法等 [5] [6],这些方法在检测时限、操作简便程度、易出现假阳性等方面存在一定的不足,在大量样品同时检测时,无法满足及时快速出具精准检测结果的实际需求。
近年来,实时荧光定量PCR (Real-time PCR)技术以其简单快速、灵敏度高和成本低廉等优点,被广泛应用于水生动物病原的分析及检测等领域。相对于普通定性PCR方法,荧光定量PCR的检测和分析过程均在密闭的单管里由机器自动完成,具有自动化程度高、有效解决PCR产物污染问题及能定量检测病原体感染等优点,被认为是实验室检测病原的理想方法。而TaqMan-MGB探针是荧光定量PCR使用的一种荧光探针,其3’端淬灭基团为不发光的MGB结合物,可实现高Tm值的探针长度缩短而有利于提高方法的灵敏度,且探针3’端不发光的淬灭基团与5’端报告基团在空间的位置更接近,使荧光本底降低、检测结果分辨率更高,因此,TaqMan-MGB探针在人类及动植物各种病原体的定量检测中得到广泛应用 [7]。基于TaqMan-MGB探针的优势,本研究以EHP基因保守片段为靶序列,设计特异性引物,建立针对EHP的快速、敏感、特异的TaqMan-MGB荧光定量PCR方法检测方法,实现疾病的早期精准检测与诊断,为保护我国虾类养殖业发展提供必要的技术支持。
2. 材料与方法
2.1. 阳性组织病料、试剂与仪器
EHP (虾肝肠胞虫)、WSSV (对虾白斑综合征病毒)及IHHNV (对虾传染性皮下和造血器官坏死病毒)、SHIV (虾血细胞虹彩病毒)阳性组织病料由本实验室鉴定保存。
Premix Ex Taq™ (Probe qPCR)试剂盒、DEPC水等购于大连宝生物工程公司。
罗氏LC96荧光PCR仪购于美国罗氏公司;移液器购于德国Eppendorf。
2.2. 引物的设计与合成
选取EHP特异保守的PTP2基因核苷酸片段作为靶序列,计病原TaqMan-MGB特异性引物和探针。利用BioEdit软件比对美国国立生物技术信息中心(NCBI) Genbank公布的各EHPPTP2基因各核苷酸序列,使用Primer Premier 5.0软件针对目标序列设计2条特异性引物及1条探针引物。该引物在EHPPTP2所在位置如图1 (黑色方框为上下游引物,红色方框为探针)。该特异性引物和探针,由宝生物工程(大连)有限公司合成如下,具体序列见表1。

Figure 1. The sequence alignment results of EHP primers and probe
图1. EHP引物和探针序列比对结果

Table 1. EHP TaqMan-MGB fluorescent quantitative PCR primer and probe sequences
表1. EHP TaqMan-MGB荧光定量PCR引物和探针序列
采用表中特异性PCR上下游引物扩增目标DNA片段,用于制备阳性质粒作为标准品。
2.3. 病原核酸的提取
采用商品化的病原基因组DNA/RNA提取试剂盒说明书,对EHP、WSSV、IHHNV及SHIV提取核酸后置−70℃保存备用。
2.4. EHP标准品的制备
为了得到可定量和稳定的EHP阳性模板,需要将扩增的EHP目的片段(58 bp)克隆到质粒中。具体为:利用表1将EHP核酸进行常规PCR扩增,得到58 bp的扩增产物。从琼脂糖凝胶中回收扩增产物。将回收产物连接到pMD-18-T载体上,转化在大肠杆菌DH5α中,筛选阳性克隆,提取质粒DNA,命名为重组质粒pMD18-T-EHP-PTP2,即EHP标准品。通过核酸分析仪测定质粒的OD260、OD280及其质粒DNA浓度,同时将该标准品换算成拷贝数。将该标准品DNA以10倍梯度连续稀释至10−8,−20℃保存备用。
2.5. TaqMan-MGB反应体系
以EHP标准品为模板,将其在LC96荧光PCR仪中进行TaqMan-MGB PCR扩增。本实验采用的反应体系为:10 μL Premix Ex Taq (Probe qPCR) (2X),0.4 μL上游引物(10 μM),0.4 μL下游引物(10 μM),0.8 μL探针(10 μM),2 μL DNA模板,加6.4 μL DEPC水将反应总体积补齐至20 μL。反应程序为:首先95℃预变性30 s;然后进行95℃变性5 s,60℃退火20 s,并在此步采集荧光信号,40个循环。
2.6. TaqMan-MGB反应条件优化
以重组质粒pMD18-T-EHP-PTP2标准品DNA为模板,在55℃~65℃范围内,每间隔1℃的温度梯度进行TaqMan-MGB荧光定量PCR扩增,以获得较低阈值循环数(CT)和较高相对荧光强度增加值(ΔRn)时的温度为最佳退火温度。同时,采用不同的上下游引物终浓度(依次为2、4、6、8、10及12 μmol/L)与TaqMan-MGB探针终浓度(1、2、3、4和5 μmol/L)组合进行TaqMan-MGB荧光定量PCR扩增,以获得较低CT和较高ΔRn时的浓度组合为最佳引物和探针浓度组合。
2.7. 标准曲线绘制及敏感性试验
重组质粒pMD18-T-EHP-PTP2以10倍梯度稀释的标准品DNA为模板,采用优化后的TaqMan-MGB探针荧光定量PCR进行敏感性试验,建立模板拷贝数(x)对数与CT值(y)间的标准曲线和线性回归方程,从而根据各标准品DNA扩增的CT值结果推算出模板浓度。
2.8. 特异性试验
按照优化好的各TaqMan-MGB荧光定量PCR反应条件进行荧光定量PCR扩增。以WSSV、IHHNV及SHIV作为对照病原,验证该方法是否与其他水生动物病原存在非特异性交叉反应。
2.9. 重复性实验
选择3个连续稀释度的重组质粒标准品为模板,进行TaqMan-MGB荧光定量PCR的批内及批间重复性试验。同一反应条件下,每个稀释度的样品同时进行3次重复为批内重复试验。而在不同的时间,同样的反应条件下进行的3次荧光定量PCR反应为批间重复试验。
2.10. 临床样品检测
将本研究构建的EHP TaqMan-MGB荧光定量PCR对收集的278份临床虾类样品进行检测,同时与标准方法中的TaqMan荧光定量PCR进行比较。
3. 结果与讨论
3.1. EHP TaqMan-MGB荧光定量PCR最优反应条件
经比较不同退火温度及不同引物和TaqMan-MGB探针浓度组合的扩增效果,最终确定在EHP TaqMan-MGB荧光定量PCR 20.0 μL反应体系中,Probe qPCR Mix (2×) 10.0 μL,EHP上下游引物(10 μmol/L)各1.0 μL,TaqMan-MGB探针(5 μmol/L) 2.0 μL,DNA模板2.0 μL,DEPC水补足至20.0 μL。扩增程序为:95℃预变性30 s;95℃ 5 s,56℃ 45 s,进行40个循环;在56℃结束时收集荧光信号。
3.2. TaqMan-MGB荧光定量PCR敏感性试验结果
重组质粒pMD18-T-EHP-PTP2以10倍梯度稀释的标准品DNA为模板,按照项“2.6”最优反应条件进行荧光定量PCR反应,各稀释度的荧光扩增试验结果如图2显示,EHP TaqMan-MGB荧光定量PCR的检测低限为重组质粒pMD18-T-EHP-PTP2标准品的10−4,其拷贝数为2.7 × 102拷贝/μL。
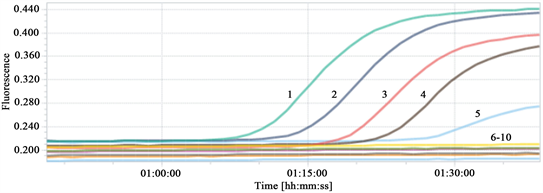 注:1~10分别代表重组质粒pMD18-T-EHP-PTP2稀释倍数为100,10−1,10−2,10−3,10−4,10−5,10−6,10−7,10−8及阴性对照。
注:1~10分别代表重组质粒pMD18-T-EHP-PTP2稀释倍数为100,10−1,10−2,10−3,10−4,10−5,10−6,10−7,10−8及阴性对照。
Figure 2. EHP TaqMan-MGB fluorescence quantitative PCR sensitivity test
图2. EHP TaqMan-MGB荧光定量PCR敏感性试验
3.3. 标准曲线
根据图3得到的不同稀释度的实时荧光扩增曲线。以重组质粒浓度的对数值为横坐标,Ct值为纵坐标,绘制标准曲线如下。由图3可知,EHP TaqMan-MGB荧光定量PCR标准曲线的斜率为−4.95,截距为34.95,相关系数为0.9993,得到标准曲线方程为y = −4.95 × log(X) + 34.95。
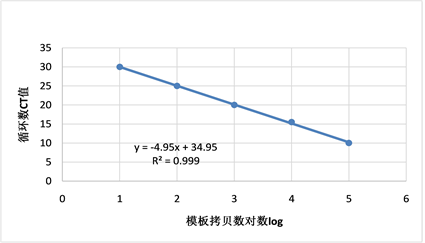
Figure 3. EHP TaqMan-MGB fluorescence quantitative PCR standard curve
图3. EHP TaqMan-MGB荧光定量PCR标准曲线
3.4. 特异性试验结果
EHP进行TaqMan-MGB荧光定量PCR的特异性检测,试验结果如下图4。试验结果显示,本研究构建的TaqMan-MGB荧光定量PCR只针对目标病原有显著的特异性扩增,与其他病原WSSV、IHHNV及SHIV无交叉反应。
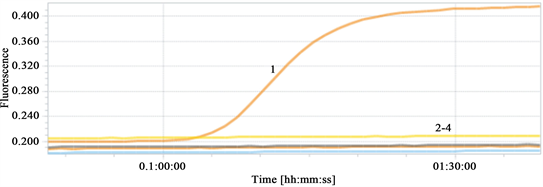 注:1:EHP,2:WSSV,3:IHHNV,4:SHIV。
注:1:EHP,2:WSSV,3:IHHNV,4:SHIV。
Figure 4. EHP TaqMan-MGB fluorescence quantitative PCR specificity test
图4. EHP TaqMan-MGB荧光定量PCR特异性试验
3.5. 重复性试验结果
EHP TaqMan-MGB荧光定量PCR重复性试验结果如下表2所示,批内试验与批间试验的变异系数差别不大,均小于1%,通过标准误差和变异系数可知EHP TaqMan-MGB荧光定量PCR的重复性较好。

Table 2. Repeatability of EHP TaqMan-MGB fluorescence quantitative PCR detection
表2. EHP TaqMan-MGB荧光定量PCR检测的重复性
3.6. 临床样品检测
研究共收集了278份国内及进境虾类及其产品,分别用本研究构建的TaqMan-MGB荧光定量PCR和SC/T 7232-2020《虾肝肠胞虫病诊断规程》中的TaqMan荧光定量PCR进行EHP的检测,检测结果详见表3。结果显示,两种方法阳性检出率非常接近,表明了本研究构建的EHP TaqMan-MGB荧光定量PCR可初步应用在实际临床样品的检测与监测中。

Table 3. Detection of EHP in clinical samples (278)
表3. 临床样品(278份)中EHP的检测
4. 讨论与结论
4.1. 讨论
虾肝肠胞虫病的防治,目前尚无特效的方法,只有建立快速灵敏的检测方法,对疾病进行早期的诊断,采取有效防控措施,才能保持虾类养殖业健康发展。
目前报道的虾肝肠胞虫EHP检测方法有多种,各个方法都有各自的优缺点。组织病理学及原位杂交检测手段因其样品制备复杂及操作繁琐耗时,不适合作为日常检测的技术。套氏PCR方法需要经过2次PCR过程,检测时间长,容易出现假阳性。LAMP方法虽然检测的灵敏度高,但是该方法特别容易污染。因此,本研究需要构建一种方便实用、精准有效的EHP检测技术,作为EHP日常检测与监测的技术手段。
实时荧光定量PCR是在DNA扩增反应中加入荧光染料,随着反应的进行,这种染料的荧光强度会不断增强,从而可以对反应中的DNA进行定量,具有实时、快速等优点。目前,实时荧光定量PCR检测技术为样品中虾肝肠胞虫的检测提供了有力的工具。但是,TaqMan探针定量PCR由于探针长度太长,存在敏感性不够理想的问题,而TaqMan-MGB探针由于其3’端的MGB结合物可提高探针的Tm值,使高Tm值探针的长度缩短,敏感性更好,TaqMan-MGB探针原则上只要有一个碱基突变,探针就不会与目的片段杂交,即不产生荧光信号,故特异性更强。此外,MGB探针3’端的淬灭基团为不发光的荧光基团,与报告基团的空间距离更接近,淬灭效果更佳,故杂交的本底小,稳定性和分辨率更优,TaqMan-MGB探针凭借其技术优势在各种病原体检测中已得到广泛应用。因此,本研究构建了虾肝肠胞虫EHP TaqMan-MGB荧光定量PCR检测技术,具体检测技术流程框图如图5,影响本EHP TaqMan-MGB荧光定量PCR检测技术构建的主要因素包括探针及引物的保守性、阳性标准品的制备、引物浓度及退火温度等。本研究经过特异性试验、敏感性试验及重复性试验验证,表明构建的EHP TaqMan-MGB荧光定量PCR检测技术特异性强、敏感性高、稳定有效,可初步应用于临床样品的检测。
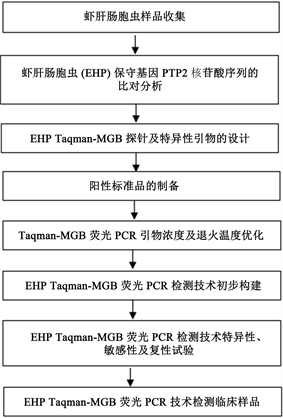
Figure 5. Flow chart of EHP TaqMan-MGB fluorescence quantitative PCR detection technology
图5. EHP TaqMan-MGB荧光定量PCR检测技术流程图
4.2. 结论
本研究建立的EHP TaqMan-MGB荧光定量PCR检测方法实用性较强。在反应过程中,只需加入引物、探针、模板、反应液便可进行反应。在实验中值得注意的是,质粒阳性标准品的制备也是建立TaqMan-MGB荧光定量PCR检测方法的关键环节,标准品的制备保障了验证分析EHP TaqMan-MGB荧光定量PCR检测方法时的稳定性及可靠性。本研究采用构建的重组质粒作为阳性标准品,EHP TaqMan-MGB荧光定量PCR的检测低限为重组质粒pMD18-T-EHP-PTP2标准品的10−4,其拷贝数为2.7 × 102拷贝/μL。特异性试验结果显示,该方法对WSSV、IHHNV及SHIV等其他水生动物病原均无特异性扩增反应,特异性良好,是一种比较实用的鉴别诊断检测方法。重复性试验表明了研究构建的检测方法具有良好的重复性。同时,该方法初步应用在了临床虾类样品的EHP检测中,与标准方法中推荐使用的TaqMan荧光定量PCR相比,两者阳性检出率基本一致,表明了本研究构建的EHP TaqMan-MGB荧光定量PCR技术适用于日常虾类及其产品的检测与检测,为水产品病原诊断及防控提供了便捷简单的技术手段。
基金项目
海关总署科研项目(2020HK143)。
NOTES
*通讯作者。