1. 引言
据国家癌症中心数据,我国肝癌的发病率排名第四,死亡率排名第二,仅次于肺癌 [1]。因此寻找新的潜在的治疗肝癌的靶点具有非常重要的意义。铁死亡是一种以脂质过氧化物、铁离子累积为主要特征的程序性死亡,现有研究表明,铁死亡与肝癌的发展有关 [2]。miR-485-3p位于染色体14q32.31,研究表明miR-485-3p在结直肠癌 [3] [4] 、宫颈癌 [5] 、和乳腺癌 [6] 等恶性肿瘤中可以作为肿瘤抑制因子。相反,研究显示miR-485-3p可作为促癌因子在胃癌 [7] 和肝癌中发挥作用。在肝癌中,miR-485-3p能与LinC00052形成互补碱基对,降低神经营养酪氨酸激酶受体(NTRK3)对肝癌细胞增殖和转移的抑制作用,从而促进肝癌细胞增殖和转移 [8]。另有研究显示,在HepG2细胞中,敲除miR-485-3p可以相对提高MAT1A的mRNA和蛋白质水平,MAT1A的表达水平与肝细胞癌的发生呈负相关,MAT1A表达升高,抑制了肝癌细胞生长和侵袭 [9]。有研究证实miR-485-3p可以通过介导铁转运蛋白影响细胞内铁的代谢,过表达miR-485-3p能降低铁转运蛋白的活性,造成细胞内铁累积 [10]。然而,miR-485-3p是否参与调控肝癌细胞铁死亡,仍待进一步研究。本研究以肝癌细胞系HepG2为研究对象,探讨miR-485-3p在肝癌细胞铁死亡过程中的影响及作用机制,为肝癌的综合治疗提供潜在的靶点。
2. 材料与方法
2.1. 主要材料和试剂
肝癌细胞系HepG2购自塞库生物。模拟物(hsa-miR-485-3p mimics)、抑制物(hsa-miR-485-3p inhibitor)、阴性对照(Negative control)、转染试剂(transfect-mate)均购自上海吉玛制药技术有限公司基因。MEM培养基、胰蛋白酶-EDTA消化液、青链霉素混合液、PBS均购自上海源培生物科技股份有限公司。胎牛血清购自Gibco美国赛默飞世尔科技有限公司。RT-qPCR试剂盒购自湖南艾科瑞生物工程有限公司公司。脂质氧化(MDA)检测试剂盒购自上海碧云天生物技术有限公司。铁离子比色法检测试剂盒采购于北京普利莱基因技术有限公司。引物采购于上海吉玛制药技术有限公司。C11-BODIPY581/591购自武汉爱博泰克生物科技有限公司。GAPDH抗体、NCOA4抗体、FTH1抗体、SLC7A11抗体、抗体均购自美国Cell Signaling Technology公司(CST)。TBST缓冲液、30%丙烯酰胺、过硫酸铵(APS)、四甲基乙二胺(TEMED)均购自武汉塞维尔生物科技有限公司。
2.2. 方法
2.2.1. 细胞培养与分组
肝癌细胞系HepG2在含10%胎牛血清及1%青链霉素混合液的MEM培养基中培养。细胞培养箱保持5% CO2、37℃的恒温条件。细胞复苏、细胞传代均在生物安全柜中进行。细胞每培养15代,更换1次细胞。HepG2细胞共分为6组,分别为“NC + DMSO”组(阴性对照组)、“NC + SF”组(索拉非尼诱导组)、“Mimics + DMSO”组(miR-485-3p过表达组)、“Mimics + SF”组(miR-485-3p过表达 + 索拉非尼诱导组)。“Inhibitor + DMSO”组(miR-485-3p抑制组)、“Inhibitor + SF”组(miR-485-3p抑制 + 索拉非尼诱导组)。
2.2.2. CCK-8 (Cell Counting Kit-8)实验
细胞活力检测:转染后的HepG2细胞,按照细胞传代步骤进行消化吹打混匀,显微镜下计数(5 × 103/well)接种于96孔板中,总培养基体积100 μL。24 h后加药,加药处理24 h后更换培养基,避光条件下加入提前配制好的CCK-8检测试剂,总体积100 μL,培养箱中孵育2 h。用酶标仪测定450 nm处的吸光度值,记录实验数据。
2.2.3. 克隆形成实验
将转染处理过的HepG2细胞(6 × 102/well)接种于12孔板中。细胞在添加10%胎牛血清的培养基中培养2周,每4天更换一次培养基。待形成肉眼可见细胞团时,加药处理24 h,室温下用4%的多聚甲醛细胞固定液固定细胞20 min,然后用0.1%的结晶紫染色。双蒸水冲洗3~5次,自然晾干后拍照保存。
2.2.4. PCR实验
预先处理好的细胞清洗3遍,提取细胞总RNA。测定RNA浓度后,参照产品说明书反转录生成cDNA,以上操作均在冰上进行。使用伯乐CFX-96荧光定量PCR仪行实时荧光定量PCR。2−ΔΔCt法计算miRNA实时水平。
2.2.5. 丙二醛(MDA)检测
裂解液充分裂解细胞后,4℃ 12,000 r/min离心10 min,取上清液。加入配制好的MDA检测工作液,溶液充分混匀,100℃孵育15 min,水浴冷却至室温,室温1000 r/min离心10 min,最后取200 μL样品加入96孔板中,每样本重复3次,酶标仪532 nm波长测定吸光度。依据标准浓度曲线及样品蛋白浓度计算细胞内MDA水平。
2.2.6. 铁离子检测
向培养好细胞的6孔板中加入400 μL/孔铁离子检测试剂裂解液,室温下置于摇床上裂解2 h充分裂解细胞。吸取样品至1.5 ml离心管,根据说明书加入各组样品及所需试剂,充分混匀,60℃孵育1 h,冷却至室温后瞬时离心,加入30 μL铁离子检测剂,室温孵育30 min,取200 μL于96孔板,550 nm测定吸光度值。依据标准浓度曲线及样品蛋白浓度计算细胞内铁离子水平。
2.2.7. C11-BODIPY实验
C11-BODIPY用于检测细胞内脂质过氧化。HepG2细胞(15 × 104/well)六孔板种板,细胞融合度40%左右进行转染,转染后24 h加药,加药处理24 h后用含50 µmol/L C11-BODIPY试剂培养基按说明书进行培养,所得各组样品用激光共聚焦显微镜进行测定。
2.2.8. Western Blot实验
RIPA裂解细胞20 min后,刮匙刮下细胞,转移至1.5 mL样品管中。4℃离心机12,000 r/min离心15 min,取上清液提取细胞总蛋白。使用BCA试剂盒测定细胞蛋白浓度,按照1:4体积比添加蛋白电泳上样缓冲液充分混匀后,95℃金属浴中加热5 min,−20℃保存备用。取10 μg蛋白上样,电泳80 V、30 min,120 V、60 min,转膜。脱脂牛奶封闭2 h。TBST缓冲液清洗条带3遍,孵育一抗过夜。所用抗体均按照说明书1:1000稀释。二抗1:3000稀释,常温下孵育1 h,TBST缓冲液清洗条带3遍。加入超敏显影液,显影仪下发光显影。
2.3. 统计学处理
所获数据应用GraphPad Prism 8软件进行统计分析。计量资料以x ± s表示,两独立样本间差异的比较采用独立样本t检验。所有实验均重复3次。P < 0.05为差异具有统计学意义。
3. 结果
3.1. miR-485-3p对HepG2细胞铁死亡的影响
通过CCK-8实验测定加入索拉非尼前后肝癌细胞的活力,结果显示“Mimics + DMSO”组细胞活力相比“NC + DMSO”组明显升高,而“Mimics + SF”组肝癌细胞活力相比于“NC + SF”组显著降低(图1(a))。细胞克隆形成实验结果显示:在索拉非尼的诱导下,miR-485-3p表达增强后,HepG2的细胞活力显著下降,而敲低miR-485-3p后,HepG2的细胞活力明显增强(图1(b))。PCR结果显示,索拉非尼诱导组的miR-485-3p表达水平较NC组显著升高(图1(c))。这些结果提示miR-485-3p在调控肝癌细胞铁死亡中发挥了作用。我们通过检测细胞内铁离子水平、丙二醛(MDA)水平发现“Mimics + SF”组的MDA和铁离子水平较“NC + SF”组明显升高(图1(d)、图1(e)),“Inhibitor + SF”组铁离子水平较“NC + SF”组明显降低(图1(f))。共聚焦显微镜下观察到,索拉非尼诱导后的各组细胞ROS水平均有明显升高;且“Mimics + SF”组荧光强度显著高于“NC + SF”组,而“Inhibitor + SF”组细胞内ROS水平较“NC + SF”组下降(图1(g))。
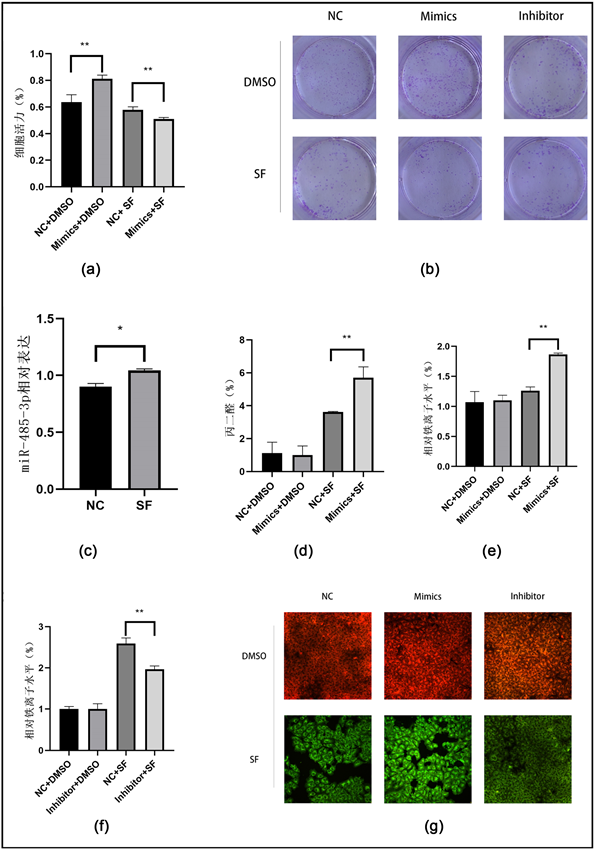
Figure 1. Effect of miR-485-3p on ferroptosis of HepG2 cells. (a) Changes in cell viability after overexpression of miR-485-3p; (b) Cell growth and proliferation in different groups; (c) The expression of miR-485-3p after sorafenib induction was detected by RT-qPCR; (d) Comparison of malondialdehyde levels in cells of different groups; (e) Comparison of intracellular iron levels in different groups after overexpression of miR-485-3p; (f) Comparison of intracellular iron levels in different groups after inhibition of miR-485-3p; (g) ROS fluorescence signals in cells of each group were observed under confocal microscope. The green fluorescence was oxidation state and the red fluorescence was non-oxidation state *P < 0.05, **P < 0.01
图1. miR-485-3p对HepG2细胞铁死亡的影响。(a) 过表达miR-485-3p后细胞活力变化;(b) 不同组别细胞生长增殖情况;(c) RT-qPCR检测索拉非尼诱导后miR-485-3p的表达变化;(d) 不同组别细胞内丙二醛水平比较;(e) 过表达miR-485-3p后不同组别细胞内铁离子水平比较;(f) 抑制miR-485-3p后不同组别细胞内铁离子水平比较;(g) 共聚焦显微镜下观察各组细胞内ROS荧光信号,绿色荧光为氧化态,红色荧光为非氧化态*P < 0.05, **P < 0.01
3.2. miR-485-3p调控HepG2细胞铁死亡的机制
为了进一步探索miR-485-3p调控肝癌细胞铁死亡的机制,我们预测了miR-485-3p在铁死亡通路中可能的靶基因,首先,我们使用铁死亡数据库FerrDb,分别筛选出“铁死亡驱动基因”和“铁死亡抑制基因”中评分前10位的基因,使用miRWalk数据库筛选得到上述基因中与miR-485-3p具有结合位点且评分前5位的基因:TP53、IREB2、NCOA4、FTH1、SLC7A11。本研究中选取NCOA4、FTH1、SLC7A11作为预选基因进行Western blot验证。结果显示:NCOA4、SLC7A11和FTH1在索拉非尼诱导铁死亡后表达都有所下降,但在非诱导铁死亡组过表达或抑制miR-485-3p后,只有NCOA4的表达量出现了显著变化。“Mimics + DMSO”组NCOA4表达量较“NC + DMSO”组明显升高,“Mimics + SF”组NCOA4表达量较“NC + SF”组也有轻度升高(图2(a)、图2(b))。“Inhibitor + DMSO”组较“NC + DMSO”组NCOA4表达量明显下降,“Inhibitor + SF”组较“NC + SF”组NCOA4表达量也有轻度下降(图2(c)、图2(d))。以上结果提示,miR-485-3p可以通过正向调控NCOA4的表达影响铁死亡。
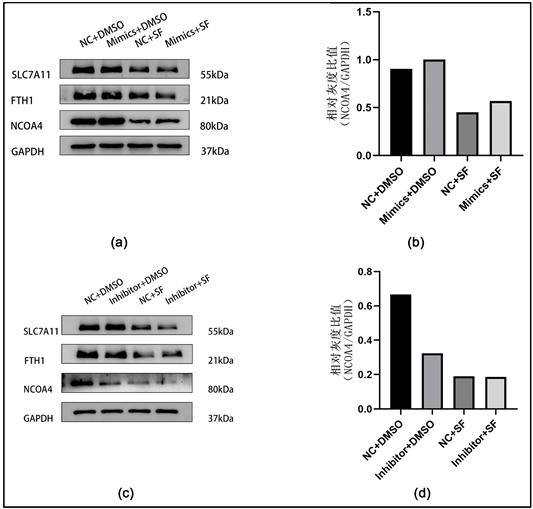
Figure 2. miR-485-3p positively regulates NCOA4 and affects ferroptosis of HepG2 cells. (a) Western blot detection of changes in the expression of ferroptosis related proteins after overexpression of miR-485-3p were detected by Western blot; (b) Changes of NCOA4 expression in different groups of cells after overexpression of miR-485-3p; (c) Western blot detection of changes in the expression of ferroptosis related proteins after the inhibition of miR-485-3p; (d) Changes in the expression of NCOA4 in different groups of cells after the inhibition of miR-485-3p
图2. miR-485-3p正向调控NCOA4影响HepG2细胞铁死亡。(a) Western blot检测过表达miR-485-3p后铁死亡相关蛋白的表达变化;(b) 过表达miR-485-3p后不同组别细胞NCOA4表达的变化;(c) Western blot检测抑制miR-485-3p后铁死亡相关蛋白的表达变化;(d) 抑制miR-485-3p后不同组别细胞NCOA4表达的变化
4. 讨论
铁死亡是一种以铁离子、脂质过氧化物累积为主要特征的程序性死亡,与肿瘤、神经系统疾病、缺血–再灌注损伤、肾损伤、血液疾病等多种疾病的病理生理过程密切相关 [11]。铁死亡通过调节细胞内谷胱甘肽(GSH)、细胞内脂质过氧化物及其他相关物质的水平影响肝癌的发展 [12]。索拉非尼是第一个被批准用于肝癌晚期全身治疗的药物,研究认为索拉非尼作为铁死亡诱导剂,可以作用于system XC−,消耗肝癌细胞内谷胱甘肽,导致脂质过氧化,最终引起肝癌细胞铁死亡,其作用与erastin相似 [13]。然而在肝癌的临床治疗中,使用索拉非尼后很快便可产生耐药性。因此寻找新的铁死亡靶点对治疗肝癌具有重要意义。MicroRNAs (miRNAs)是一类进化上保守的非编码RNA,作为基因表达的转录后调节因子,参与细胞增殖、凋亡等多种生物学过程 [14]。过去的研究认为,miRNA的作用机制是作为负调控因子在胞质中与靶mRNA结合导致靶mRNA的翻译抑制或引起靶mRNA的降解 [15]。最新的研究证实,miRNA同样存在于细胞核中。核内miRNA可通过结合增强子,改变增强子的染色质状态,从而激活基因的转录表达 [16]。诺贝尔奖得主菲利普·夏普(Phillip Allen Sharp)最新的研究也证实miRNA激活理论 [17],说明miRNA具有双重功能,在胞质中作为负向调控因子抑制基因表达,在细胞核内作为正向调控因子激活基因的转录。多项研究证实,miRNAs在肝癌的发生、发展中发挥着重要作用,并被认为可能成为新的肝癌治疗靶点 [18]。核受体共激活因子4 (Nuclear receptor coactivator 4, NCOA4)是一种选择性货物受体,与铁蛋白自噬关系紧密。NCOA4可以直接识别和结合FTH1介导铁蛋白自噬降解,释放大量游离铁,最终引起铁死亡 [19]。据报道,NCOA4表达水平同样受细胞内铁离子水平的影响,在铁充足的条件下,NCOA4可以与HERC2稳定结合。促进NCOA4蛋白酶体转换并降低细胞内NCOA4水平,促进铁蛋白积累和铁储存,在缺铁条件下,NCOA4-HERC2结合减弱,NCOA4的蛋白酶体转换减少导致NCOA4水平升高,加快铁蛋白自噬降解,从而增加游离铁 [20]。本研究中发现,过表达miR-485-3p后,促进了HepG2细胞的生长增殖,这与之前miR-485-3p促进肝癌进展的报道相符。有意思的是,我们研究发现在索拉非尼诱导下,过表达miR-485-3p后,HepG2细胞铁死亡指标出现了升高,抑制miR-485-3p的表达后细胞铁死亡指标出现了下降。说明miR-485-3p在HepG2细胞铁死亡的过程中起到了促进作用。过表达miR-485-3p后HepG2细胞中NCOA4的表达量升高,抑制miR-485-3p的表达后NCOA4的表达量出现降低。研究证实,NCOA4是铁死亡正向调控因子,敲低NCOA4抑制了erastin诱导的铁死亡,而NCOA4的过表达促进了铁死亡 [21]。说明miR-485-3p可以正向调控NCOA4的表达影响肝癌细胞HepG2的铁死亡,这引起了我们的兴趣。我们推测miR-485-3p正向调控NCOA4的机制可能有两种。一是miR-485-3p在细胞核内与增强子结合后,激活了转录表达,使得NCOA4表达升高。二是miR-485-3p在细胞质内起作用,通过沉默或降低某种分子的表达,间接地使NCOA4表达升高。然而,由于围绕正向miRNA调控机制的研究刚刚起步,其生物学意义和具体功能仍需要进一步的研究证实。
5. 结论
综上,我们证实了miR-485-3p可以正向调控NCOA4的表达并最终影响HepG2细胞的铁死亡。但是对于miR-485-3p调控NCOA4的具体机制以及该通路是否受其他分子的调控,仍需要进一步的研究证实。我们期待更深一步的研究能为肝癌的治疗提供新的可能的方案。
基金项目
国家自然科学基金资助项目,项目编号:81802414。
NOTES
*通讯作者。