1. 引言
北美红花槭(A. rubrum L.)为无患子科(Sapindaceae)槭属(Acer L.)中的重要观赏植物,近年来,我国进行了多种源及多品种引种培育。相关研究表明,北美红花槭适于容器栽培 [1] ,但其生长受栽培基质影响 [2] ,相关基质栽培多见于国外文献,并筛选出了纯松树皮,松树皮分别与泥炭、椰壳纤维按照体积比4:1混合基质的 [2] 。并且城市污水泥、苗圃清理物等相关废弃物也可以开发为北美红花槭的栽培基质 [3] 。而且相关混配基质具有抑菌效果 [4] 。国内未见相关研究报道。
基质理化性质影响苗木根系生长,乃至影响苗木整体生长发育,探明混配基质在栽培过程中的化学性质,筛选出良好的基质配方,是支撑规模化高质量开展北美红花槭容器培育的重要前提 [5] [6] 。本文以小麦秸秆、树皮、菇渣、木屑等国内常见农林废弃物为材料开发基质配方进行北美红花槭进行栽培利用,对北美红花槭栽培过程中的基质化学指标变化进行分析,以期为北美红花槭的容器栽培及其高效培育提供支撑。也为农林废弃物的高效利用提供了重要方向。
2. 材料与方法
2.1. 试验地点
试验地点设在山东省林草种质资源中心枣园保护库,相关情况参见相关文献 [7] 。
2.2. 材料
北美红花槭无性系的规格为地径约2 cm~2.5 cm,于春季萌动之前栽植;栽培容器为25加仑的内、外容器和阻根布,阻根物质为Cu(OH)2。
对照为50 cm × 40 cm无纺布袋。
栽培基质包括:P1 (树皮过100目筛)、P2 (树皮过100目筛、树皮过50目筛1:1混合)、P3 (树皮过50目筛、菇渣3:1混合)、MO (纯棉杆)、MM1 (棉杆、菇渣1:1混合),MS (加硫棉杆),MY (棉杆、玉米秸1:1混合),MX (棉杆、小麦秸1:1混合),CM (纯木屑)和MM2 (木屑、菇渣1:1混合)。
2.3. 方法
参照文献 [8] ,进行北美红花槭的双容器栽培。其中,先用机器在试验地按照株行距1.3 m × 1.3 m进行打孔,放置外容器,铺上阻根布;然后将配好的基质配方装入内容器,并将苗木栽培至其中,栽植深度至苗木根茎处,最后将栽有苗木的内容器放入外容器中。每五株为一个处理。试验田间设计见表1。

Table 1. Field experiment design of pot-in-pot
表1. 双容器试验田间设计
参照文献 [9] 相关测定方法进行基质的化学指标测定。其中,采用电位法测定pH值,电导法测定全盐含量,重铬酸钾容重法测定有机质含量,采用H2SO4-H2O2消煮、蒸馏法测定全氮含量,采用H2SO4-H2O2消煮、钒钼黄比色法测定全磷含量,采用H2SO4-H2O2消煮、火焰光度计法测定全钾含量。相关操作步骤见文献 [9] 。
数据通过Excel与SPSS软件分析。
3. 结果分析
3.1. 栽培过程中基质有机质含量变化分析
栽培基质的有机质含量及其分解与植物吸收之间的养分平衡能力十分重要 [10] 。由图1可知,基质MM2的有机质含量持续减小,基质P1和基质MM1有机质含量先增大后减小,其余基质有机质含量均先减小后增大。除基质P1、P3、MX、CM的有机质含量大于相应原基质有机质含量外,其余基质有机质含量均不大于相应原基质有机质含量。其中基质P2的有机质含量下降最多,为19.86%。变化幅度由大地到小顺序为:P2 > MO > MM2 > CM > MM1 > MS > P3 > MX > MY > P1。
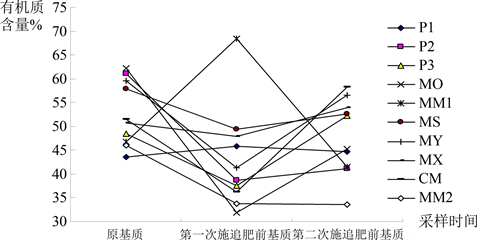
Figure 1. Variance of content of orange matter of ten substrates during planting
图1. 栽培过程中不同基质种类有机质含量变化
方差分析显示,在栽培过程中,三次取样间基质有机质含量差异未达到显著水平,说明在栽培过程中基质有机质含量变化程度较小。而十种基质间有机质含量差异也未达到显著水平,说明十种基质间有机质含量变化趋势相对一致。
3.2. 栽培过程中基质全氮含量变化分析
由图2分析可知,基质P1、P3、MM1的全氮含量变化趋势为先增大后减小;基质P2、MS、MY的全氮含量变化趋势为持续减小,其余基质全氮含量变化趋势均为先减小后增大,除基质P1、P3、MX、CM、MM2外,其余基质全氮含量均小于相应原基质全氮含量,其中基质CM的全氮含量上升最大,为1.55%。变化幅度从大到小顺序为:CM > MY > MO > MS > P3 > P2 > MM1 > P1 > MX > MM2。
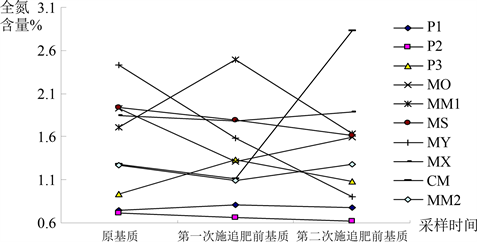
Figure 2. Variance of content of total nitrogen of ten substrates during planting
图2. 栽培过程中不同基质种类全氮含量变化
方差分析显示,栽培过程中,三次取样间基质全氮含量差异未达到显著水平,说明在栽培过程中基质全氮含量变化程度较小。而十种基质间全氮含量的差异达到显著水平,说明十种基质间全氮含量的变化趋势存在差异,但未达到极显著水平。
3.3. 栽培过程中基质全磷含量变化分析
由图3分析可知,基质P1、MO、MY的全磷含量变化趋势为持续减小,基质P3、MM1的全磷含量变化趋势为先增大后减小,其余基质全磷含量变化趋势均为先减小后增大,除基质P3、MM1、MX、CM的全磷含量高于相应原基质全磷含量外,其余基质的全磷含量均小于相应原基质全磷含量。变化幅度从大到小顺序为:MY > MX > MO > MM1 > CM > P1 > MS > P3 > P2 > MM2。
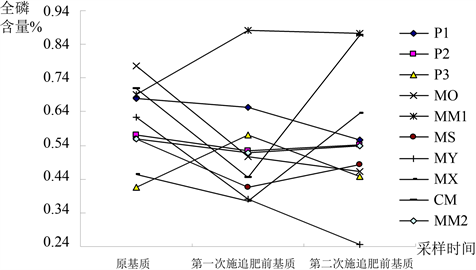
Figure 3. Variance of content of total phosphorus of ten substrates during planting
图3. 栽培过程中不同基质种类全磷含量变化
方差结果显示,在栽培过程中,三次取样间基质全磷含量差异未达到显著水平,说明在栽培过程中基质全磷含量变化程度较小。而十种基质间全磷含量差异达到显著水平,说明十种基质间全磷含量变化趋势存在差异,但未达到极显著水平。
3.4. 栽培过程中基质全钾含量变化分析
由图4分析可知,基质P2的全钾含量变化趋势为增大,然后稳定;基质P1、MM1的全钾含量变化趋势为先减小后增大,基质MX的全钾含量变化趋势持续增加,基质MM2的全钾含量变化趋势为持续增加,其余基质P3、MO、MS、MY、CM的全钾含量变化趋势为先增大后减小,基质P3、CM的全钾含量未变,基质MM1、MY的全钾含量低于相应原基质全钾含量,其余基质全钾含量均高于相应原基质全钾含量。变化幅度从大到小顺序为:MY > P2 > MS > MO > MX > MM2 > P1 > M1 > CM = P3。

图4. 栽培过程中不同基质种类全钾含量变化
方差分析显示,栽培过程中,三次取样间基质全钾含量差异未达到显著水平,说明在栽培过程中基质全钾含量变化程度较小。而十种基质间全钾含量差异达到显著水平,说明十种基质间全钾含量变化趋势存在差异,但未达到极显著水平。
3.5. 栽培过程中基质盐分含量变化分析
根系周围基质中的盐浓度决定了其养分供应的潜在能力,并且与基质的养分、栽培植物需求及其根系吸收能力等因素有关。由图5分析可知,基质P1的盐分含量变化趋势为维持不变然后下降;基质P3、MM1、MS的盐分含量变化趋势为先增大后减小,其余基质盐分含量变化趋势均持续减小,基质盐分含量均不高于相应原基质盐分含量,其中基质MY的盐分含量下降最大,为4.75%。变化幅度从大到小顺序为:P3 > MO > MM1 > MY > MM2 > CM > MX > MS > P1 > P2。

Figure 5. Variance of content of salinity of ten substrates during planting
图5. 栽培过程中不同基质种类盐分含量变化
方差分析显示,在栽培过程中,三次取样间基质盐分含量差异达到极显著水平,说明在栽培过程中基质盐类含量变化程度非常大。而十种基质间盐类含量差异未达到显著水平,说明十种基质间盐类含量变化趋势相对一致。
3.6. 栽培过程中基质pH值变化分析
栽培基质pH值与水肥灌溉、自然蒸发、栽培植物的吸收等有关,栽培基质的缓冲性能对于维持植物正常生长十分重要。由图6分析可知,基质P1、P3、MO、MY、CM的pH值变化趋势为先增大后减小;基质MM1的pH值变化趋势为先减小后增大,其余基质的pH值变化趋势均为持续减小,基质的pH值均低于相应原基质的pH值,其中基质P3的pH值下降最大,为1.02。变化幅度从大到小顺序为:P2 > MM2 > MX > CM > P1 > MY > MS > P3 > MO > MM1。
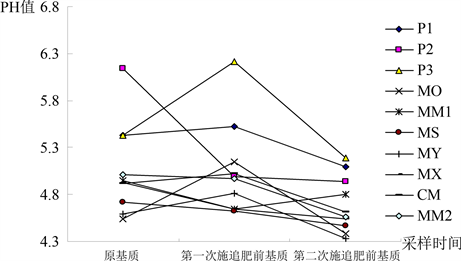
Figure 6. Variance of quantity of pH of ten substrates during planting
图6. 10种基质在栽培过程中的pH值变化
方差分析显示,在栽培过程中,三次取样间基质的pH值差异未达到显著水平,说明在栽培过程中基质pH值变化程度相对一致。而十种基质间pH值差异达到显著水平,说明十种基质间pH值变化趋势存在差异,但未达到极显著水平。
4. 结论
1) 北美红花槭双容器栽培中3个基质指标应作为基质研究重点指标。在栽培过程中,每种基质化学性质均发生了较为复杂的变化。栽培过程中,基质6个指标中变化幅度较大的指标主要是:盐分含量、全氮含量和全磷含量3个指标,而有机质含量、全钾含量和pH值3个指标变化幅度相对较小。在北美红花槭双容器栽培过程中,继续深入开展十种基质性质变化研究时,应以前3个指标为主,后3个指标为辅。
2) 北美红花槭双容器栽培中基质化学性质综合稳定性为基质筛选的重要参考。每次取样的十种基质各相应指标之间,以及三次样品之间的相应指标存在较大差异,部分达到显著水平,在栽培过程中每种基质的化学性质均发生了较为复杂的变化。十种基质化学性质稳定性依次减弱顺序为:P1 > MS > P3 > MM2 > MM1 > MX > P2 > MO > CM > MY,基质P1的化学性质稳定性最好,基质MS次之,基质MM2再次;基质MY稳定性较差。P1 (树皮过100目筛)、MS (加硫棉杆)、MM2 (木屑、菇渣1:1混合)是北美红花槭双容器栽培的重要候选基质,应进一步结合基质理化指标及栽培植物生长性状进行综合筛选基质配方。
基金项目
中央财政林业改革发展资金项目“槭属主要树种繁育及栽培技术推广示范(鲁[2023] TG018号)”和山东省重点研发计划(重大科技创新工程)项目“珍贵用材树种种质资源挖掘与精准鉴定”(2021LZGC02304)。
NOTES
*通讯作者。