1. 引言
杀伤性T细胞(CTL)被认为是抗肿瘤的最主要细胞 [1] 。基于CTL的肿瘤免疫疗法在临床上已取得巨大成功,如CAR-T技术通过向机体回输特异性杀伤T细胞对抗肿瘤。然而,据统计只有约20%的癌症患者可以从中获益 [1] ,且仅限于少数癌症尤其是血液型肿瘤。在实体瘤中,疗效不佳。其它技术如免疫检查点阻断(如anti-PD1)、治疗性疫苗等新型技术不断被开发用于恢复T细胞对肿瘤细胞的识别及增加T细胞数量 [1] [2] [3] [4] 。然而,另外一个问题也不容忽视,即CTL自身在肿瘤微环境(TME)诱导下的功能失调甚至功能丧失问题。研究显示原因归因于T细胞在TME下常常功能失调甚至功能丧失。除了TME中大量抑制性受体、因子等因素,近来免疫学领域越来越多的证据显示:肿瘤代谢失调是造成T细胞功能失调的重要源头因素 [1] 。肿瘤代谢失调导致其对营养物质(如氨基酸、脂肪酸等)的需求大量增加,因而致使瘤内免疫细胞包括T细胞的营养匮乏进而功能失调 [5] [6] [7] [8] [9] 。
一系列氨基酸类营养物质,包括甲硫氨酸、精氨酸、丝氨酸、甘氨酸等被陆续发现具有代谢调控作用,相关研究持续增加 [10] 。例如,邹伟平团队报道:甲硫氨酸同样可以强化T细胞活性:补充甲硫氨酸可使T细胞的凋亡率减少近50%,相应促炎细胞因子(TNF-α)活性也提高了近30% [11] 。最近,Geiger团队报道:在瘤内补充精氨酸后,可显著增加瘤内CD8+ T及CD4+ T细胞浸润数目(各增加近50%) [12] 。
虽然氨基酸在肿瘤代谢免疫治疗领域极具发展潜力,其递送效率却普遍较为低下。有几个突出表现:(1) 在氨基酸代谢治疗研究中,大多采用大剂量口服给药的方式,如在荷瘤小鼠中,每日口服精氨酸的剂量竟达到了1.5~2 g/kg体重 [12] ,若加之于人,75 kg体重的患者需每日吞服112.5~150 g精氨酸,这几乎无法实现。这一点,在最近的引领性工作中,也已被明确指出是氨基酸代谢调控走向临床的瓶颈 [12] ;(2) 即便是瘤内给药方式,也必需高剂量给药。Geiger团队指出:由于瘤内注射存在迅速扩散问题,即便采用这种极端给药方式,有些氨基酸即使以其饱和浓度瘤内给药,也无法有效发挥作用 [12] 。
在亲水性小分子药物递送方面,纳米递送技术,例如脂质体、囊泡等的成功经验,对于氨基酸递送有重要启示作用。其具备负载通用性上的可行性及递送优势,包括EPR靶向效应 [13] ,血液循环时间延长 [14] 等。尽管传统纳米递送载体存在优势,但难以将其直接用于氨基酸的递送。例如,在亲水性分子纳米递送技术中,脂质体或聚合物囊泡的药物包封率较低,通常小于5% [15] 。综上考虑,探索直接将氨基酸进行纳米化组装的策略成为重要的潜力解决方案。但挑战是,如何将高亲水性的氨基酸在水溶液条件下组装到一起,并能够响应肿瘤微环境释放。
本项目提出一种氨基酸纳米组装策略,即不借助现有纳米载体,而通过挖掘氨基酸纳米组装潜力,构建一种“自纳米化”氨基酸颗粒。启发于儿茶醛与离子的MOF组装 [16] ,我们意识到儿茶醛结构上的酚羟基与离子可进行相互作用。那么是否可以引入离子作用诱导氨基酸组装呢?为了探索这种可行性,我们进行了一系列尝试。以甲硫氨酸、精氨酸、丝氨酸为例,我们发现:当儿茶醛与氨基酸以席夫碱键合后(氨基酸“标签化”),可与Fe3+组装成为纳米颗粒。这种氨基酸“标签化”组装系统可实现:(1) 氨基酸高负载(精氨酸负载率近40%),且能实现肿瘤微环境酸响应性释放的目的(儿茶醛与氨基酸之间形成的席夫碱键具有酸响应性);(2) 可有效提高T细胞的活力;(3) 令我们鼓舞的是:所制备出的氨基酸纳米颗粒自带光热效应(多酚类结构与离子形成的MOF组装体常具此效应),可用于刺激肿瘤细胞发生ICD效应(免疫原性增强),诱导T细胞产生。
2. 材料与方法
2.1. 氨基酸“标签化”组装方法的构建
1) 原儿茶醛标签化氨基酸的合成:利用原儿茶醛的醛基与氨基酸结构中的伯氨基在中性或弱碱条件下形成可逆的共价化学键(席夫碱),得到原儿茶醛标签化氨基酸。
2) 氨基酸“标签化”组装:利用金属离子(Fe3+)与标签化氨基酸中酚羟基可通过配位键的形式实现动态组装,得到氨基酸颗粒。通过马尔文粒度仪,TEM等表征其尺寸,形貌;利用808激光器和热成像仪考察所制得的氨基酸纳米粒的光热转化性能。
2.2. 实验动物
BALB/c雌性小鼠(上海斯莱克实验动物公司) (10只,均为雌性5~6周龄,体重18~21 g)根据国家动物福利要求,所有小鼠均在同济大学SPF级动物实验室喂养SPF级饲料和纯净水,室温维持在20℃~22℃。
2.3. 氨基酸纳米粒安全性及抑瘤效应
1) 安全性:动物模型选择Balb/c雌性小鼠,尾静脉给予氨基酸纳米粒,HE染色观察各脏器病理变化情况,血清生化指标测定肝肾功能。
2) 抑瘤效果:6周龄BALB/c雌性小鼠右侧背部种植肿瘤细胞,注射8 × l05的CT-26细胞悬液,观察。待小鼠肿瘤长至一定大小后(50~60 mm3),将其随机分为以上3组,分别为:PBS组,Fe3+与原儿茶醛组装而得的纳米粒联合低温光热组(NPs+L),氨基酸纳米粒联合低温光热组(MetNPs+L)。尾静脉注射各组纳米颗粒(180~200 μl,甲硫氨酸浓度:300 μg/ml)。测量并记录小鼠肿瘤大小以及小鼠体重变化(计第1, 3, 5, 7, 9, 11, 13, 15天数据),预计15天之后,猝死小鼠,取各组肿瘤、脾脏用于免疫测试。其中,给药频率为:第0天;第2天;第5天;第8天;第11天,且给药之后,进行光照处理。光照温度:43℃~45℃。光照时间长短:8 min;光照时间点:给药后约2 h。
3) 利用光声(PA)成像装置对氨基酸颗粒在荷瘤小鼠体内的光声特性进行评估。
2.4. 免疫机制评价
治疗结束后处死各组小鼠,解剖获取小鼠肿瘤组织和脾脏进行免疫分析。流式细胞术分析其中肿瘤组织中CD8+ T细胞数量以及抑制性微环境的改善,脾脏T细胞类型及比例变化情况。(1) 肿瘤内免疫效应:分离肿瘤组织的淋巴细胞:(i) T细胞:anti-CD3-APC,anti-CD4-FITC,anti-CD8-PEcy7染色;(ii) 巨噬细胞:anti-CD11b-APC;anti-F4/80-PE-CY7;anti-CD80-FITC染色;(2) 脾脏免疫效应:分离出脾脏组织中的淋巴细胞:T细胞:anti-CD45-PE;anti-CD3-APC,anti-CD4-FITC,anti-CD8-PEcy7染色。
3. 结果
3.1. 氨基酸“标签化”纳米组装的探索过程及构建
为了实现氨基酸高效负载的方法,前期,我们直接将各种生物相容性良好的离子(Cu2+和Fe3+)与氨基酸(以甲硫氨酸(Met)为代表)进行配位组装。结果发现:Cu2+和Fe3+与氨基酸羧基的组装驱动力极难控制,所形成的氨基酸离子组装体以沉淀形式存在,尺寸不可控(图1(A)~(C))。因此考虑引入其它作用力,使组装驱动力可控。鉴于儿茶醛与离子的极易可控的作用力(即极容易组装成纳米粒子),我们进一步做了探索:首先通过席夫碱反应,在氨基酸分子表面修饰上标签分子–儿茶醛(标签化)。此后,发现Fe3+可以诱

Figure 1. The labeling assembly of amino acids (e.g., methionine, arginine): (A) TEM photograph of Cu-Met assembly; (B) TEM photograph of Fe-Met assembly; (C) The particle size of Fe-Met assembly ; (D) The assembly process of labelled amino acids and the corresponding TEM; (E)The particle size of amino acids nanoparticles; (F) The photothermal conversion performance of amino acids nanoparticles; (G) The photothermal cycles of amino acids nanoparticles
图1. 标签化氨基酸纳米化组装过程(以甲硫氨酸、精氨酸为例):(A) Cu-Met组装体电镜;(B) Fe-Met组装体电镜;(C) Fe-Met组装体粒径;(D) 标签化氨基酸纳米组装过程及电镜;(E) 氨基酸纳米颗粒粒径;(F) 氨基酸纳米粒光热性能;(G) 光热循环
导标签化氨酸的纳米组装,并且该方法可适合其他氨基酸(如精氨酸) (图1(D))。该方法制备的甲硫氨酸纳米颗粒,呈球型,粒径约60 nm;精氨酸纳米粒呈梭形,粒径约110 nm (图1(E))。其次。此外,氨基酸经标签化纳米组装后自带光热效应,且载体光热性能较为稳定,有利于发挥载体的ICD效应(图1(F),图1(G))。
3.2. 氨基酸“标签化”纳米组装系统体内抑瘤效果评价
首先,为了更好获知氨基酸纳米粒在小鼠肿瘤组织中的富集情况,我们评价了纳米粒的体内光声行为。结果显示:在静脉给药2 h后,氨基酸纳米粒在肿瘤组织中的富集信号最强(图2(C))。以此时间点作为低温光热治疗的光照时间点,我们发现:氨基酸纳米粒组随着808激光的照射,小鼠肿瘤组织表面的温度较PBS组显著升高(图2(A),图2(B)),从中可以看出所制得的氨基酸纳米粒具备良好的光热转换性能。在此基础上,我们考察了氨基酸纳米粒联合低温光热的抑瘤效果。结果显示:经过治疗后,氨基酸纳米粒联合低温光热组的抑瘤效果较PBS以及低温光热组而言,抑瘤水平显著提升(图2(E),图2(F))。此外,各治疗组小鼠体重均无明显变化(图2(G)),提示纳米粒的生物安全性良好。
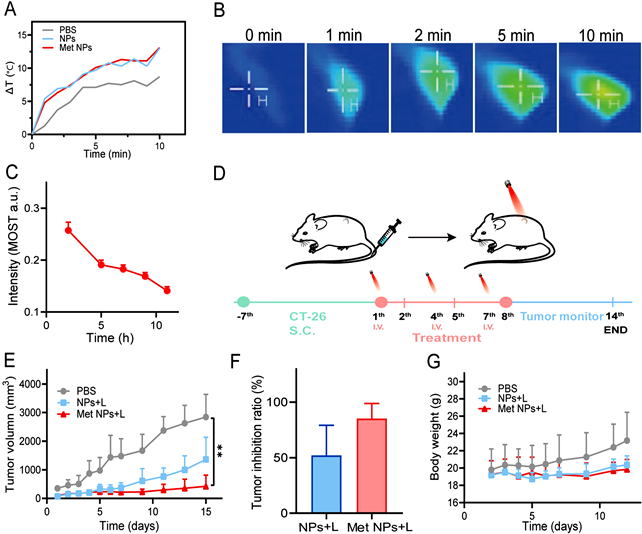
Figure 2. The in vivo photothermal, photoacoustic, and therapeutic performance of amino acids particles via labeling assembly. (A) Temperature increasing profiles of the tumor sites at 2 h after administration (n = 3); (B) The corresponding thermal imaging of (A); (C) Tumor photoacoustic intensity measured at different time points after intravenous injection (n = 3); (D) Schematic illustration of the in vivo experimental design; (E) Tumor growth curves of CT26 tumor-bearing BALB/c mice in different treatment groups (n = 3); (F) Tumor inhibition ratio of CT26 tumor-bearing BALB/c mice in different treatment groups; (G) Body weights of CT26 tumor-bearing mice treated with different groups (n = 3)
图2. 氨基酸“标签化”纳米组装系统体内光热、光声成像、及抑瘤效果评价。(A) 给药2 h后,肿瘤部位温度升高曲线(n = 3);(B) 对应的(A)中热成像图;(C) 给药后不同时间点,肿瘤光声信号的变化图(n = 3);(D) 体内治疗实验设计方案;(E) 荷瘤小鼠中肿瘤尺寸随时间的变化图(n = 3);(F) 各治疗组肿瘤抑制率;(G) 荷瘤小鼠体重随时间的变化图(n = 3)
3.3. 氨基酸“标签化”纳米组装系统抗肿瘤机制探索
为了进一步探索氨基酸“标签化”纳米系统体内抗肿瘤的机制,我们测定了肿瘤组织以及脾脏组织中免疫细胞的表达丰度。研究结果表明:较PBS组和低温光热组而言,氨基酸纳米粒在低温光热的辅助下,可显著增加瘤内CD8+ T细胞、M1型促炎巨噬细胞的表达丰度(图3(A)~(D))。从中可以看出:在低温光热辅助下,氨基酸纳米粒可显著增强了抗肿瘤的免疫治疗效应。此外,在脾脏免疫细胞中,氨基酸纳米粒在低温光热的辅助下也显示出最高的CD8+ T/CD4+ T细胞的比例。表明:该治疗组同时增强了小鼠的全身免疫能力(图3(E),图3(F))。
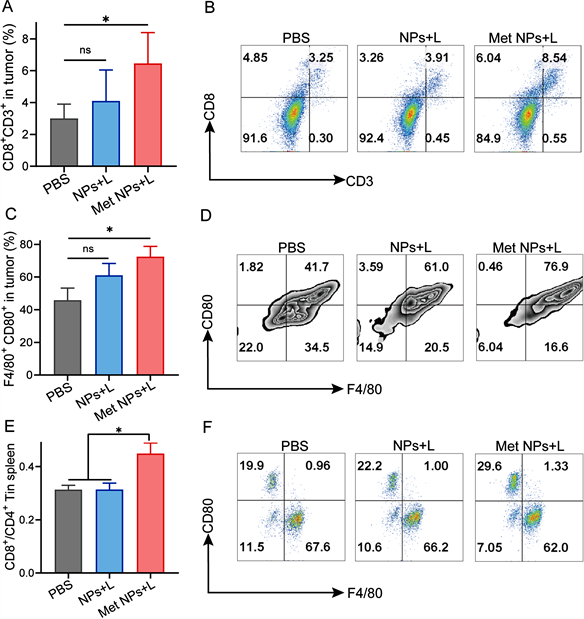
Figure 3. The in vivo antitumor immunometabolic mechanism of amino acids particles via labeling assembly. ((A), (B)) Representative flow cytometry plots and analysis of intratumoral infiltration of CD3+CD8+ T cells; ((C), (D)) Representative flow cytometry plots and analysis of intratumoral infiltration of M1 macrophages; ((E), (F)) Representative flow cytometry plots and analysis of ratio of CD8+/CD4+ T cells in spleen
图3. 氨基酸“标签化”纳米组装系统体内抗肿瘤机制评价。((A), (B)) 各治疗组肿瘤组织中CD3+CD8+ T细胞占比的统计图及流式图;((C), (D)) 各治疗组肿瘤组织中M1型巨噬细胞占比的统计图及流式图;((E), (F)) 各治疗组脾脏CD8+ T/CD4+ T细胞比例的统计图及流式图
3.4. 氨基酸“标签化”纳米组装系统的安全性评价
在抑瘤实验中,不同处理组的小鼠体重均无明显变化,反映出氨基酸纳米组装系统体内治疗的良好生物相容性。在此基础上,我们进一步进行组织病理学试验来。研究结果显示:在各组治疗后,HE染色的主要脏器(心、肝、脾、肺、肾)均未见明显炎症浸润或病理损伤(图4(A))。从中表明:氨基酸纳米粒在接受近红外激光后表现出良好的生物相容性。血清生化分析结果显示:血液中谷草/谷丙转氨酶含量正常表明肝脏无炎症发生;碱性磷酸酶正常说明小鼠肝胆系统无损伤;血肌酐和尿素氮浓度正常无变化说明肾功能正常无损伤(图4(B))。基于此,氨基酸纳米粒联合低温光热的治疗方式是一种安全无毒的肿瘤治疗策略。
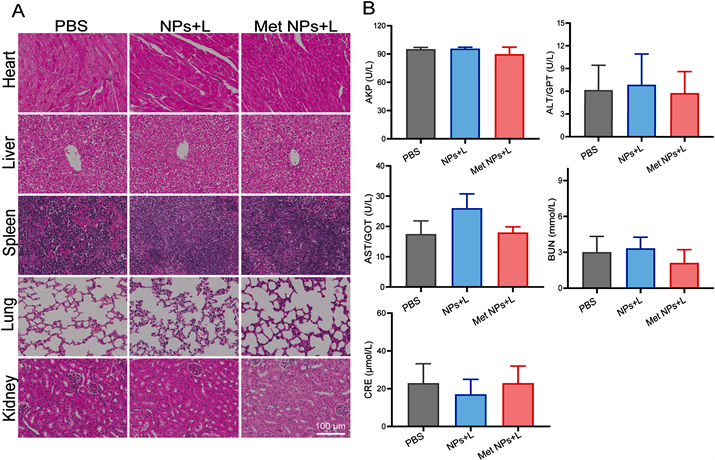
Figure 4. The safety of amino acids particles via labeling assembly. (A) Representative HE staining of vital organs after different treatments; (B) The determination of serum biochemistry parameters including alanine aminotransferase (ALT), alkaline phosphatase (AKP), creatinine (CRE), aspartate aminotransferase (AST), and blood urea nitrogen (BUN)
图4. 氨基酸“标签化”纳米组装系统体内安全性评价。(A) 不同组小鼠主要脏器的HE染色图像;(B) 各组小鼠血清中丙氨酸转氨酶(ALT)、碱性磷酸酶(AKP)、肌酐(CRE)、天冬氨酸转氨酶(AST)和尿素氮(BUN)等
4. 讨论
综上所述,我们发展了一种氨基酸标签组装的策略,可驱动亲水性氨基酸自组装成纳米颗粒,实现了氨基酸高效负载目标(如精氨酸、甲硫氨酸负载率可达40%)。氨基酸原儿茶醛标签化,以席夫碱键合方式赋予了氨基酸纳米粒肿瘤微环境响应释放特性,以此调控肿瘤组织中CD8+ T细胞的活力。其次,Fe-多酚组装介导的光热特性可有效诱导肿瘤细胞发生免疫原性死亡,从而促进T细胞更多浸润至肿瘤组织。值得一提的是,这种氨基酸标签化纳米组装系统,在低温光热(43℃)辅助下,氨基酸纳米粒可有效诱导CD8+ T淋巴细胞浸润至肿瘤组织(2.5倍高于PBS组),肿瘤抑制率高达85%。本项目的实施不仅为氨基酸递送瓶颈提供解决思路,更为氨基酸代谢免疫治疗提供潜力技术。
与已知的免疫代谢纳米系统相比,这种氨基酸标签组装方法探索出了氨基酸的自组装潜力,实现了高效负载和诱导得到了光热特性。这种氨基酸标签组装策略不仅有望激活其他免疫细胞(如巨噬细胞,NK细胞),也有可能扩展至其他生物分子(多肽和蛋白质),以解决其应用瓶颈。
致谢
感谢国家自然基金委员会对这篇文章的支持与帮助(No. 32271387)。
NOTES
*通讯作者。