1. 引言
葡萄糖 [1] 是构成人体最基本的化学物质之一。是为有机体提供能量的原料。基于葡萄糖氧化酶的生物传感器在食品工业、生物医学、生化工业上均有重要的用途。早在1962年,Clark和Lyons [2] 就提出了葡萄糖生物传感器的原理:当葡萄糖还原以后,还原态葡萄糖氧化酶的氧化还原活性中心在酶分子内部,受蛋白质的包围,不易直接与常规电极交换电子,因而得不到直接可测量的电信号。因此人们常根据此反应过程中氧气的消耗量或者生成物H2O2的生成量间接测定葡萄糖的含量。但是,该方法中由于大气中氧分压的变化会导致溶液中溶解氧浓度的变化,从而影响测定的准确性;而在传统的固体电极上,H2O2氧化需要很高的过电位(>0.6 V vs. Ag/AgCl)。在如此高的电位下进行氧化测定,试样中共存的其它电活性物质,如:抗坏血酸和尿酸等,也可以在此电位下氧化而产生氧化电流,给测定带来干扰,因此该方法的灵敏度和选择性相对较差。因此,近年来基于媒介体电极的葡萄糖生物传感器得到广泛的重视 [3] - [6] 。
二茂铁(Ferrocene,以下简称Fc)及其衍生物 [7] - [10] 是一类富电子体系, 具有氧化还原可逆性、芳香性、低毒性、疏水性等特点,其修饰电极膜中有氧化还原中心,因此在电位扫描过程中能发生氧化或还原反应,促进电子的转移速率。张校刚 [10] 等人用分子自组装技术在金电极表面形成二茂铁乙烯基吡啶硫醇单分子膜。经过分子自组装法制得的二茂铁及其衍生物修饰电极,表面结构高度有序,稳定性好。李亚卓 [11] 等人将聚烯丙胺基二茂铁与聚苯乙烯磺酸盐生成的离子配合物用乙醇溶解后掺杂到溶胶–凝胶中,将此溶液滴涂在玻碳电极表面。Koide等人 [12] 通过羧基二茂铁上的羧基与凝胶聚烯丙胺上的氨基反应制成高分子媒介体,然后以共价键连到葡萄糖氧化酶上,得到介质改良的酶电极。Gass等人 [13] 通过媒介体吸附的方法制备了二茂铁媒介的葡萄糖氧化酶电极所以它们具有非常好的电化学活性和电催化功能,广泛地应用于电化学和生物传感器的制备。
有序介孔碳自1999年 [14] 首次被合成出来以来,由于其一系列独特的性质 [14] - [16] ,如巨大的比表面积、狭窄的孔径分布、维度有序等等,己经引起了科学工作者极大的兴趣。介孔碳能提高电子传递速率,人们利用有序介孔碳修饰电极已经成功地检测了许多生物分子,如:NADH、抗坏血酸、多巴胺、过氧化氢等 [17] - [22] 。
在本论文中,我们利用有序介孔碳的高比表面积,采用浸渍法将葡萄糖氧化酶(Glucose Oxidase,简称GOD)吸附固定在有序介孔碳修饰电极表面,然后利用Nafion溶液将媒介体二茂铁修饰到介孔碳电极表面,便制得了一种新的电流型葡萄糖生物传感器,并详细研究了它的性能。
2. 实验部分
2.1. 试剂与仪器
葡萄糖氧化酶(GOD, E.C. 1.1.3.4, 151 U/mg,来源于黑曲霉)购于美国Sigma公司。有序介孔碳(OMC)由本实验室提供。β-D-葡萄糖,抗坏血酸(AA),尿酸(UA),多巴胺(DA)均购于Sigma公司。二茂铁购于北京化学试剂厂。β-D-葡萄糖储备溶液使用前需要在4℃环境中放置24小时,使其达到变旋平衡后再使用。其他试剂均为分析纯。实验用水为二次蒸馏水。整个实验均在室温下进行。有序介孔碳(OMC)由本实验室自己合成 [14] [23] 。
电化学实验采用CHI660C型电化学工作站(上海辰华仪器公司);标准三电极体系:Fc/GOD/OMC修饰的玻碳电极为工作电极,Ag/AgCl (3 M KCl)为参比电极,铂丝为对电极。X射线粉末衍射数据在Siemens D5005衍射仪上收集。氮气吸附/脱附于液氮温度下(77 K)在美国ASAP 2010分析仪上测得。透射电镜(TEM)照片在日本JEOL JEM2011型高分辨透射电镜于200 kV下获得。拉曼光谱在英国Renishaw-1000型拉曼光谱仪上收集。
2.2. 修饰电极的制备
将玻碳电极分别在湿润的金相砂纸和α-Al2O3抛光成镜面,二次蒸馏水超声清洗,经铁氰化钾溶液校准,在丙酮和二次水中各超声3 min后备用。将一定量有序介孔碳超声分散在N,N-二甲基甲酰胺(DMF)中,制得0.5 mg/mL的OMC分散液。用微量注射器取5 μL此分散液修饰于处理好的玻碳电极表面,用红外灯烘干约15 min,得到有序介孔碳修饰电极(OMC/GCE)。
制备10 mg/mL的GOD Na2HPO4-KH2PO4溶液中(0.1 M, pH 7.0)。将OMC/GCE电极于4℃环境中在上述GOD溶液中浸泡约20 h后,取出,然后在其表面滴加2 μL 0.5% Nafion溶液,自然晾干,最后在修饰电极表面滴涂5 μL 0.05 mol/L的二茂铁的丙酮溶液,利用Nafion与二茂铁之间的静电吸附作用将二茂铁修饰到电极上。待电极自然晾干后便得到了包含GOD的有序介孔碳修饰电极。本文中我们用Fc/GOD/OMC/GCE来表示该修饰电极。
3. 结果与讨论
3.1. 有序介孔碳的表征
我们采用X 射线粉末衍射法、氮气等温吸附法、拉曼光谱测定法以及透射电镜等手段对合成的有序介孔碳OMC进行一系列表征。
如图1(a)所示为有序介孔碳的X射线粉末衍射图。从图中我们可以看到,在(100)、(110)和(220)面上有三个较强的布拉格衍射峰,表明有序介孔碳的碳孔道为长程高度有序的六方形介观结构。并且通过与SBA-15的XRD衍射图相比较,可知制备的OMC仍然保持了类似SBA-15的典型六方孔道结构。这是因为在OMC的合成过程中,碳化和去模板以后,介孔碳结构与原来的SBA-15模板是完全对称的,就好像被复制了一样。这一点与第一章中的理论是相符合的。
图1(b)所示为OMC与SBA-15的氮气等温吸附–脱附曲线。比表面积BET和孔体积BJH分别根据Barrett-Emmett-Tellter公式和 Barrett-Joyner-Halanda模型由吸附曲线计算得到。其中BET比表面积是由相对压力在0.04到0.3之间的吸附数据计算得到。而总孔容Vt是由相对压力在0~3的总吸附量求得。经过计算,OMC的BET面积900 m2/g,孔径4.5 nm,孔体积1.29 cm3/g。因而可以预计其含有更多的表面活性位可以吸附蛋白质分子,有利于提高吸附量。而SBA-15的BET面积607 m2/g,孔径5.4 nm,孔体积0.96 cm3/g。


 (a) (b) (c)
(a) (b) (c)
Figure 1. (a) X-ray powder diffraction patterns of CMK-3 and SBA-15; (b) N2 adsorption-desorption isotherm for CMK-3 and SBA-15; (c) Raman spectra for CMK-3
图1. (a) CMK-3和SBA-15的X 射线粉末衍射图;(b) CMK-3 and SBA-15的氮气等温吸附图;(c) CMK-3的拉曼光谱图
图1(c)为有序介孔碳的拉曼光谱图。从中我们可以看出它们均具有两峰。位置在1680 cm−1左右的是G峰,在1357 cm−1左右的是D峰,D键与G键的相对强度比值(ID/IG)与石墨碳层内的缺陷点位的数量成正比 [24] 。经计算可知OMC的拉曼光谱比值约为0.903。根据文献 [25] [26] 可知在OMC表面有很多的缺陷。
图2是有序介孔碳材料的TEM图。从TEM照片图中可以看出,有序介孔碳呈现出有序的纳米棒阵列结构。根据图中标尺,可估算其孔径在5 nm左右,为典型的有序介孔结构,这与XRD测试结果吻合。由第二章扫描电镜(SEM)图片显示,在有序介孔碳材料薄膜中有许多裂缝,这使得其孔道开放性提高,可能更加有利于生物分子在薄膜中的扩散和传输。这些结构特征使有序介孔碳材料薄膜可以有效地固定葡萄糖氧化酶等生物分子。
3.2. OMC/GCE的电化学行为
在本文中采用5 mmol/L的铁氰化钾溶液作为氧化还原体系,在20 mV/s的扫描速度下分别得到了OMC/GCE和裸GCE的循环伏安图(如图3)。通过Randles-Sevcik equation方程可知,Ip = 2.69 × 10−5AD1/ 2n3/2v1/2c,n是氧化还原反应过程中参与的电子数,A是电活性表面区域的面积(cm2),D是粒子在溶液中的扩散系数(cm2/s)。根据上述方程计算得到,OMC/GC电极的电活性面积的平均值为0.108 cm2,而裸GCE电极的电活性面积约为0.076 cm2。表面经过有序介孔碳修饰后的电极具有较高的电活性面积,再加上它本身又具有大的比表面积,因此可以有效吸附GOD分子。
3.3. Fc/GOD/OMC/GCE的电化学行为
由于Nafion独特的离子交换和生物兼容性,被广泛用作修饰电极和构建电化学传感器的材料 [27] [28] 。因此我们在葡萄糖氧化酶与二茂铁中间覆盖了一薄层Nafion溶液,一方面可以防止葡萄糖氧化酶在电极表面的脱落,另一方面由于Nafion分子中含有负电荷的-SO3基团,是一种含电离基团的全氟化聚合物,根据静电作用原理,会吸引带正电荷的铁离子,因此可以更好地将二茂铁修饰到电极表面上来,并且Nafion膜性质稳定。在这里Nafion薄层相当于起着“导线”的作用,加速电子的转移。图4所示为Fc/GOD/ OMC/GCE电极在Na2HPO4-KH2PO4缓冲溶液中(0.1 M, pH 7.0)的循环伏安图。
从图4上我们可以清楚地观察到两对明显的氧化还原峰。在−0.45 V和−0.54 V处出现了一对可逆的氧化还原峰,根据文献我们认为这是由GOD产生的峰。而+0.3 V左右出现的这对则是二茂铁在修饰电极表面产生的氧化还原峰。图4说明葡萄糖氧化酶和二茂铁已经成功地固定在了OMC/GCE表面。

Figure 3. CVs obtained at GCE (1) and OMC/GCE (2) electrodes in 5 mmol/L K3Fe(CN)6/0.1 mol/L KCl solution at a scan rate of 50 mV/s
图3. GCE (1)和OMC/GCE (2)在5 mmol/L铁氰化钾和0.1 mol/L氯化钾的混合溶液中的循环伏安图,扫速为50 mV/s

Figure 4. CV of Fc/GOD/OMC/GCE electrode in 0.1 M PBS (pH 7.0). Scan rate: 100 mV/s
图4. Fc/GOD/OMC/GCE在pH = 7.0的0.1 M磷酸缓冲溶液中的循环伏安图,扫速为100 mV/s
3.4. 扫速对Fc/GOD/OMC/GCE的影响
图5是Fc/GOD/OMC/GCE电极在磷酸盐缓冲液(0.1 M, pH 7.0)中不同扫速下的循环伏安图。由图5可见,在10~200 mV/s扫速范围内,随着扫描速度的增加,所有的氧化还原峰电流均增大,而氧化还原峰电位基本不随扫速的增加而改变,峰电位之差(DEp)约为65 mV,与单电子反应的理论值比较接近。表面该修饰电极具有良好的氧化还原可逆性。另外我们发现,在10~200 mV/s的扫速范围内,GOD的峰电流与扫速的平方根成正比。如图6所示。线性回归方程为I pa = −7.02 × 10−6 + 7.67 × 10−6 v1/2 (I: A, v: mV/s),

Figure 5. CVs of Fc/GOD/OMC/GCE in pH 7.0 PBS at scan rates of (from 1 to 15): 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 160, 180, 200 mV/s
图5. 在不同扫描速度下,Fc/GOD/OMC/GCE在pH = 7.0的0.1 M磷酸缓冲溶液中的循环伏安图,从里到外扫速分别为10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 160, 180, 200 mV/s

Figure 6. The relationship between the peak currents and the square root of scan rates
图6. 峰电流与扫速平方根的关系
相关系数为0.998,I pc = 6.82 × 10−6 − 7.17 × 10−6 v1/2 (I: A, v: mV/s),相关系数为0.998。表明媒介体在电极上的氧化还原过程受扩散控制,这是由于修饰在电极表面的膜具有一定的厚度,媒介体从膜中扩散到电极表面发生氧化还原反应。
3.5. pH对Fc/GOD/OMC/GCE的影响
图7为不同pH条件下Fc/GOD/OMC/GCE在磷酸盐缓冲溶液中的循环伏安图。从图7中我们可以发现,随着溶液pH的增大,所得Fc/GOD/OMC/GCE循环伏安图上的氧化还原峰电位均向负方向移动,表明其氧化还原过程伴随着质子的转移。在pH值为3.0~8.0范围内,将式量电位Formal potential [(Epa + Epc)/2]与pH作图(图8),我们发现GOD的阳极峰电位和pH值的关系为:Epa1 = 0.65 − 0.063pH,r = 0.999,其斜率为−63 mV/pH,该值与等电子等质子传递的理论值−58 pH/mV非常接近,表明GOD在修饰电极上质子数与参加反应的电子数相等。根据Randles-Sevick公式计算na = 2,所以我们认为GOD在修饰电极上反应过程为两步两电子两质子过程[29] 。
3.6. Fc/GOD/OMC/GCE对葡萄糖的催化氧化
称取0.5 g β-D-葡萄糖,配制成0.1 mol/L的葡萄糖储备溶液,该溶液于4℃环境中放置24小时使其达到变旋平衡后再使用。图9为Fc/GOD/OMC/GCE中GOD部分在不同葡萄糖浓度下的循环伏安曲线。

Figure 7. CVs of Fc/GOD/OMC/GCE in 0.1 M PBS with various pH 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, respectively. Scan rate: 100 mV/s
图7. Fc/GOD/OMC/GCE在不同pH值的0.1 M磷酸缓冲溶液中的循环伏安图,扫速为100 mV/s

Figure 8. pH dependence of E1/2 of Fc/GOD/OMC/GCE
图8. E1/2与pH的关系

Figure 9. CVs of CVs of Fc/GOD/OMC/GCE in the presence (trace 2) and absence (trace 1) of 0.5 mM glucose in 0.1 M PBS. Scan rate: 100 mV/s
图9. Fc/GOD/OMC/GCE在空白溶液(1)和含有0.5 mM葡萄糖(2)的0.1 M磷酸缓冲溶液中的循环伏安图,扫速为100 mV/s
当向溶液中加入0.5 mmol/L葡萄糖溶液后,在−0.45 V左右的氧化峰电流显著增大,还原峰电流减小,表明修饰在电极外表面的二茂铁和基底物质OMC共同在GOD的氧化还原中心和电极表面起到了电子传递的作用,同时说明该Fc/GOD/OMC/GCE电极对葡萄糖具有良好的催化氧化能力。我们认为Fc/GOD/ OMC/GCE电极对葡萄糖的催化机理如下[30] :
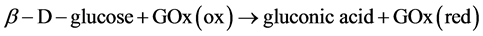


图10为Fc/GOD/OMC/GCE在−0.45 V的工作电位下对葡萄糖的计时电流曲线。随着葡萄糖的加入,Fc/GOD/OMC/GCE在5 s内即可达到最大响应电流的95%,表明该酶电极对葡萄糖的响应时间短,说明该电极响应灵敏。由标准曲线(图11)可知,Fc/GOD/OMC/GCE的线性范围为5.00 M~10.00 mM;检出限为1.03 ± 0.15 M (S/N = 3);相关系数为0.996;灵敏度为220 ± 10.4 A∙mM−1∙cm−2 (由直线部分斜率和电极的几何面积计算得出)。
3.7. Fc/GOD/OMC/GCE修饰电极的稳定性和选择性
修饰电极的稳定性和选择性是衡量生物传感器性质的一个重要标准。我们采用循环伏安法对该修饰电极的稳定性与重现性进行检测。结果表明,将Fc/GOD/OMC/GCE修饰电极置于含1 × 10−3 mmol/L葡萄糖的磷酸盐缓冲溶液中进行循环伏安扫描。经过连续扫描2小时以后,Fc/GOD/OMC/GCE修饰电极的峰电流仍然保持原来的94%。而当把Fc/GOD/OMC/GCE修饰电极放在冰箱中保存4周后,对葡萄糖的电流响应基本保持不变,这表明Fc/GOD/OMC/GCE电极稳定性良好。对 Fc/GOD/OMC/GCE进行干扰试验(结果如表1所示),待背景电流稳定后分别加入与葡萄糖相同浓度的多巴胺、尿酸和抗坏血酸,尿酸和多巴胺对响应电流几乎没有影响,不足之处是加入抗坏血酸时电流有所下降。说明该电极能很好的消除尿酸和多巴胺的干扰,我们也将对该电极进行进一步改进。
4. 结论
在本工作中,我们用吸附法将葡萄糖氧化酶固定到有序介孔碳修饰电极表面,进而制备出了一种新型的Fc/GOD/OMC/GCE修饰电极,这种电极很好地体现了有序介孔碳的优良特性,不仅保持了葡萄糖

Figure 10. Amperometric responses of the Fc/GOD/OMC/GCE with successive addition of glucose into PBS (0.1 M, pH 7.0) at an operation potential of −0.45 V
图10. Fc/GOD/OMC/GCE在连续滴加葡萄糖的磷酸缓冲溶液(0.1 M, pH = 7.0)中的计时电流响应,设置电位为−0.45 V
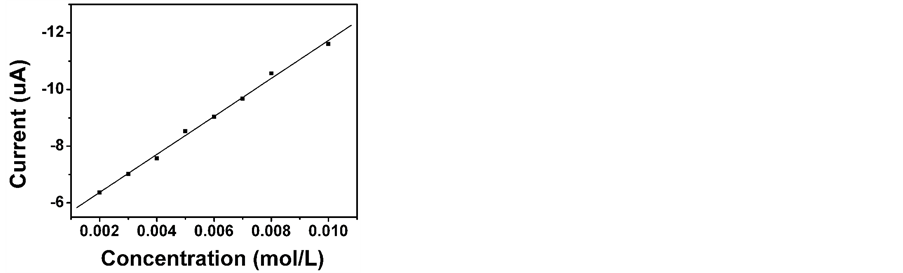
Figure 11. The calibration curve for glucose detection at the Fc/GOD/OMC/GCE at an operation potential of −0.45 V
图11. 不同浓度的葡萄糖与Fc/GOD/OMC/GCE的计时电流响应的线性关系
表1. 20 µmol·L−1的葡萄糖、尿酸、多巴胺以及抗坏血酸在0.1 M,pH 7.0的磷酸盐缓冲液中的电流–时间响应
氧化酶的生物活性,而且在二茂铁与有序介孔碳的共同作用下,所制得的Fc/GOD/OMC/GCE修饰电极对葡萄糖显示出良好的电催化性能,对葡萄糖的检测线性范围为5.00 M~10.00 mM;检出限为1.03 ± 0.15 M (S/N = 3);相关系数为0.996 (信噪比为3)。并且在检测过程中可以消除多巴胺、尿酸的干扰,但是对抗坏血酸表现出一定程度的响应。我们希望通过进一步改进,该葡萄糖氧化酶修饰电极可以在实际样品检测中得到应用。
致谢
本文获得吉林省科技厅科技发展计划项目(20130102003JC),国家大学生创新创业训练计划项目资助。