1. 引言
山竹(Garcinia mangostana L.)原产于马来群岛,在马来西亚、泰国、菲律宾、缅甸栽培较多,主要分布在我国海南保亭县和五指山市境内,其果形扁圃,外壳呈深紫色,由4片果蒂盖顶,酷似柿样,又名“莽吉柿”[1] 。目前国内市场上销售的山竹果,几乎全部从马来西亚、泰国进口,每年进口量达千万吨,山竹果制成的果汁饮料、糕点、果冻很受消费者的喜爱,其独特的药用价值也获得人们的青睐,山竹果皮和果壳中含有具有抗癌作用和抗氧化作用的氧杂蒽酮,研究人员还从山竹果皮提取物巾分离鉴定出化合物β-谷甾醇和芦丁[2] 等独特的生物活性物质,引起了医药、保健食品领域的广泛关注。从山竹种子中提炼的油脂已经被频繁用做藤黄油、起酥油的替代品,果壳中对光热稳定的红色素,还可作为天然食用色素的提取原料 [3] 。
我国市场上销售的种苗大部分从泰国、越南等地引进,单株成本高达40元,而每个山竹果中具备生活力的种子平均数量不超1个,有限的种苗数量严重制约了山竹产业的发展。通过组织培养的方法,可以在短时间内获得大量均一、优质的山竹材料,这是进行种苗繁殖的最佳选择,也是开展山竹遗传改良研究的必要步骤。目前,仅国外开展了山竹组培技术研究,且多以幼嫩叶片为外植体,采用80%酒精消毒3~5 min后再用20%次氯酸钠消毒20 min的方式作为消毒条件开展后续组培快繁研究[4] [5] ,但有关山竹多种外植体材料的系统性消毒研究尚未见报道。本文以山竹多种材料为研究对象展开消毒技术研究,以期建立山竹组培再生体系,为解决山竹种苗供应不足问题及其遗传改良研究奠定技术基础。
2. 材料与方法
2.1. 试验材料
外植体材料采于海南省农科院果树所永发试验基地和保亭县三道镇亨通公司,选择生长旺盛、健壮、无病虫害的山竹植株,取当年萌生的枝条顶芽、带腋芽茎段和叶片为外植体材料。
2.2. 培养基及培养条件
接种培养基为½MS + 6-BA 5.0 mg/L + 蔗糖30 g/L + 琼脂8 g/L,pH 5.8;培养基在0.11 MPa高压下,121℃灭菌17 min。培养温度为(25 ± 2)℃,先进行3 d的暗培养处理,然后在1500 lx光照强度下培养。
2.3. 外植体准备
将采下的外植体用洗衣粉水来清洗外植体10 min,流水冲洗30 min,修剪叶片、枝条,得到叶片、顶芽和茎段外植体。于超净工作台中进行不同消毒药剂和消毒时间的处理,处理完毕后用无菌水涮洗3次。将消毒好的外植体置于铺有无菌滤纸的盘中,吸干材料表面的水分。对于叶片,切掉四周与药液接触的部分,再切成含中脉的1.0 cm2左右的小块;对于顶芽,则切掉末端与药液接触的部分;对于茎段,则切掉两端与药液接触的部分,接入至½MS + 6-BA 5.0 mg/L的诱导培养基。
2.4. 试验方法
10%次氯酸钠溶液消毒叶片预实验表明,10~20 min叶片污染率达95%以上,存活率低于2%,由于过高的污染率和较低存活率所以本研究设置叶片消毒时长10 min以内;而消毒茎段20 min,污染率仍达100%,消毒茎段时间过长,且污染率极高,失去了培养意义,所以实验未进行10%次氯酸钠溶液消毒茎段试验。
因植物材料的不同,75%左右的酒精具有很强的穿透力和杀伤力,一般5~60 s即可杀死外植体表面绝大部分微生物,延长消毒时间会加重外植体的损伤程度,采用0.1%升汞10 min内能有效杀死外植体表面的微生物[6] [7] ,而目前外植体消毒研究中70%~75%酒精消毒时长大都设置在90 s范围内[8] [9] ,0.1%升汞消毒时长也多设置在0~15 min范围内[10] -[12] 。鉴于山竹生长在高温高湿环境中,本研究在此基础上分别设置75%酒精最高消毒时长90 s和0.1%升汞最高时长15 min。
2.4.1. 叶片单因素消毒效果试验
1) 10%次氯酸钠溶液消毒叶片效果试验
叶片10%次氯酸钠溶液消毒时长设置为0、2.5、5、7.5 min,消毒完毕后,用无菌水漂洗3次,接至培养基。每个处理8瓶,每瓶3~4个外植体,重复3次。7 d后统计污染率,30 d后统计死亡率。
2) 75%酒精消毒叶片效果试验
叶片75%酒精消毒时长设置为0、30、60、90 s,消毒完毕后,用无菌水漂洗3次,接至培养基。每个处理8瓶,每瓶3~4个外植体,重复3次。7 d后统计污染率,30 d后统计死亡率。
3) 0.1%升汞消毒叶片效果试验
叶片0.1%升汞消毒时长设置为0、5、10、15 min,消毒完毕后,用无菌水漂洗3次,接至培养基。每个处理8瓶,每瓶3~4个外植体,重复3次。7 d后统计污染率,30 d后统计死亡率。
2.4.2. 茎段单因素消毒效果试验
1) 75%酒精消毒茎段效果试验
茎段75%酒精消毒时长设置为0、30、60、90 s,消毒完毕后,用无菌水漂洗3次,接至培养基。每个处理8瓶,每瓶3~4个外植体,重复3次。7 d后统计污染率,30 d后统计死亡率。
2) 0.1%升汞消毒茎段效果试验
茎段0.1%升汞消毒时长设置为0、5、10、15 min,消毒完毕后,用无菌水漂洗3次,接至培养基。每个处理8瓶,每瓶3~4个外植体,重复3次。7 d后统计污染率,30 d后统计死亡率。
2.4.3. 影响消毒效果因素的正交试验设计
在前期单因素试验处理基础上,试验进一步开展了针对不同外植体类型的不同消毒药剂和消毒时间的L16(44)正交试验。
设定外植体类型(A)、75%酒精消毒时长(B)、10%次氯酸钠溶液消毒时长(C)和0.1%升汞消毒时长(D)4个因素。
各因素水平见表1,参考实验前期单因素优化实验数据,选用L16(44)正交试验表见表2进行试验,每个处理重复3次,每重复接种20~30个外植体。
2.5. 数据统计与分析
外植体接种7 d后统计污染率,30 d后统计死亡率。所有百分数经平方根反正弦化ASIN(SQRT(X))、个数经平方根转化SQRT(X),采用SPSS分析软件进行方差分析(ANOVA)和Duncan多重比较(P = 0.05)。文中数据为未转化数据均值。

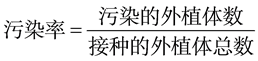

Table 1. Levels of factors for orthogonal experimental design method
表1. 正交试验各因素水平

Table 2. Orthogonal experiment of L16(44)
表2. L16(44)正交实验表
3. 结果与分析
3.1. 10%次氯酸钠溶液消毒叶片效果
由表3可知,消毒时长0~5 min范围内,叶片外植体污染率逐渐下降,消毒时长达5 min时,污染率达到最小值90.66%,存活率达到最高值7.44%;消毒时长5~7.5 min范围内,污染率则显著升高,达到96.51%,存活率下降至3.49%。分析结果可知,10%次氯酸钠作为山竹叶片消毒剂,其污染率达90%以上,存活率最高为7.44%左右,以10%次氯酸钠溶液作为外植体消毒剂效果不理想。
3.2. 75%酒精消毒叶片效果
由表4可知,酒精消毒时间在30~90 s内,叶片污染率呈逐渐下降的趋势,存活率呈逐渐上升的趋势。消毒时间在30~90 s内,三个处理间的污染率和存活率变化不显著。不同处理间污染率仍高达近90%,与10%次氯酸钠处理效果相近,所以采用单一的酒精消毒效果也不是十分理想。
3.3. 0.1%升汞消毒叶片效果
试验结果表明(见表5),对于叶片外植体采用0.1%升汞消毒可以达到很好的效果。随着消毒时间的延长,外植体污染率呈逐渐下降的趋势,存活率呈逐渐上升趋势,消毒时长达10 min后,污染率和存活率即达到了稳定状态(10 min和15 min两个处理的污染率、存活率无显著差异)。所以,消毒时长达到10~15 min时,污染率和存活率两指标达到最佳值,污染率29.28%~34.47%,存活率为65.53%~70.72%。采用0.1%升汞对叶片进行消毒,适宜的消毒时长可维持在10~15 min左右。
3.4. 75%酒精消毒茎段效果
由表6可见,当用茎段作为外植体,增大了表面消毒难度。采用75%酒精消毒时长在1 min以内,并不能显著改善外植体污染状况,当消毒时长达90 s污染率才显著降低,但污染率仍高达87.47%;而各个处理间的存活率差异不明显。结果表明,采用单一的酒精作为茎段消毒剂,并不能达到较佳效果。

Table 3. Disinfection effects of 10% sodium hypochlorite of leaves
表3. 10%次氯酸钠溶液消毒叶片效果
注:表中显著性水准为0.05。

Table 4. Disinfection effects of 75% ethyl alcohol of leaves
表4. 75%酒精消毒叶片效果
注:表中显著性水准为0.05。
3.5. 0.1%升汞消毒茎段效果
由表7可见,相对叶片来说,采用升汞消毒效果不理想。消毒时间小于10 min,外植体全部污染,当消毒时间达到15 min,污染率下降至86.51%,外植体存活率仅为8.19%,污染率得到了一定程度的控制,但存活率仅为8.19%。所以采用单一的升汞对茎段进行消毒,并不能达到良好效果。
3.6. 消毒效果影响因素的正交试验
16个不同处理间在污染率和存活率指标上均存在显著差异(见表8)。尽管A1B1C1D1、A2B2C1D2、A2B4C3D1、A1B4C4D3、A1B3C3D2、A2B1C2D3、A1B2C2D4几个处理存在污染率极低的处理,但由于这7个处理的外植体存活率为0,失去了培养的意义。剩余的处理中,A4B4C1D4及A4B1C4D2处理存活率没有显著差异,但显著高于其它处理,其对应的污染率指标除高于A2B3C4D4号处理外,均显著低于剩余的其它处理。尽管A2B3C4D4号处理污染率为0,但其外植体存活率仅为5.08%。综上所述A4B4C1D4、A4B1C4D2两个处理为外植体消毒的最佳处理,即以茎尖为外植体75%酒精消毒90 s,再用0.1%升汞消毒15 min或10%次氯酸钠消毒18 min,0.1%升汞消毒10 min。
表5. 0.1%升汞消毒叶片效果
注:表中显著性水准为0.05。

Table 6. Disinfection effects of 75% alcohol of stem cutting
表6. 75%酒精消毒茎段效果
注:表中显著性水准为0.05。
表7. 0.1%升汞消毒茎段效果
注:表中显著性水准为0.05。

Table 8. Duncan’s multiple range test of 16 treatments in an orthogonal test
表8. 正交试验16个处理消毒效果的多重比较
注:表中显著性水准为0.05。
4. 结论与讨论
4.1. 讨论
目前采用单一的消毒药剂对叶片进行消毒的做法较为普遍,百合、金钱树、杨树[13] -[15] 等植物的消毒研究表明以叶片为外植体消毒材料,只采用0.1%升汞消毒即可达到较佳消毒效果,此外也有研究人员先用75%酒精对叶片进行10~20 s短时间预处理,再采用单一的0.1%升汞进行消毒,在杨树、胡椒木[16] [17] 等植物上得到了较好的试验结果,控制污染率的同时,也未对叶片造成明显伤害。本研究表明,对叶片仅采用0.1%升汞消毒10~15 min即可控制污染率在29.28%~34.47%,存活率达到65.53%~70.72%;而经75%酒精、10%次氯酸钠和0.1%升汞多种消毒剂处理后,虽然污染率最低降低到0,但是存活率指标也降低到0,多种消毒剂处理不利于外植体生存。所以对于山竹叶片采用单一的升汞消毒处理效果明显好于多种消毒剂的复合使用效果。
多种消毒剂的配合使用可以明显提高表面消毒效果,很多研究也证明这一点。龙眼茎尖培养采用75%酒精消毒60 s,再用0.1%升汞处理10 min,最后用3%次氯酸钠处理30 min,进行表面消毒处理用于芽的诱导研究[18] ,苹果茎尖消毒采用75%酒精浸泡30 s,再用0.1%升汞浸泡10 min后,进行超低温保存研究[19] 。欧李茎尖用75%酒精消毒30~40 s,再用0.11% HgCl2消毒6~12 min,获得的消毒材料用于芽增殖研究[20] 。黄冠梨茎尖消毒以75%酒精处理10 s、再用0.1% HgCl2浸泡4 min的消毒效果最佳,污染率控制在25%,成活率达到71.88% [21] 。本研究表明,茎尖最佳的消毒方式为75%酒精与0.1%升汞或者10%次氯酸钠与0.1%升汞复合消毒效果最佳,这与上述研究结果是一致的。
分析不同外植体类型消毒方式不一的原因可能与外植体与药剂接触面有关。由于叶片表面相对平整,与消毒剂接触面积较大,单一消毒药剂即可达到较好的效果。茎尖凹陷不平,使得药剂不能有效深入凹陷部位,所以结合不同的消毒药剂,方能达到较好的消毒效果。所以对外植体消毒应依据具体的材料类型确定最佳的消毒剂种类及消毒时间。
4.2. 结论
以7~9 d生叶片和10~15 d生叶片为外植体,进行不同消毒药剂的组合消毒试验结果表明,不同药剂间的组合在很大程度降低了污染率,但对外植体造成了很大的损伤,存活率仅为0%~1.27%。参考前期单因素处理试验,建议只采用0.1%升汞进行消毒处理,处理时间维持10~15 min;以茎尖为外植体,适宜的消毒方式为75%酒精消毒90 s,再用0.1%升汞消毒15 min或10%次氯酸钠消毒18 min,再用0.1%升汞消毒10 min;采用茎段作为外植体材料消毒效果不佳。
基金项目
本研究受海南省农业科学院农业科技创新专项“山竹组培快繁技术研究”(项目编号:CXZX201411)资助,特此感谢!