1. 引言
化石能源(主要为:煤炭、石油和天然气)是目前全球消耗的最主要能源(占总能源消耗的85%以上),化石能源的大量使用是导致近几十年来大气中CO2浓度不断增加的元凶 [1] [2] 。其中燃煤电厂、水泥建材、钢铁冶金和石油化工等工业排放的烟道气是CO2的集中排放源。烟道气具有温度高(400℃~600℃)、流量大、CO2分压低、杂质浓度高等特点,发展高温CO2捕集技术对于控制碳排放具有重要意义。
Li2ZrO3 [3] - [7] 和Li4SiO4 [8] - [12] 是近年来出现的新型高温CO2吸收材料,具备优越的高温CO2吸收能力、较好的机械强度以及循环稳定性,不需要对高温烟道气冷却即可在高温下直接捕获CO2,在发展高温CO2捕获技术方面展示了良好的应用前景 [13] [14] 。相比于Li2ZrO3材料,Li4SiO4显示出了更高的吸收容量和吸收速率 [11] [15] 。一般认为CO2在Li2ZrO3或Li4SiO4材料上的吸收过程遵循“核壳模型” [16] [17] 即吸收从材料表面开始,因此Li4SiO4材料的外表面积与其CO2吸收速率密切相关。目前所报道的Li4SiO4材料均为无孔结构,颗粒较大,高温CO2吸收速率较慢。本文探究以CTAB + PAA为复合模板剂,采用溶剂挥发诱导自组装法(EISA)制备多孔Li4SiO4材料 [18] [19] ,并考察制备的Li4SiO4材料的CO2吸收性能。
2. 实验
2.1. 实验原料
氢氧化锂(LiOH·H2O)、十六烷基三甲基溴化氨(CTAB),分析纯,由国药试剂有限公司提供;正硅酸乙酯(TEOS)、聚丙烯酸(PAA),分析纯,购自阿拉丁试剂(上海)有限公司;去离子水由学校自制(电阻率大于7 MΩ)。
2.2. 合成
将8.06 g LiOH·H2O在冰浴下溶解到40 g去离子水中,加入1.82 g CATB搅拌1 h至完全溶解;再将7.15 g PAA(质量分数35%的水溶液)加入到上述溶液中搅拌1 h;最后将10.0 g TEOS缓慢滴加到上述溶液中室温下持续搅拌24 h,形成均一溶液。最终反应物的摩尔比为:n(TEOS):n(LiOH·H2O):n(PAA):n(CTAB) = 1:4:0.7:0.1。再将配置好的前驱体溶液倒入预先清洁过的平底表面皿(直径15 cm × 15 cm)上,自然铺展,将表面皿置于40℃、50℃、60℃、70℃、80℃的鼓风干燥箱中,使溶剂挥发完全,且薄膜可以从表面皿上完全剥落。将所得前驱体样品在马弗炉中焙烧,条件:升温速率3℃/min,300℃保温3 h后继续升温到600℃保温4 h,随炉冷却得样。
2.3. 表征
粉末X射线衍射(XRD)实验在荷兰Philips生产的PW3040/60型X射线衍射仪上进行。Cu靶Kα射线(λ = 0.154 nm),管电流40 mA,管电压40 kV,测试样品扫描范围0.5˚~10˚和10˚~60˚。用日本HITACHI S-4800型扫描电子显微镜(SEM)观察样品形貌,电压5 kV,电流5 mA,表面进行喷金处理以增强样品导电性。N2吸附采用美国Micromeritics公司生产的ASAP 2020物理吸附仪,在吸附前,材料在设定温度423 K下真空脱气6 h,然后在77 K下进行氮气吸附。热重差热分析(TG-DTA)在NETZSCH STA 449 C型热分析仪上进行。
2.4. CO2吸收
用NETZSCH STA 449 C型热分析仪对材料高温CO2吸收性能进行表征。样品置于氧化铝坩埚中,N2气氛中以10℃/min的速率升温到600℃预处理1 h,然后降温吸收温度550℃,切换成N2-CO2混合气体,CO2分压分别为0.1 bar、0.25 bar和0.5 bar,恒温吸收60 min,该过程为CO2吸收过程。脱附过程是吸附完后切换到纯N2气氛,以10℃/min的速率升温到脱附温度600℃,保持60 min。循环稳定性测试进行多次重复吸收和脱附。
3. 结果与讨论
3.1. 前驱体
图1为1、2、3号前驱体样品的XRD图,分析图谱可知,样品在3.5˚、7˚有衍射峰,说明以LiOH·H2O为锂源、TEOS为硅源,CTAB+PAA为复合模板剂,溶剂在40℃、50℃、60℃挥发诱导自组装所合成Li4SiO4前驱体样品存在有序的孔道结构。EISA法制备多孔Li4SiO4材料为协同自组装机理,即在溶剂挥发过程中表面活性剂胶团和无机物种之间通过协同作用发生重排,生成表面活性剂分子—无机物种共组装体,从而最终得到具有介观结构的Li4SiO4材料前躯体。
采用TG对Li4SiO4前驱体(空气气氛中以10℃/min的升温速率从30℃升温到800℃)进行热分析。其结果见图2,在30℃~800℃温度范围内,前驱体样品重量减少了53.9%。这整个过程明显可分为4个阶段,在30℃~300℃阶段,样品失重26.4%,是由于前驱体粉末中含有少量结晶水和游离水挥发。在300℃~550℃的明显失重是由于表面活性剂CTAB热分解和有机物质(以TEOS作硅源)剧烈燃烧导致。在500℃~620℃失重是由于SiO2与Li2O发生化学反应生成Li4SiO4。在620℃之后,前驱体样品的质量几乎保持不变,这说明反应已完全。所以我们选择在300℃与600℃分段焙烧。
3.2. 温度的考察
从表1的BET结果可知5个前驱体样品分段焙烧后,其孔结构坍塌,比表面积很小,其中3号样品的值稍高。
3.2.1. SEM图
从SEM图(图3)可知,制备的Li4SiO4样品形貌为颗粒堆积体,颗粒尺寸较为均一、颗粒间形成很多堆积孔。根据Li4SiO4材料的核壳吸收模型,CO2吸收是由表面扩散到颗粒内部,有更高外表面积的Li4SiO4材料具有更快的CO2吸收和解吸速率。
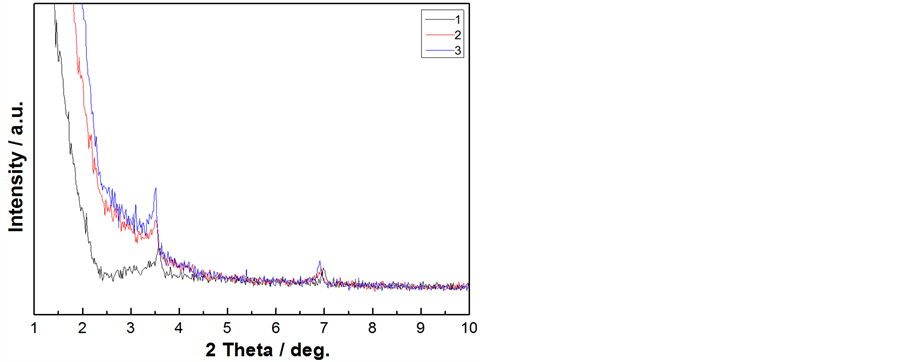
Figure 1. XRD pattern of precursor sample 1, 2, 3 (table 1)
图1. 1、2、3号(见表1)前驱体样品的XRD图
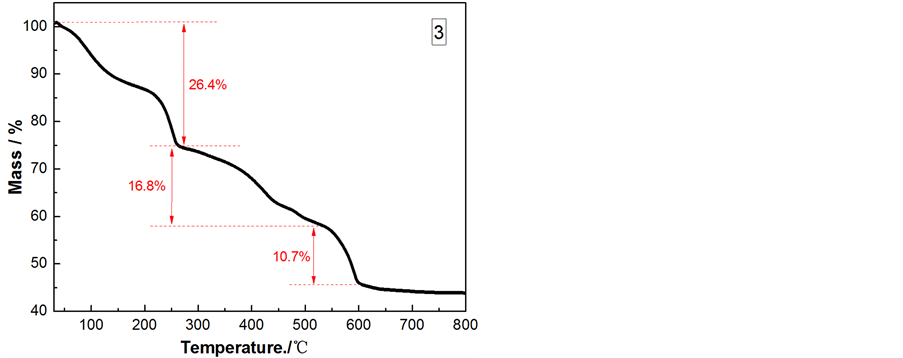
Figure 2. The precursor of Sample 3 in an air atmosphere from room temperature to 800˚C TG curves
图2. 样品3的前驱体在空气气氛中由室温升高到800℃的TG曲线
 注明:1~5分别是溶剂在40℃、50℃、60℃、70℃、80℃挥发诱导自组装所得前驱体焙烧后所得Li4SiO4样品
注明:1~5分别是溶剂在40℃、50℃、60℃、70℃、80℃挥发诱导自组装所得前驱体焙烧后所得Li4SiO4样品
Figure 3. SEM images of the samples Li4SiO4
图3. Li4SiO4样品的SEM图
3.2.2. XRD
图4为焙烧后样品的XRD图。由图可知,样品基本上为Li4SiO4的衍射峰,且峰形尖锐,也有较弱的Li2SiO3衍射峰及极微弱的Li2CO3衍射峰存在,其中4和5样品的Li2CO3衍射峰较前面3个样品有增强的趋势。且样品3不含有Li2CO3衍射峰,Li2SiO3衍射峰相比其它样品微弱。Li2SiO3衍射峰的存在可能是由于焙烧时锂源挥发造成部分样品锂源不足所致。
3.2 3. CO2吸收曲线
从图5可以看出,以CTAB + PAA为复合模板剂采用溶剂挥发诱导自组装法制备的5个Li4SiO4样品中,2、3样品在10 min内达到吸收平衡,且样品3的平衡吸收量为28.8 wt%稍高于样品2。1、4、5样品的CO2吸收速率和吸收量随着溶剂挥发温度的升高出现下降趋势。因此以CTAB+PAA为复合模板剂合成Li4SiO4材料,其溶剂挥发自组装的温度选在60℃较好,见表2。

Table 1. Different temperature of the solvent evaporation induced self-assembly prepared Li4SiO4 materials
表1. 不同温度下溶剂挥发诱导自组装制备Li4SiO4材料

Table 2. CTAB, CTAB + PAA as templates and without template prepared Li4SiO4 materials contradistinction
表2. 以CTAB、CTAB + PAA为模板剂与不加模板剂所制备Li4SiO4材料的对比
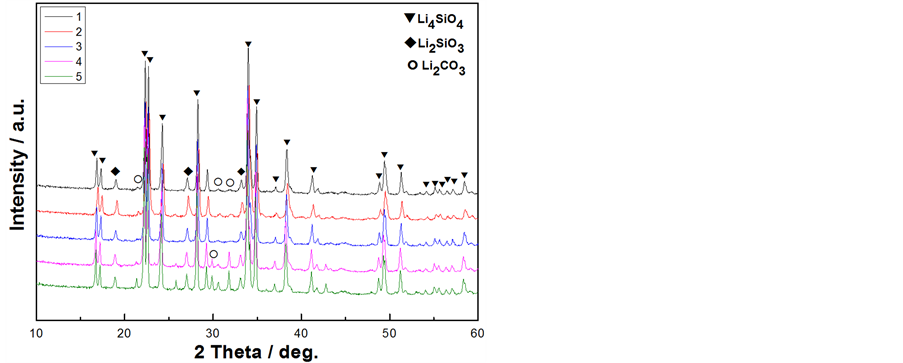 注明:1~5分别是溶剂在40℃、50℃、60℃、70℃、80℃挥发诱导自组装所得前驱体焙烧后所得Li4SiO4样品
注明:1~5分别是溶剂在40℃、50℃、60℃、70℃、80℃挥发诱导自组装所得前驱体焙烧后所得Li4SiO4样品
Figure 4. XRD patterns of Li4SiO4 samples
图4. Li4SiO4样品的XRD图
从图6可以明显看出,这3个样品在前3 min内的吸收速率一致,且样品3的CO2吸收量最高,样品6的最低。因而可知模板剂的加入显著提高了Li4SiO4材料的CO2吸收量,且CTAB + PAA复合模板剂的作用更显著。此外通过BET测试发现,3号样品的比表面积相对较大。
图7是CO2分压为0.25 bar、总流速为40 ml/min时,样品3随温度变化吸收-解吸CO2量的变化图。从图可知,制备的Li4SiO4材料在450℃之前吸收量很低,从500℃开始CO2吸收量有明显提高;530℃时,CO2吸收速率达到最大(~3.3 wt.%/min),最终Li4SiO4材料在670℃达到最大吸收量为28.4 wt.%。当温度高于670℃时CO2开始解吸,并在740℃时解吸完全。这说明液相体系自组装法合成的Li4SiO4材料可以在450℃~670℃吸收CO2气体,并在高于670℃时解吸。
图8为样品3在550℃、不同CO2分压下的吸收曲线。由图可知,Li4SiO4材料在CO2分压为0.5bar时,其吸收速率最快,10 min内几乎达到吸收平衡,其平衡吸收量为28.8 wt%。随着CO2分压的降低,CO2吸收速率减慢。当CO2分压为0.1 bar时,在10 min时吸收量仍可达22.8 wt%是其平衡吸收量(27.85wt%)的81.87%,依旧显示出较好的吸收性能。
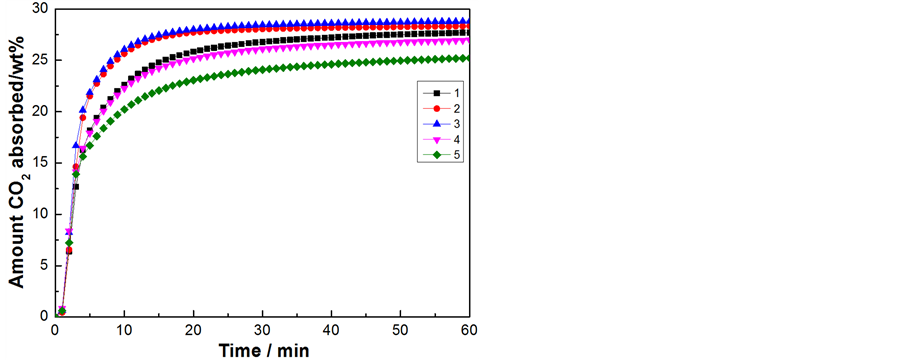
Figure 5. Uptake profiles of CO2 in the Li4SiO4 at CO2 partial pressure CO2 of 0.25 bar and 550˚C
图5. Li4SiO4样品在550℃,0.25 bar下的CO2吸收曲线

Figure 6. Uptake profiles of CO2 in the samples 3, 6, 7 at CO2 partial pressure of 0.25 bar and 550˚C
图6. 3、6、7号样品在550℃,0.25 bar下CO2的吸收曲线
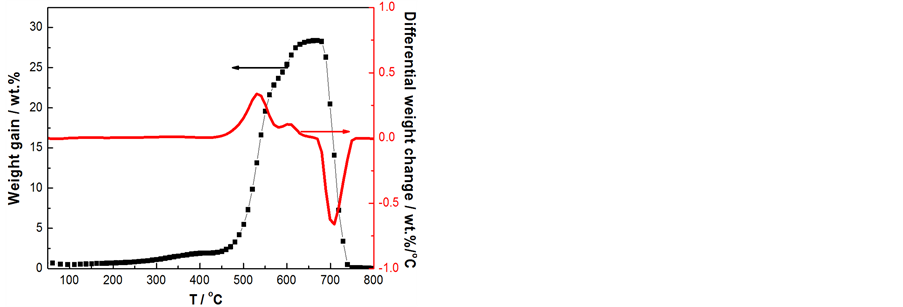
Figure 7. Absorption-desorption profiles of CO2 in the Li4SiO4 as a function of temperature in the B-3 Sample, CO2 partial pressure: 0.25 bar
图7. CO2在样品3上的变温吸收–解吸曲线,CO2分压为0.25 bar

Figure 8. Uptake profiles of CO2 in the Li4SiO4 at different CO2 partial pressure and 550˚C in the B-3 Sample
图8. 样品3在550℃、不同CO2分压下的CO2吸收曲线

Figure 9. Five cycles of CO2 capture-regeneration in the B-3 Sample: (1) Capture at 550˚C and a CO2 partial pressure of 0.25 bar; (2) Regeneration by heating (10˚C/min) to 600˚C in a pure N2 flow of 40 mL/min
图9. 样品3的CO2吸收–解吸五次循环曲线;吸收阶段:550℃,CO2分压0.25 bar;解吸阶段:600℃,N2气氛40 mL/min
考察了制备的样品3的CO2吸收–解吸循环使用性能(图9),由图9可知,该样品具有较快的吸收和解吸速率,600℃,N2气氛中Li4SiO4样品能完全再生。经5次吸收–解吸循环后,其CO2吸收性能没有明显改变,表明合成的Li4SiO4材料具有良好的循环稳定性。
4. 结论
采用挥发诱导自组装法合成了具有介观结构的Li4SiO4前驱体,其在焙烧后得到纳米Li4SiO4材料,具有良好的高温CO2吸收性能:可在450℃~670℃范围内可吸收CO2气体,并在高于670℃时解吸;在550℃,CO2分压为0.1~0.5 bar范围内均具有很快的CO2吸收速率;经过5次吸收–解吸循环后样品吸附性能基本没有下降,具有良好的循环使用性能。这说明了前驱体的介观结构有利于Li4SiO4材料CO2吸收性能的提高。