1. 引言
精子DNA是精子遗传物质的载体,近年来的研究表明精子DNA的完整性能够影响精子的受精能力、受精卵的分裂以及胚胎的发育。精子DNA完整性对自然受孕、人工授精、胚胎、胎儿、婴儿甚至成人的发育至关重要。研究表明精子DNA完整性是优于常规精液分析的独立参数 [1] ,与辅助生殖技术结局有相关性 [2] 。因此,对男性不育患者进行精子DNA完整性分析,有助于探讨或发现其不育的原因,为患者的预防和治疗提供咨询及诊断依据。
本研究对少精子症(idiopathic oligozoospermia, IO)患者同时应用精子染色质扩散(SCD)实验和吖啶橙染色实验(AOT)两种方法检测精子DNA完整性,探讨男性不育机理,并通过比较两种方法的检测结果,分析这两种方法的应用价值。报告如下。
2. 对象与方法
2.1. 对象
选取山东省妇幼保健院2014年1月至2016年2月就诊的IO患者27例为不育组,年龄(28~37)岁,平均(28.5 ± 3.2)岁,平均不育年限(5.3 ± 2.8)年。夫妇染色体检查均为正常核型。排除生殖器异常、内分泌异常及感染因素引起的不育。男性检查包括男性第二性征、阴茎、阴囊、精索、输精管、睾丸、附睾等。健康对照组选取32名近期生育过的正常成年男性,年龄(28~38)岁,平均(29.1 ± 2.7)岁,男性检查均无发现异常。
2.2. 精液常规分析
按照WHO《人类精液及精子–宫颈粘液相互作用实验室检验手册》 [3] 和《世界卫生组织男性不育标准化检查与诊疗手册》 [4] 精液变量参考值的标准:液化时间少于60 min,精液量大于2 ml,密度大于20 × 106/ml,存活率 ≥ 60%,前向运动精子 ≥ 50%,精子正常形态率 > 30%,为正常精液指标参数。连续3次精液常规检查5 × 106/ml ≤ 精子密度 < 20 × 106/ml为少精子症,精子密度 < 5 × 106/ml为严重少精子症。
2.3. 精子DNA完整性检测
2.3.1. 仪器和试剂
1) 仪器:E-1000荧光显微镜(日本NIKON)。OLYMPUS CX31普通光学显微镜(日本)。2) 主要试剂:低溶点琼脂、标准琼脂、二硫苏糖醇(DTT)、联咪二苯吲哚(DAPI)、三羟甲基氨基甲烷–硼酸盐–乙二胺四乙酸二钠盐(Tris-Borate-EDTA,TBE)缓冲液、瑞氏-姬姆萨染液、吖啶橙等均购自美国Sigma公司。其余试剂均为国产分析纯试剂。
2.3.2. SCD实验,根据文献 [5] [6] 略加修改
1) 方法:精液标本用磷酸盐缓冲液(pH6.8)调至10 × 106/ml,取0.3 ml处理好的精液与0.7ml 1%低熔点琼脂凝胶混匀,37℃孵育;吸取50 µl上述精子混合液滴在经过0.65%正常溶点琼脂预处理过的载玻片上,盖上22 × 22 mm盖玻片4℃放置5 min;小心去除盖玻片,室温(22℃左右)将标本载玻片浸入0.08 mol/L的盐酸(HCl)内变性7 min;然后浸入含0.4 mol/L二硫苏糖醇(DTT)的精子裂解液内(pH 7.3) 20 min;再移入TBE缓冲液中3 min;然后将标本载玻片依次放入70%、90%和100%的乙醇中脱水。所有操作过程均要求标本载玻片处于水平状态。风干后放入密封盒,可存放数月。观察前染色。
2) 染色:在标本上滴50 μl 2 μg/ml的DAPI染色,立即在荧光显微镜下观察。如用普通光学显微镜观察,需进行瑞氏–姬姆萨染色。先用瑞氏染液将标本面充分覆盖;稍等片刻再加姬姆萨染液1~2滴;稍等1~2分钟后,再缓慢加磷酸盐缓冲液,直至染色液形成表面张力;染色10分钟;用蒸馏水缓缓冲洗至少2分钟,风干,立即观察结果(也可存放于密封盒内数周后观察)。
3) 结果判断:计数500个精子,观察精子晕环大小。根据环晕与精子头部横径的比例,粗分为大、中、小和无晕环4个等级,大和中晕环表示精子DNA完整无碎片,小和无晕环表示精子DNA断裂为碎片。小晕环以 ≤ 精子头直径四分之一为判断标准,中晕环 > 精子头直径四分之一而 ≤ 精子头直径三分之二,大环晕 > 精子头直径三分之二。
2.3.3. AOT,按参考文献 [5] 方法
1) 方法:精液标本根据文献 [2] 配制的泰洛氏(Tyrode’s)液洗涤3次,精子沉淀稀释至50 × 106/ml;涂片,风干;卡诺氏(Carnoy’s)液(1份冰醋酸:3份甲醇)固定2 h,风干;用新配制的0.19 mg/ml的吖啶橙(pH 2.5)避光染片5 min;双蒸水冲洗染片,盖上盖玻片立即观察。
2) 结果判断:采用荧光显微镜计数500个精子(波长450~490 nm),观察精子着色情况,绿色精子为未受损伤的双链DNA精子,红色及黄色、橙色为受损伤的单链DNA精子。
2.4. 统计学分析
采用SPSS(11.5版)软件系统进行统计处理,精液常规分析数据、SCD实验及AOT检测数据均以均数 ± 标准差(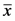 ± s)方式表达;健康对照组和不育组比较经t检验。P < 0.05视为差异有统计学意义。
± s)方式表达;健康对照组和不育组比较经t检验。P < 0.05视为差异有统计学意义。
3. 结果
3.1. 精液常规检查结果
精液常规分析如表1所示。IO患者精子密度、活力、畸形率与健康对照组有显著性差异(P < 0.001)。
3.2. 精子DNA完整性检测结果
3.2.1. SCD实验结果
SCD实验通过显示大、中、小晕环和没有晕环4个等级来分析含碎片DNA精子的百分率,见图1。IO患者精子大晕环、中晕环、小晕环和无晕环精子百分率分别平均为(51.8 ± 17.1)%、(9.4 ± 8.6)%、(11.9 ± 5.8)%和(26.7 ± 10.6)%,健康对照组平均为(73.2 ± 6.2)%、(14.8 ± 5.7)%、(6.8 ± 2.9)%及(5.3 ± 2.2)%,二组比较,差异有统计学意义(t = 4.256, P < 0.01; t = 5.1849, P < 0.05; t = 3.6967, P < 0.01; t = 5.7971, P < 0.01)。IO患者含DNA碎片精子(小晕环和无晕环精子)百分率为26%~82%,平均(38.1 ± 9.5)%,健康对照组8%~18%,平均(12.1 ± 5.2)%,二组比较,差异有统计学意义(t = 9.2438, P < 0.01),见表2、表3。
3.2.2. AOT结果
AOT根据双链DNA精子染成绿色,单链DNA精子染成红色或黄色的原理来分析含DNA碎片精子的百分率,见图2。健康对照组绿色荧光的精子平均为(60.1 ± 16.6)%,具有橙色、黄色或红色荧光的精子平均为(39.8 ± 19.2)%,不育组绿色荧光的精子平均为(54.7 ± 12.2)%,具有橙色、黄色或红色荧光的精子平均为(45.5 ± 13.8)%,两组比较,差异均无统计学意义(t = 0.5617和t = 0.6720,P > 0.05),见表3。
3.2.3. SCD实验与AO实验结果比较
SCD实验中无晕环和小晕环的精子为DNA损伤精子,AO实验中黄色、橙色及红色精子为单链DNA精子。健康对照组SCD实验的小晕环、无晕环精子占总精子数的百分率为(12.1 ± 5.2)%,AO实验的红、橙、黄色精子占总精子数的百分率为(39.8 ± 19.2)%,差异有统计学意义(t = 5.0443, P < 0.01)。IO患者SCD实验的小晕环、无晕环精子百分率为(38.1 ± 9.5)%,AO实验的红、橙、黄色精子的百分率为(45.5 ± 13.8)%,差异无统计学意义(t = 0.4312, P > 0.05)。

Table 1. Comparison of semen routine analysis in infertility patients and healthy control group (s)
表1. 不育患者及健康对照组精液常规分析结果比较(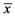 ± s)
± s)
注:a与健康对照组比较,P < 0.001。

Table 2. Comparison of sperm of SCD, middle, small halo and no ring in infertility group and control group (s)
表2. 不育组与对照组SCD大、中、小晕环和无晕环精子比较 ( ± s)
± s)
注:与对照组比较,aP < 0.01,bP < 0.05。

Table 3. Comparison (s) of SCD experiment and ao experimental results
表3. SCD实验与AO实验结果比较(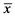 ± s)
± s)
注:与SCD比较,aP < 0.01。

Figure 1. Light microscope sperm picture of SCD test. C for the healthy control group, 1, 2, 3 were large halo sperm, 4 was small halo sperm; d is a sterile group, 1 is a large halo sperm, 2 is a halo ring sperm, 3 and 4 are halo sperm, 5 is a halo - free ring sperm. (general optical microscope, ×1000)
图1. SCD试验普通光镜精子图片。c为健康对照组,1、2、3号为大晕环精子,4号为小晕环精子;d为不育组,1号为大晕环精子,2号为中晕环精子,3、4号无晕环精子,5号为无晕环退化精子。(普通光学显微镜,×1000)

Figure 2. a is for the healthy control group, b is for the infertility group, the green arrow refers to normal double stranded DNA sperm (green), the red arrow refers to single strand DNA sperm (red, orange, yellow) (fluorescence microscope, ×1000)
图2. AOT。a为健康对照组,b为不育组,绿色箭头所指为正常双链DNA精子(绿色),红色箭头所指为单链DNA精子(红色、橙色、黄色)(荧光显微镜,×1000)
4. 讨论
人类精子成熟过程中,其DNA极易受内外环境因素影响而形成DNA碎片,从而引起精子形态和功能异常,导致男性不育,并带来遗传风险。尽管精子DNA完整性一直是生殖医学领域研究热点,但过去对精子DNA完整性的研究并不多,主要是存在方法学的不足。随着技术的发展和研究的深入,精子DNA完整性检测方法逐渐增多。然而这些方法大都需要流式细胞仪或荧光显微镜分析观察,或检测试剂昂贵或步骤繁琐,限制了这些方法的临床应用。SCD实验是由Fernández等 [5] 2003年创立的一种精子DNA完整性检测方法,基本方法和原理是:将精子悬液与琼脂糖混合铺于载玻片上,酸处理后用裂解液裂解细胞去除核蛋白,用DAPI染色后在荧光显微镜观察精子。损伤断裂的DNA在酸处理后不能再产生特征性晕环。根据晕环的大小,可以判定精子DNA是否有碎片也就是确定其DNA的完整性,从而对男性生育力进行评估。然而由于荧光容易发生淬灭,晕环的大小在荧光显微镜下不容易区分,也不容易区分精子和其他精液细胞。2005年Fernández 等 [6] 改进了SCD检测方法,用瑞氏染液染色,可在光学显微镜下观察。精子头部晕环清晰易辨,并保留了精子尾部,得以区分精子和其他细胞。还能清晰地观察到荧光染色无法观察的退化的精子。使观察结果更加准确可靠。正常精子没有DNA碎片,具有大的晕环或中等晕环;而存在DNA碎片的精子没有晕环形成或有很小的晕环,或没有晕环且着色很淡,呈退化迹象。
本研究在改良的SCD实验 [6] 基础上,适当缩短了操作时间,使之更适于临床应用。并改瑞氏染液为瑞氏–姬姆萨染液进行染色,在普通光学显微镜下清晰观察到精子晕环,方法稳定、简单,重复性好,可直观定量显示精子DNA完整性水平,适于临床检测。
在实验方法建立过程中,我们发现影响精子SCD实验结果的因素为混合精子用的低溶点琼脂的浓度会影响精子粘附在载玻片上的牢固程度,从而影响实验效果。预处理载玻片时,正常溶点琼脂涂布不均匀可能使精子脱落,载玻片上出现无精子空白区域而检测不到精子。其次, 合适、稳定的室内温度(20℃~32℃)也是SCD实验成功的关键。预实验结果表明,如果室温低于18℃,则影响变性及裂解的效果,但16℃左右对染色效果仍无影响。因此,严格遵守实验程序,保持室温相对稳定,对于SCD实验成功至关重要。
本研究采用SCD实验,观察了IO患者的精子DNA损伤情况,结果发现小晕环、无晕环精子百分率高于健康对照组[分别为(38.1 ± 9.5)%和(12.1 ± 5.2)%],说明IO患者的精子DNA损伤程度高于健康对照组。最近,Gallegos 等 [7] 对泌尿生殖系统感染的男性不育患者精子进行SCD检测,精子DNA碎片是正常生育男性的3倍(35.2%:10.8%),经过抗菌治疗后,精子DNA碎片下降到13.6%和11.2%。本研究结果与以上研究结果相符。提示IO患者精子DNA完整性异常,可能是精子质量下降的原因。
AOT是一种常用的检测精子DNA单链或双链结构的方法 [8] [9] [10] 。其染色机理是:精子在附睾内成熟期间,精子头部DNA的硫醇类逐渐转为二硫化物,使DNA具有对抗酸所致变性的性能,从而保持了双链结构。而不成熟精子或受损伤的DNA在酸的作用下变性,成为单链。AO荧光物质结合双链DNA 呈单体形式,发绿色荧光,而与单链DNA结合时呈聚合物形式,发红色或黄色荧光。
本研究在进行SCD实验的同时还对同一份标本的精子涂片进行AOT。结果发现,AOT中,IO患者和健康对照组的绿色精子百分率和红、橙、黄色精子百分率无统计学差异,健康对照组和IO患者均显示较高水平的DNA碎片。提示AOT用于精子DNA完整性检测的可靠性不高。Eggert-Kruse等 [11] 也曾对AOT用于评价精子质量提出了质疑,在其研究中,AOT与精液参数(如精子计数、动力、形态、活率、以及精子–宫颈粘液作用实验等)没有相关性。有人认为这可能与对颜色辨别的灵敏度、稳定性有关 [12] 。在本研究中,健康对照组的AOT与SCD实验结果不一致。AOT结果明显高于SCD实验结果,差异有统计学意义。提示AOT如何用于评价精子DNA完整性以及是否适用还需进一步探讨。
相对于AOT,本研究使用的SCD检测方法具有简单、快速、准确、廉价、分辨率高的特点,适用于临床应用。但仍需要进一步扩大样本,建立SCD实验检测标准和正常参考值,以便进一步扩大SCD实验的临床应用范围。
基金项目
山东省科技发展计划资助(基金号:2015GSF118072)。