1. 引言
甲壳类动物的防御系统以非专一性的先天性免疫为主 [1] ,防御系统分为体液性(humoral)与细胞性(cellular)免疫反应。细胞性功能有吞噬作用(phagocytosis)、疖结形成(nodule formation)、包膜作用(encapsulation)、细胞毒杀作用(cytotoxicity)与原酚氧化酵素系统(prophenoloxidase-activating system, PAS),而PAS被认为能引起进而增强防御系统的连锁反应 [2] 。先天性免疫反应为生物体防止外来入侵物的第一道防线,对于宿主而言,最大的挑战是通过有限的受体迅速识别大量不同的病原体以引发有效的防御。Janeway于1992年提出[模式识别理论] (pattern recognition theory) [3] ,将先天性免疫反应的防御性细胞受体或分子主要能辨识的病原体之目标分子形式称作病原相关的分子模式(Pathogen-associated molecular pattern; PAMP),因为这些分子广泛存在于病原体表面或细胞内的各类分子,且在演化上趋于保守的 [4] ,如酵母细胞壁上的葡聚糖(glucan)、细菌细胞壁之脂多醣(lipopolyssacharide, LPS)、多肽糖(peptidoglycan; PGN)和胞壁酸(lipoteichoic acid; LTA)、以及核酸分子如细菌的DNA和病毒的RNA等。由于这些分子不存在宿主或与宿主分子有差异,宿主可以藉由防御性识别受体,又称为模式识别受体(pattern recognition receptor; PRR),进行“自我”和“非我”的区分 [5] ,如类铎受体(Toll-like receptors, TLR)。
细菌DNA中某些特定序列之未甲基化CpG寡聚脱氧核苷酸(CpG oligodeoxynucleotides; CpG-ODNs)为一种PAMP,其通常在5’端有两个purines (Pu)及3’端有两个pyrimidines (Py)将其包围,即5’Pu-Pu-CpG-Pyr-Pyr3’核苷酸序列,因此种序列具有生物活性,故将其命名为CpG基序(CpG motif) [6] [7] 。Takeshita等人(2001)研究指出,不同序列之CpG-ODN对HEK 293细胞引起不同的反应,且不同物种能辨识的ODN可能有差异 [8] 。在鱼类,目前已有许多有关CpG-ODN应用的研究。CpG-ODN能增强的免疫功能包括:巨噬细胞活性、过氧离子产量、淋巴球增生以及抵抗细菌和病毒等免疫力 [9] [10] [11] [12] [13] 。但是也有研究显示,有些CpG-ODN具有抑制效应,包括:抑制鲤鱼的肾巨噬细胞的增生 [12] 、无法提升金鱼(Carassius auratus)抗体的产量 [14] 、以及对大西洋鲑无明显影响等 [10] 。在甲壳类,本研究室是第一个证明CpG-ODN可以增强虾类免疫力,包括:激活虾血球的PAS活性、呼吸爆炸作用(respiratory burst)和血球基因proPO的表现 [15] [16] [17] ,且增强的proPO表现会被另一种ODN抑制,推测不同序列的ODN可能对虾免疫力具有不同效应 [16] 。此外,有研究发现内含多个(multi-copy) CpG基序之质体具有增强白虾(Litopenaeus vannamei)抗菌力和PO活性 [18] ,以及在虾子受到白点病毒(WSSV)感染期间,CpG-ODN可以降低病毒在血球细胞内的复制 [19] 。
本研究室已经根据对鱼类等具刺激或抑制效应的不同序列CpG-ODN进行分析并设计可能对虾血球为刺激或抑制的不同序列之CpG-ODN。本研究将针对这些CpG-ODNs,分别于体外直接刺激虾血球和注射处理虾子的实验,测定刺激后的酚氧化酵素(phenoloxidase, PO)活性以及四种免疫相关基因及一种呼吸相关基因的mRNA表现,最后利用感染实验确定这些不同序列CpG-ODNs对虾子防御力的影响效应属刺激性、抑制性或中和性。本研究结果将可以作为未来评估不同效应之CpG-ODNs应用在养殖上的参考。
2. 材料与方法
2.1. CpG寡聚脱氧核苷酸(CpG oligonucleotides, CpG-ODN)的制备
本实验使用之不同序列的CpG-ODN是收集过去已发表且与鱼类有关的30段ODNs和与人类有关的11段ODNs,利用Perl程序语言撰写的oligo-mer计数程序,找出这些ODNs序列中出现较多频率的连续5个核苷酸(5-mer)或6个核苷酸(6-mer)以CpG为核心的基序后,将这些序列随机组合成21~24个核苷酸长度的四段CpG-ODNs,包括:ODN2050、ODN2051、ODN3006及ODN4006 (表1)。此外,本实验使用已知能增强虾子免疫力的ODN2006 [15] 以及已知对虹鳟鱼(Oncorhynchus mykiss)为抑制性的ODN2140 [20] 分别作为促进性和抑制性的对照组,以进行各项实验分析与比较。所有ODN皆委请生工有限公司(MDBio, Inc.)代为制作。于体外实验时,各种CpG-ODN以M199配制成1、2、5、10、20、30及40 μg/mL

Table 1. Six CpG-oligonucleotides used in the study
表1. 本实验所使用之六种CpG寡聚脱氧核苷酸
等不同浓度;虾体实验时,以PBS配制成20、30、40及50 μg/mL等不同浓度。为了利于流式细胞仪的分析与观察,制备5’端带有羧基荧光素之琥珀酰亚胺基酯(Carboxyfluorescein-5-succimidylester),即5-FAM的ODN,简称FAM-ODN。实验前,以磷酸盐(Phosphate buffered saline, PBS)缓冲液分别配制成不同浓度。
2.2. 实验用虾
购买自养殖场外观健康的淡水长臂大虾(Macrobrachium rosenbergii) (体重平均约25公克),置于充分打气的淡水循环养殖池中,养殖密度约为每平方公尺4~5尾,至少驯养三天后抽血进行实验。养殖期间每日喂食人工饲料二次,饲料来自屏东科技大学郑文腾教授,配方详见Chiu等(2010) [21] 。
2.3. 活血球细胞制备
以内含0.5 mL抗凝剂的3.0 mL塑料针筒搭配24 G x1” (0.55 × 25 mm)针头(TERUMO, Japan),由淡水长臂大虾头胸部处,抽取血淋巴液(hemolymph)至1.1 mL;将抗凝剂与血淋巴液迅速上下摇晃混合均匀。混合液以300 ×g于4˚C,离心10分钟;去除上清液后,加入1.0 mL PBS悬浮细胞。取10 μL血球悬浮液,加入等量的trypan blue (Sigma T-6164;0.4% trypan blue in 1.4% NaCl)后,以血球计数器(hemocytometer)计算血球总数;其余血球悬浮液置于冰上备用。
2.4. CpG-ODN与虾血球细胞结合分析
为确认不同序列的ODN与虾血球表面受器结合饱和浓度,实验中以不同浓度FAM-ODN与血球作用后,利用流式细胞仪(Cytomics FC 500; BECKMAN COULTER)分析之。实验中,将来自同一尾虾子且悬浮于0.01 M PBS的细胞悬浮液(约5 ´ 106 cells/mL细胞数),分装至5管,每一管200 mL;接着,每一管分别加入100 mL的PBS及四种不同浓度的FAM-ODN,置于室温作用1分钟后,离心,去除上清液,以10%甲醛(formaldehyde)固定液处理细胞10分钟后,以4˚C于800 ×g离心5分钟,去除上清液,以PBS悬浮细胞。接着,以流式细胞仪进行分析,观察FAM-ODN于细胞表面结合之变化。
2.5. 虾子酚氧化酵素(phenoloxidase, PO)活性的测定
本实验分别测定体外血球胞外液和虾子血球及血浆内的PO活性。根据Chuo等(2005)实验步骤进行体外血球胞外液样本PO的测定 [15] 。不同浓度的CpG-ODN溶液100 μL分别与200 μL虾血球悬浮液混匀后,静置15分钟;经4˚C,800 ×g离心5分钟后,吸取10 μL上清液,利用Bradford方法测定蛋白质浓度外,另取50 μL胞外上清液测定酚氧化酵素(PO)活性。至于虾子血球和血浆之PO活性的测定前,取100 mL的ODN溶液由虾体腹节处注射后1小时,分别抽取虾血淋巴液。经离心后,取上清液即血浆样本,沈淀即为血球样本。血球样本经悬浮并高速離心后的上清液即为血球细胞萃取液(hemocyte lysate supernatant; HLS)。取50 μL待测样本、加入50 µL浓度1 mg/mL胰蛋白酶(Trypsin)后,置于室温下反应15分钟后,加入200 μL新鲜配置之受质溶液L-DOPA (L-3,4-dihy-droxyphenyl-alanine, 1.6 mg/mL),并立即在波长490 nm下测定吸光值(OD490)。取前五分钟内且单位时间内最大变化的OD数值,以变化0.001为1 U,获得PO活性,以(ΔU/Δt)/mg表示。根据Chao等实验指出,样本加入胰蛋白酶后所测得的PO活性,视为样本内原含有的proPO总量,以POT表示 [15] 。
2.6. 基因之mRNA表现量的测定
本实验利用半定量反转录聚合酶链式反应(RT-PCR)进行分析。首先制备血球RNA样本。取虾血球(约1 × 107细胞)加入1 mL的Trizol试剂(Boehringer Mannheim, Roche)于室温下作用、离心后,取上清液;以异丙醇(isopropanol)沈淀出RNA,以酒精进行盐洗、风干。以核酸测定仪定量RNA浓度为A260/A280介于1.8~2.0,方能进行后续的RT-PCR。本实验测定之五种防御相关基因的专一性引子序列如表2所示。使用First Strand cDNA Synthesis Kit (Fermentas)进行,实验中取5 μg的RNA样本,加入1 μL的Oligo-d(T)18引子,再加入适量的DEPC水使总体积为11.5 μL。在65˚C加热5分钟后使温度缓慢降至室温。接着,依序加入4 μL的5X反应缓冲液、2 μL的10 mM之dNTP混合液、0.5 μL的RNase抑制剂(20 U/μL)、以及1 μL的反转录酵素(reverse transcriptase, 20 U/μL),使总体积为20 μL。于42˚C水浴一小时后,以85˚C加热5分钟后,置于冰上备用。
配制1%胶体,于迷你电泳槽(RunOne, EmbiTec),在电压100伏特下进行电泳约30分钟,取出胶体用溴化乙锭(ethyl bromide)染色10秒,再以清水退染20~30分钟,最后置于紫外光源下照像存档。接着,使用ImageMaster2D软件分析目标片段,将目标片段之条带亮度量化。本实验以虾血球中正常表现的β-actin基因作为参考基因(internal control),以其mRNA表现量于胶体中的条带亮度当作分母,目标基因之条带亮度当作分子,所得比值即为目标基因之mRNA表现量。
2.7. 易感性分析
虾子驯养至少1周后,每一尾虾子注射2.5 μg的LPS刺激虾子1小时后,测定血浆中POT和血球GPx活性表现确认虾子处于发炎状况。接着,将虾子分为四组,每一组20尾虾子。一天后,其中两组分别注射2 mg的ODN2140和ODN3006,并同时感染100 mL致病菌Lactococcus garviae (108 cells),两个对照组分别为注射PBS取代ODN以及PBS取代ODN和致病菌。接着连续观察并记录虾子死亡尾数,

Table 2. The primers of selected genes for semi-quantitative RT-PCR
表2. 用于半定量反转录聚合酶链式反应之目标基因的引子
注:所有目标基因进行PCR的退火温度为58˚C,循环24次。
直到连续48小时无死亡发生为止。换算出专一性死亡率,12小时内死亡属非专一性死亡。
专一性死亡率(%) = (实验组死亡只数 − 非专一死亡数)/(总数 − 非专一死亡数) × 100%。
2.8. 统计分析
血球细胞之PO活性和免疫相关基因mRNA表现量的数据以one-way ANOVA进行各不同喂食处理组间的比较,分析后有显着差异者(p < 0.05),再以Duncan比较各组间的差异。
3. 结果
3.1. 不同序列CpG-ODN能结合血球细胞
为确定设计且人为合成之四种不同序列的ODNs是否能直接与血球细胞作用,本实验以不同浓度(0,0.1、0.5、1、2、5、10、20、30、40及50 μg/mL)且标定荧光素FAM的ODN与虾血球作用后,利用流式细胞仪分析其结合血球细胞的百分率。图1结果发现,ODN于低浓度时(0.1至1 μg/mL),ODN2050和2051于0.5 μg/mL能结合的血球百分率均高于5%,于1 μg/mL能结合的血球百分率均超过10%。ODN3006和4006于0.5 μg/mL能结合的血球百分率仅分别为1%和0.6%;ODN3006于1 μg/mL能结合的血球百分率升高至12%,然ODN4006仅能结合3%的血球细胞。
当ODN于浓度1至10 mg/mL时,包括对照组ODN2006和ODN2014在内的所有ODNs结合血球的百分率随浓度而增加(图2);四种ODNs中以ODN2050结合50%血球所需浓度(required concentration for binding 50% of the cells, BC50)最低(1.88 mg/mL),其他ODNs的BC50依浓度低至高分别是ODN2006 (4.43 mg/mL) < ODN2051 (4.59 mg/mL) < OD3006 (6.12 mg/mL) < ODN2140 (6.66 mg/mL) < ODN4006 (9.28 mg/mL)。此外,除ODN3006与ODN4006于50 mg/mL仅能结合72%和88%的血球外,其他ODNs均能结合约95%血球,但所需浓度不同,其中ODN2050仅需5 mg/mL即能与约95%血球结合。本实验利用荧光单染分析ODN3006与ODN2050与血球细胞表面的结合位是否相同。实验中,使用固定浓度的FAM-ODN3006 (12.5 mg/mL)分别与不同浓度的ODN2050 (0、12.5及25 mg/mL)共同处理虾血球细胞后,以流式细胞仪分析FAM-ODN3006于细胞表面结合之变化。结果如图3所示,随ODN2050浓度的增加,测得能与FAM-ODN3006结合的细胞百分率下降。
3.2. 不同序列CpG-ODN于体外影响血球细胞酚氧化酵素(PO)的活性
实验以不同浓度(0.33 mg/mL至13.3 mg/mL) ODNs直接与血球作用后,测定细胞外液中总酚氧化酵素活性(POT)的结果显示,除ODN2014抑制POT外,其他ODNs均可以增加POT,即促进血球细胞的释颗粒作用(图4)。以高于未加入ODN处理之对照组活性的1.5倍为基准发现,正对照组的ODN2006于0.33 mg/mL即可以明显增强POT,其次是ODN2050和ODN3006至少为0.67 mg/mL能明显增强POT,ODN4006及ODN2051则分别要大于1.67 mg/mL和10 mg/mL才具有明显刺激POT表现。
3.3. 不同序列CpG-ODN影响虾子的免疫力
相较于无ODN处理的对照组,虾子注射剂量2 mg/尾的ODN后1小时测定的血浆POT显示,ODN2050、ODN2051及ODN4006三组虾子血浆POT与正对照组ODN2006相同,均明显地增加,其中ODN2050为对照组的3.8倍;至于ODN3006和ODN2140则与对照组无明显差异(图5(a))。除POT外,本实验分析四个免疫相关的基因表现以评估不同序列ODNs对虾子的影响,包括:原酚氧化酵素活化系统(prophenoloxidase-activating system, PAS)相关基因propo、pon及α2-m以及抗微生物相关基因alf。相对于对照组的各基因之mRNA表现量,ODN处理虾子后3小时测得的mRNA表现量如图5(b)显示,
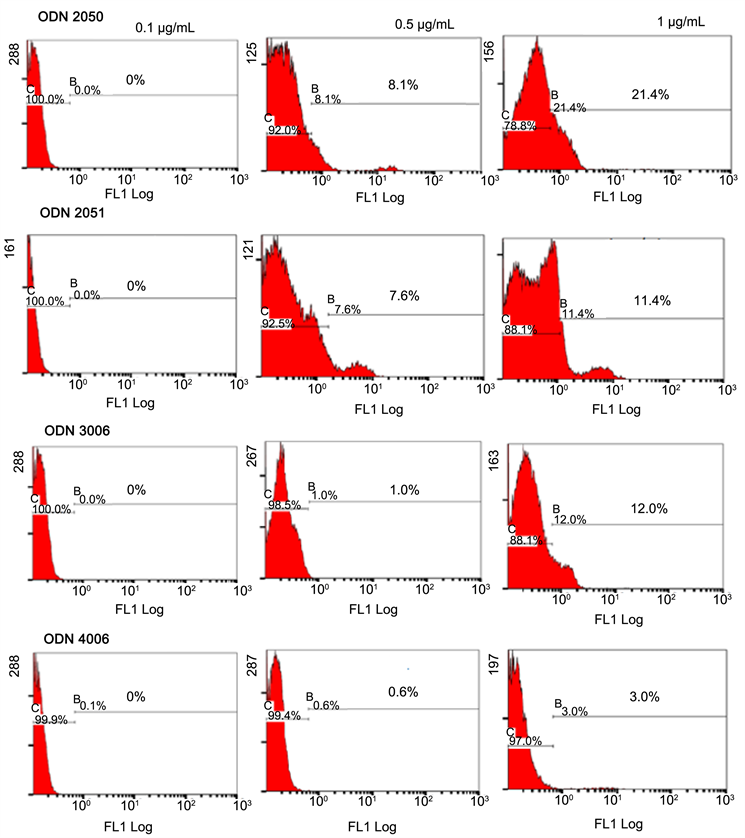
Figure 1. The percentage of prawn hemocyte bound by the low concentration of CpG-ODN
图1. 低浓度CpG-ODN结合虾血球细胞的百分率
ODN2006组虾子有四种免疫相关基因(propo、pon、α2-m和alf)的mRNA表现量明显升高;相反地,ODN2140和ODN3006组分别有3种(propo、α2-m和alf)和2种(propo和pon)基因的mRNA明显低于对照组。至于ODN4006组虾子之四种基因的mRNA表现与对照组无显着差异。
3.4. CpG-ODN2014和CpGODN3006降低发炎性虾子感染后的死亡
由图5结果推测ODN2140和ODN3006可能对虾子免疫力具有抑制性,也许可以降低发炎状态虾子
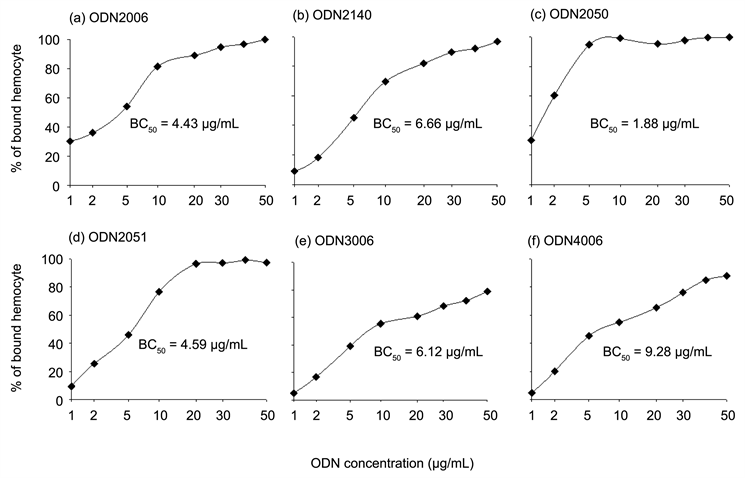
Figure 2. The percentage of prawn hemocyte bound by CpG-ODN at concentration higher than 1 mg/mL
图2. 浓度高于1 mg/mL之CpG-ODN结合虾血球细胞的百分率
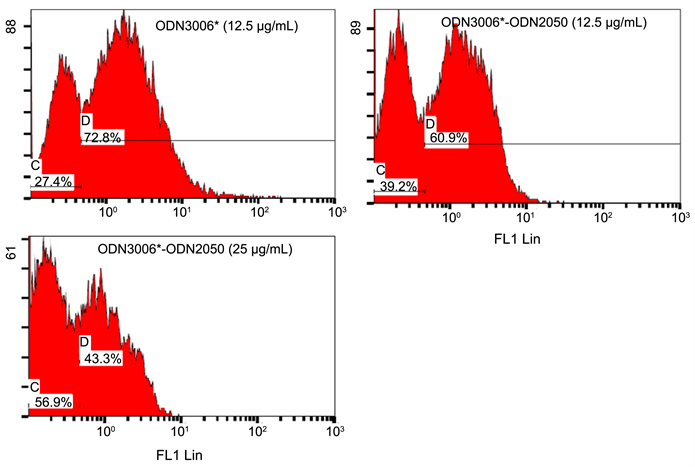
Figure 3. Distribution of prawn hemocyte bound by two CpG-ODN detected by single-fluorescent staining
图3. 利用单荧光素染法测定两种CpG-ODN结合虾子血球细胞的分布
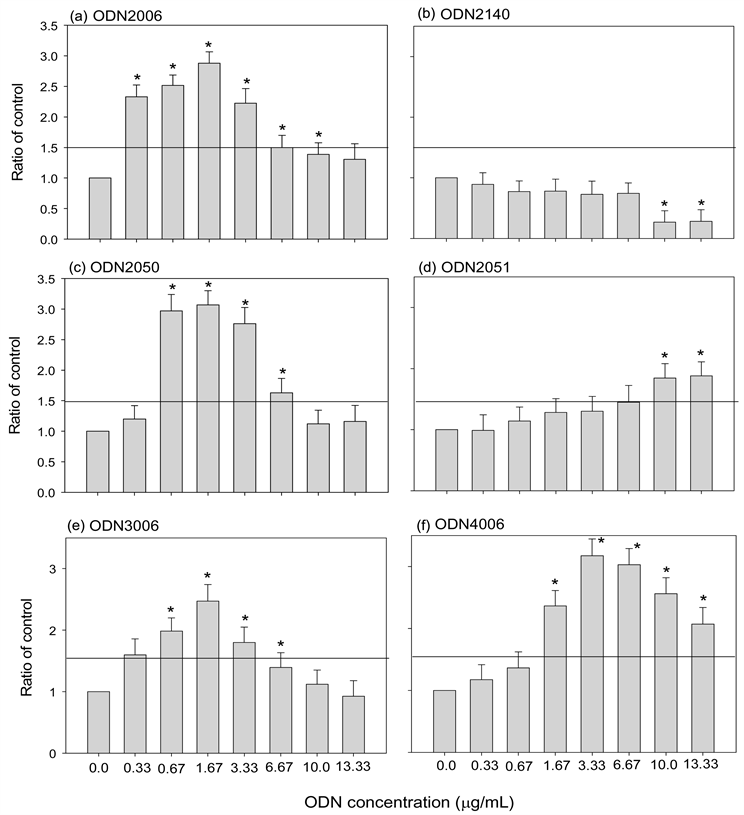 直线为实验组酵素活性为无ODN处理之对照组活性的1.5倍之标记。*表示实验组数据经统计分析明显与对照组具有差异(p < 0.05)。
直线为实验组酵素活性为无ODN处理之对照组活性的1.5倍之标记。*表示实验组数据经统计分析明显与对照组具有差异(p < 0.05)。
Figure 4. Intracellular phenoloxidase activity (POT) after hemocytes treated with different concentrations of CpG-ODN
图4. 不同浓度CpG-ODN处理虾血球后释出胞外的总酚氧化酵素活性(POT)
因感染而造成的死亡。实验以LPS诱发虾子发炎反应后1天,以致病菌Lactococcus garviae (1 × 108 cells/尾)感染虾子后发现,感染但未以ODN处理组之虾子的死亡率为85%;当虾子感染的同时以剂量2 mg/尾的ODN3006或ODN2140处理后,虾子的死亡率分别会降低至65%和60% (表3)。
4. 讨论
Krieg等(1995)设计合成许多长度不同的CpG-ODN以进行活性研究指出,具有刺激免疫功能的最佳
 (a)为处理后一小时测定血浆中POT;(b)为处理后三小时后测得血球的基因表现。*表示实验组数据经统计分析明显与对照组具有差异(p < 0.05)。
(a)为处理后一小时测定血浆中POT;(b)为处理后三小时后测得血球的基因表现。*表示实验组数据经统计分析明显与对照组具有差异(p < 0.05)。
Figure 5. Phenoloxidase activity and immune-related gene expression after prawn injected with different CpG-ODNs
图5. 不同CpG-ODNs注射虾子后PO活性及免疫相关基因的表现
ODN是以CpG为核心且由20个核苷酸组成 [7] ;但是邻近CpG的区域序列不同,在小鼠和人类的刺激效果有异 [22] ;其他研究也证明,CpG基序(CpG motif)的刺激效应具有序列特异性的(sequence specific),且核心的CpG改成GpC会丧失活性的刺激效应 [7] [23] 。在哺乳类,对于合成对免疫细胞有效CpG-ODN的相关研究已多有了解,但是在其他物种或脊椎动物了解则非常有限。在鱼类养殖,已知CpG寡脱氧核醣核酸(简称CpG-ODN)具有刺激免疫活性,可做为疫苗的佐剂;但是序列不同对相同免疫反应的效果不

Table 3. Mortality of LPS-stimulated prawn treated with inhibitory CpG-ODN after infection
表3. 脂多醣刺激之虾子以抑制性CpG-ODN处理后感染的死亡率
注:d表示感染后天数。N表示实验用的数目。连续2天没有死亡发生后再出现的死亡被认定为非专一性死亡(详见材料方法)。
同外,核心基序反向则会使刺激性消失 [23] [24] 。
本研究室曾利用不同序列CpG-ODN刺激虾子的血球细胞后发现,ODN2006激发虾血球基因proPO的表现会被os-ODN13抑制 [16] ,推测不同序列的ODN可能对虾免疫力具有不同效应。Sun等(2013)曾将5种分别对哺乳类和水生动物有效的CpG-ODNs连结成一段富含CpG且110个核苷酸组成的ODN,发现可以诱发白虾的细胞性免疫力 [25] 。Su等(2016)曾根据已发表的6段ODNs以及3段能刺激草鱼(Ctenopharyngodon idella)头肾单核细胞增生的ODNs,组合成一段新的ODN1670A,证明此ODN能激发TLR9表现以及在病毒感染时促进第二型干扰素(IFNγ)表现 [26] 。因此,我们认为利用不同策略发展不同影响效应的CpG-ODN以应用在养殖虾,以调节不同状况时虾子的免疫力,应该是非常重要且可行的。
本研究室曾收集已发表且分别与鱼类和人类有关的CpG寡聚脱氧核苷酸各30段和11段,其中32段为刺激序列和9段为抑制序列。以oligomer计数程序进行序列分析后,分别根据在刺激序列和抑制序列中出现次数较多的5-mer和6-mer核心基序,以头尾相接方式随机排列获得数段疑为刺激性和抑制性之不同序列ODN (未公开)。本研究随机选择一段四段疑为抑制性或刺激性的ODN2050、ODN2051、ODN3006及ODN4006进行免疫调节作用的分析。由于本研究试图找到对虾子免疫力具有不同影响的CpG-ODN,实验虾在进行分析前会以M199缓冲液于体外处理血球细胞,分别测定胞内和胞外POT,当胞外POT低于胞内POT的虾子,则被认定为未发炎的虾子。
4.1. CpG-ODN于体外对血球细胞的作用
Sung等(2010)实验指出,CpG-ODN直接结合血球细胞以刺激活性 [17] 。因此,本研究首先确定四种CpG-ODNs是否结合血球细胞,接着再利用体外实验,初步决定四种CpG-ODNs对血球细胞的直接影响效应。相较于ODN2006和ODN2140分别于30和40 mg/mL时可以结合近95%和92%的血球细胞,本研究的四种ODNs中,ODN2050和ODN2051也可以与超过95%的细胞结合,但所需浓度较低;然而ODN3006和ODN4006于50 mg/mL时,只能与72%和88%的细胞结合。这些结果推测,ODN2050和ODN2051可以作用大部分的血球细胞,ODN3006和ODN4006则与特定的血球族群结合,尤其是ODN3006。此外,由图1的低浓度ODN与血球结合率和结合50%血球细胞所需浓度(BC50)结果发现,ODN2050于0.5 mg/mL能与8.1%细胞结合,1 mg/mL能结合21%血球,均高于其他的ODNs,且BC50也远低于其他ODNs。由本研究的图3结果,ODN2050和ODN3006能与相同细胞族群的相同分子结合,随ODN2050浓度增加,能与ODN3006结合者下降。这些结果推测的可能原因包括:ODN2050结合血球细胞的亲和力高于其他ODN或是血球细胞上能与ODN2050结合的分子种类不只一种。这些推测仍须进一步利用竞争实验和其他方法作验证。
不论细胞结合率是否有差异,在没有其他因子的影响下,正对照的ODN2006和四种ODNs都能增加虾子血球胞外的POT,即刺激释颗粒作用;但是效刺激浓度有差异(图3)。负对照的ODN2014则会抑制释颗粒作用。研究曾指出,核心的CpG改成GpC后会失去对小鼠和鱼类的刺激效应 [7] [23] 。有趣地,ODN2050则是根据此原则而设计,将具有CG且为抑制性的ODN2014序列中再增加CG而获得,预测可能具抑制作用,但本次的体外测定结果却与预期相反。推测其可能原因有三:需要虾体内其他因子的偕同作用才会具有抑制作用、CG重复次数与ODN效果有关、以及物种差异所致。
4.2. CpG-ODN于虾体内对血球免疫反应的影响
由于虾体内影响因子复杂,为了解体外实验所测得ODNs的作用是否在进入虾体后仍是一致的,本研究进一步将不同序列的CpG-ODNs注射入虾体腔后,分析血球的释颗粒作用(POT表现)以及血球内三个原酚氧化酵素活化系统(PAS)相关的基因(propo、pon和α2-m)和一个抗微生物基因alf的表现(mRNA表现量)。结果显示,正对照之促进性ODN2006能增强血球释颗粒作用和促进四种免疫基因的转录;ODN2050和ODN2051对三种PAS相关基因的转录均都具促进作用,且增强血浆POT的结果与体外实验结果一致,其中ODN2050效果优于ODN2051。Xu等(2016)研究指出,亲和力强的ODN刺激虾子免疫力的效果强于亲和力弱者 [27] 。根据图1和图2血球结合率的结果,我们推测ODN2050的亲和力可能高于ODN2051。
意外地,ODN3006于体外能刺激释颗粒作用,但在虾体内不但对血浆POT和基因α2-m无影响,且抑制基因propo和pon的转录,对血球的影响效应与抑制性的ODN2140雷同(图5)。针对淡水长脚大虾,过往的研究已经证明ODN2006进入虾体后可以经由不同讯号路径来激活虾血球的PAS 活性和促进基因propo的转录;而os-ODN13不影响propo表现但会抑制ODN2006的促进效应 [15] [16] [17] 。由上述结果推测,ODN2050、ODN2051和ODN3006可能透过不同路径以影响虾子的PAS,前两种ODNs如ODN2006应该属促进性;而ODN3006则可能是抑制性。至于ODN4006可能与os-ODN13相似,可能具有中和其他ODN的影响效应,属中和型。
前人实验指出,不同物种能辨识的ODN可能有差异 [8] ,邻近CpG的区域序列不同,在不同物种之间的刺激效果也不同 [22] ,显示CpG基序的刺激效应具有序列特异性的 [7] [23] 。本研究的四种CpG-ODNs是根据已知对鱼类和人类有影响的ODN设计而获得。体外及体内实验发现,ODN2050的影响效应均与设计所预测的相反。之前曾推测ODN2050可能需要虾体内其他因子的偕同作用才会具有抑制作用。但是体内实验证明此推测不成立。另外,ODN3006核心中不具CG且GC重复数多于ODN2006,但于虾体内的影响效也与预测相反。根据本研究的免疫反应与细胞结合率等结果推测本实验的四种CpG-ODNs效应之差异,除了可能因物种不同造成ODN2050和ODN3006的影响与预测有差异外,ODN核心中GC和CG出现频率以及ODN对血球的结合率和亲和力都可能与ODN的影响效应与关。这些必须更多实验已证明之。
4.3. 抑制性CpG-ODN降低发炎性虾子感染后的死亡
脂多醣分子(LPS)为病原相关的分子模式(PAMP)之一,可以增强动物的发炎反应,包括虾类 [28] 。为确认实验虾处在发炎状态,我们在预备实验中,以虾子血浆中的POT和血球内谷胱甘肽过氧化酶活性( Glutathione Peroxidase, GPx)作为发炎指标,测得每一尾虾子注射2.5 μg的脂多醣分子(LPS)后1小时,虾子之POT (45.7 ± 9.92 U/min/mg)高于未注射LPS的对照组组(64.4 ± 8.10 U/min/mg),GPx活性(6.1 ± 1.7 U/mg)也高于对照组(2.6 ± 1.5 U/mg)。因此,本研究将2.5 μg/尾LPS剂量注射处理后之虾子定义为发炎性虾子。本研究假设感染后虾子能因给予抑制性ODN减缓发炎作用而降低因感染造成的死亡率。以易感性实验发现,疑似抑制性ODN3006或ODN2140处理之发炎性虾子在感染后的死亡率确实低于未处理组死亡率(表3),显示虽然无法大幅度降低发炎状态虾子的易感性,但此两种抑制性ODNs仍然具有降低虾子死亡的效用,证明ODN3006和ODN2140应为抑制性。至于ODN3006的抑制性是否与亲和力(图1)较低和仅结合特定血球族群(图2)有关,须进一步厘清。
5. 结论
综合本研究实验结果,四段不同序列的CpG-ODNs对虾子免疫反应具有不同的调节作用。ODN2050和ODN2051都能增强虾子血球的释颗粒作用和PAS;反之,ODN3006抑制这些血球的免疫反应;ODN4006则对免疫反应无明显影响。此外,抑制性ODN3006能降低发炎状态之虾子的易感性。本研究结果可以提供开发不同效应之CpG-ODNs以应用于养殖业之参考。未来或许可以视养殖虾子的状态,选择最适效应的ODN以提升养殖期间虾子的存活。以受到感染且发炎的虾子为例,持续给予促进性ODN2050,也许会导致过度发炎反应而加速虾子的死亡;若给予抑制性ODN3006可能降低发炎而减缓虾子的伤害。
致谢
本研究感谢科技部补助研究经费(NSC 98-2313-B-031-001-MY3)得以顺利完成。