1. 引言
肝癌是最常见的恶性肿瘤,其致死率在肿瘤中排第三 [1] [2] 。随着医疗技术和水平升高,肝癌病人生存期得到一定延长。但是,大多数患者在诊断时已经处于肝癌晚期,其生存期一般小于1年 [3] [4] 。诱导肿瘤凋亡是治疗肿瘤的重要策略。因此,寻找有效诱导肝癌细胞凋亡的因子尤为重要。
干扰素-γ (Interferon-γ,INF-γ)是Ⅱ型干扰素。大量研究表明,INF-γ除具有广谱抗病毒功能外,对免疫系统也起着调节作用 [5] 。进一步研究发现INF-γ能够干扰细胞周期,抑制细胞增殖 [6] 。在肿瘤方面,INF-γ增强神经母细胞瘤细胞对TRIAL的敏感性 [7] 。INF-γ主要通过调控免疫系统抑制肿瘤生长 [8] 。INF-γ在肝癌病人血清中表达各异,有升高,也有下调 [9] [10] 。但是,INF-γ对肝癌作用及分子机制方面研究尚少。
在这篇论文中,首先用ELISA方法检测肝癌病人血清中INF-γ水平,同时研究INF-γ对肝癌作用。此外,构建ATGL过表达质粒,进一步研究INF-γ通过ATGL诱导肝癌细胞株HepG2凋亡作用及分子机制。
2. 材料与方法
标本收集
健康人和肝癌病人血清来自广州医科大学附属第三医院。血清采集时间为2017年1月到2017年12月。健康人和肝癌病人相关临床信息见表1。所有病人资料和标本收集都严格按照广州医科大学伦理委员会相关规定。伦理批准时间为2017年1月。
试剂和耗材
INF-γ ELISA检测试剂盒购自Genestar生物科技公司(货号C608)。MTT试剂购自北京鼎国公司。Caspase-3活性试剂盒购自碧云天公司(货号C115)。Bax和Bcl-2抗体购自CST公司。ATGL抗体购自Abcam公司。DNA maker购自Bio-Rad公司。ATGL引物由Invitrogen公司合成。RNA提取试剂盒购自康为世纪公司。DNA聚合酶购自Takara公司。INF-γ蛋白购自Sigma公司。

Table 1. Clinical information related to health and liver cancer patients
表1. 健康人和肝癌病人相关临床信息
ATGL过表达质粒构建
在Pubmed上面调出ATGL基因CDS序列,根据ATGL基因CDS序列设计克隆引物(引物1F:5'-CCCAAGCTTATGTTTCCCCCGCGAGAAGACG-3';引物1R:5'-CCGGAATTCCAGCCCCAGGGCC CCGATCACGG-3'),以HepG2细胞cDNA为模板,进行PCR钓取ATGL基因,酶切、连接到pcDNA3.1+载体上,经公司测序确定ATGL过表达质粒构建成功。
MTT法检测肝癌细胞HepG2增殖能力
MTT法,即噻唑兰颜色反应法,是反映细胞增殖活力的测定方法 [11] 。活细胞里面线粒体琥珀酸脱氢酶能使MTT还原为不溶于水的蓝紫色晶体——甲缵,并沉淀在细胞里面,而死细胞则并不能使细胞里面的甲缵沉淀。取对数生长期肝癌细胞,接种到96孔细胞培养板中,每孔加入100 µl细胞悬液,置于37℃、5% CO2细胞培养箱中培养;细胞贴壁后其融合度达到80%左右,用INF-γ蛋白处理,不同时间点(24 h, 48 h, 72 h)加入10 µl的MTT工作液(浓度为5 mg/ml),继续培养4小时;去掉上清后每孔加入200 µl dimethyl sulfoxide (二甲基亚砜,DMSO),37˚,150转/min震荡摇匀10分钟,以使蓝色结晶颗粒甲缵完全溶解,用酶标仪测定OD490的光密度值。实验中每个实验组设置6个重复的培养孔,重复进行3次。
Caspase-3活性试剂盒检测肝癌细胞HepG2的Caspase-3活性
收集处理好的肝癌细胞HepG2,600 g 4℃离心5分钟收集细胞,小心吸除上清,同时确保没有细胞被吸除,PBS洗涤一次。离心吸尽上清后,按照每200万细胞加入100 µl裂解液的比例加入裂解液,重悬沉淀,冰上裂解15分钟。4℃ 16,000~20,000 g离心10~15分钟。把上清转移到预冷的离心管中,立即测定caspase-3的酶活性。
统计学分析
采用SPSS17.0软件进行统计学处理。计量资料以均数±标准差表示。血清中INF-γ水平和MTT水平采用t检验。P < 0.05表示具有统计学意义。
3. 实验结果
肝癌病人血清INF-γ水平下调
为了检测INF-γ在肝癌病人血清中水平,收集了30例健康人和肝癌病人的血清,用ELISA试剂盒检测血清中INF-γ水平。30例健康人和肝癌病人临床信息见表1。结果显示,与对照组相比,肝癌病人血清中INF-γ水平明显低于健康人(图1)。
INF-γ升高Caspase-3酶活性、下调Bcl-2/Bax比例、诱导肝癌细胞HepG2凋亡
为了进一步研究血清INF-γ对肝癌细胞作用,MTT法检测INF-γ处理HepG2细胞后细胞活力。结果显示,在不同时间点(24 h,48 h和72 h),INF-γ都明显抑制HepG2细胞生长(图2(a))。为了研究INF-γ对肝癌细胞凋亡作用,Caspase-3酶活性试剂盒检测INF-γ处理肝癌细胞后Caspase-3酶活性。结果显示,INF-γ明显升高肝癌细胞HepG2的Caspase-3酶活性(图2(b));同时,Western blot结果显示INF-γ明显升
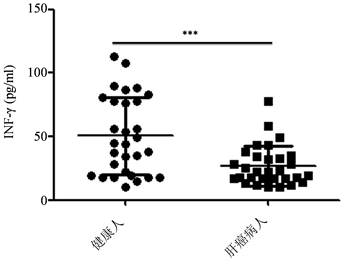 ELISA法检测肝癌病人血清中INF-γ水平(n = 30)。***<0.001。
ELISA法检测肝癌病人血清中INF-γ水平(n = 30)。***<0.001。
Figure 1. The level of INF-γ in HCC patients’ serum
图1. INF-γ在肝癌病人血清中水平
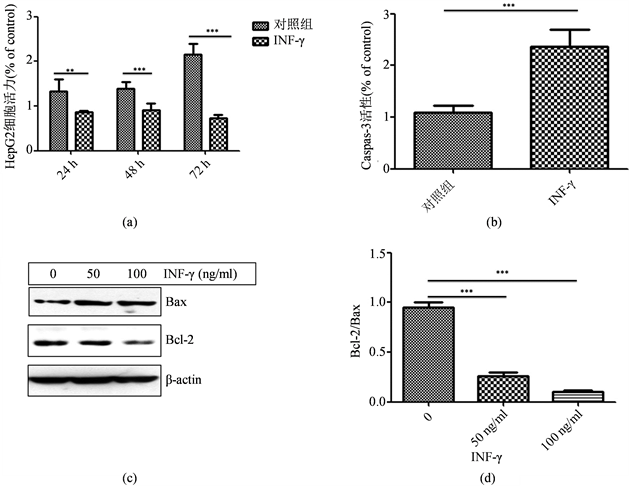 (a) MTT检测肝癌细胞HepG2活力。50 ng/ml INF-γ处理HepG2细胞24 h,48 h和72 h,MTT法检测细胞活力。**<0.01,***<0.001。(b) HepG2细胞Caspase-3酶活性检测。50 ng/ml INF-γ处理HepG2细胞48 h,检测细胞Caspase-3酶活性。***<0.001。(c) Western blot检测HepG2细胞Bcl-2和Bax蛋白水平。50 ng/ml和100 ng/ml INF-γ处理HepG2细胞48 h,Western blot检测细胞Bcl-2和Bax蛋白水平。β-actin为上样对照。(d) Bcl-2/Bax比例。***<0.001。
(a) MTT检测肝癌细胞HepG2活力。50 ng/ml INF-γ处理HepG2细胞24 h,48 h和72 h,MTT法检测细胞活力。**<0.01,***<0.001。(b) HepG2细胞Caspase-3酶活性检测。50 ng/ml INF-γ处理HepG2细胞48 h,检测细胞Caspase-3酶活性。***<0.001。(c) Western blot检测HepG2细胞Bcl-2和Bax蛋白水平。50 ng/ml和100 ng/ml INF-γ处理HepG2细胞48 h,Western blot检测细胞Bcl-2和Bax蛋白水平。β-actin为上样对照。(d) Bcl-2/Bax比例。***<0.001。
图2. INF-γ升高Caspase-3酶活性、下调Bcl-2/Bax比例、诱导肝癌细胞HepG2凋亡
高HepG2细胞Bax蛋白水平,下调Bcl-2蛋白水平,下调Bcl-2/Bax比例(图2(c) and图2(d)),表明INF-γ升高caspase-3酶活性、下调Bcl-2/Bax比例、诱导肝癌细胞HepG2凋亡。
INF-γ下调肝癌细胞株HepG2中ATGL蛋白水平
上面结果提示INF-γ诱导肝癌细胞HepG2凋亡,但是其具体分子机制尚未清楚。文献报道ATGL促进肿瘤细胞增殖、生长 [12] 。为了研究ATGL在INF-γ诱导肝癌细胞HepG2凋亡中作用,我们首先检测INF-γ对HepG2细胞ATGL影响。结果显示,50 ng/ml和100 ng/ml INF-γ明显下调HepG2细胞ATGL蛋白水平,提示ATGL可能参与INF-γ诱导肝癌细胞HepG2凋亡过程(图3(a))。
ATGL参与INF-γ诱导肝癌细胞株HepG2凋亡过程
为了研究ATGL在INF-γ诱导肝癌细胞HepG2凋亡中作用,我们首先构建ATGL过表达质粒。INF-γ处理肝癌细胞HepG2的同时过表达ATGL,观察ATGL是否参与INF-γ诱导肝癌细胞HepG2凋亡过程。MTT结果显示,过表达ATGL后,INF-γ诱导肝癌细胞HepG2凋亡被抵消(图4(a))。此外,Caspase-3酶活性实验也表明,ATGL能阻止INF-γ升高HepG2细胞的Caspase-3酶活性(图4(b)),表明ATGL参与INF-γ诱导肝癌细胞HepG2凋亡过程。
4. 讨论
肝癌是最常见的恶性肿瘤,其死亡率在恶性肿瘤中排名前列 [1] 。诱导肝癌细胞凋亡是治疗肝癌重大策略之一 [13] 。INF-γ主要由活化的T淋巴细胞和NK细胞分泌,具有抗病毒、调控细胞周期、抗肿瘤作用 [14] 。本论中,我们发现肝癌病人血清INF-γ明显低于健康人,进一步研究发现INF-γ通过调控ATGL蛋白水平,升高Caspase-3酶活性、下调Bcl-2/Bax比例、诱导肝癌细胞HepG2凋亡。
 Western blot检测HepG2细胞ATGL蛋白水平。50 ng/ml和100 ng/ml INF-γ处理HepG2细胞48 h,Western blot检测细胞ATGL蛋白水平。β-actin为上样对照。
Western blot检测HepG2细胞ATGL蛋白水平。50 ng/ml和100 ng/ml INF-γ处理HepG2细胞48 h,Western blot检测细胞ATGL蛋白水平。β-actin为上样对照。
Figure 3. INF-γ down-regulates the level of ATGL protein in HepG2 cells
图3. INF-γ下调肝癌细胞株HepG2中ATGL蛋白水平
 (a) MTT法检测肝癌细胞株HepG2生长情况。50 ng/ml INF-γ处理HepG2细胞的同时过表达ATGL,48 h后行MTT检测。*<0.05,***<0.001。(b) HepG2细胞Caspase-3酶活性检测。50 ng/ml INF-γ处理HepG2细胞的同时过表达ATGL,48 h后检测细胞Caspase-3酶活性。***<0.001。
(a) MTT法检测肝癌细胞株HepG2生长情况。50 ng/ml INF-γ处理HepG2细胞的同时过表达ATGL,48 h后行MTT检测。*<0.05,***<0.001。(b) HepG2细胞Caspase-3酶活性检测。50 ng/ml INF-γ处理HepG2细胞的同时过表达ATGL,48 h后检测细胞Caspase-3酶活性。***<0.001。
Figure 4. ATGL participates in the process of INF-γ induced HepG2 apoptosis
图4. ATGL参与INF-γ诱导肝癌细胞株HepG2凋亡过程
干扰素家族主要包括类3干扰素,第一类包括IFN-α,IFN-β,IFN-ω,IFN-κ和IFN-ε;第二类只有IFN-γ,第三类主要是IFN-λ。IFN-γ为免疫调控因子,具有抗增殖、抗病毒、抗肿瘤等功能 [15] 。不同研究表明肝癌血清中IFN-γ水平各异 [9] [10] ,我们实验发现IFN-γ在肝癌病人血清中下调,不同实验结果的差异可能和肿瘤治疗、大小有关。文献报道IFN-γ可引起肝细胞的细胞周期阻滞和细胞凋亡,诱导肝癌凋亡 [16] ,但是其具体分子机制尚未清楚。我们研究发现INF-γ升高Caspase-3酶活性、下调凋亡家族蛋白Bcl-2/Bax比例、诱导肝癌细胞HepG2凋亡,此外,进一步研究发现INF-γ下调ATGL蛋白水平,进而诱导肝癌细胞HepG2凋亡。
ATGL,脂肪甘油三酯脂肪酶,是脂肪降解的第一个酶,使脂肪降解为甘油二脂,启动脂肪动员 [17] 。最近研究发现ATGL与肿瘤增殖有关 [12] 。为了验证ATGL蛋白参与INF-γ诱导肝癌细胞HepG2凋亡过程,我们构建ATGL过表达质粒。在INF-γ处理肝癌细胞HepG2的同时过表达ATGL,结果表明ATGL参与INF-γ诱导肝癌细胞HepG2凋亡过程。文献报道INF-γ发挥生物学功能时并不是直接作用于靶细胞,而是与细胞表面受体IFNGR1或IFNGR2结合,从而利用INF-γ信号传导机制激活细胞内多种效应因子来发挥功能 [18] 。INF-γ下调ATGL蛋白水平,进而诱导肝癌细胞HepG2凋亡是否也是通过与细胞表面受体IFNGR1或IFNGR2结合起作用尚未清楚,是我们本论文的局限地方,还值得我们进一步研究。
总之,在这篇论文中,我们实验结果证明INF-γ在肝癌病人血清中下调,INF-γ下调ATGL蛋白水平,升高Caspase-3酶活性,下调凋亡家族蛋白Bcl-2/Bax比例,进而诱导肝癌细胞HepG2凋亡。
基金项目
本论文由广州市卫生局(2017A011312)和广州医科大学科学科研项目博士启动(2015C24)支持。