1. 引言
临床血管支架的植入常常伴随着内皮细胞的损伤,从而导致植入部位急性凝血以及平滑肌细胞表型的失调。BVLD是一种特异性可逆的凝血酶抑制剂 [1] 。其可与凝血酶结合而使其失活,从而实现抗凝血的功能。然而,只抑制凝血酶的活性并不能取得良好的抗凝血效果,因此本研究还采用NO抑制血小板的粘附、激活来与BVLD协同地发挥作用。NO作为内皮细胞的生物活性分子,不仅能通过CGMP信号通路抑制血小板的粘附和激活,而且能够抑制平滑肌的粘附和增殖 [2] [3] [4];此外,NO还具有免疫响应、抗癌和抗菌的作用 [5] [6] [7] 。由于人体内的内源性RSNO水平恒定,在涂层表面引入的催化剂可以持续稳定的产生NO [8] 。本研究中选取SeCA作为NO的催化剂。由于PPAam表面的-NH2量有限,所以通过在PPAam表面接枝TA来提供大量的活性位点,从而固定大量的BVLD和SeCA,构建PPAam@TA@BVLD + SeCA涂层。
2. 材料与方法
2.1. 实验试剂
烯丙胺、比伐卢定(BVLD)、单宁酸(TA)、N-二羟乙基甘氨酸(Bicine)缓冲液、磷酸盐(PBS)缓冲液、NaOH溶液、罗丹明染色试剂、活化部分凝血活酶时间(APTT)购自Sigma公司、CCK-8试剂购自同仁化学研究所。
2.2. 各类涂层的制备
采用实验室自制脉冲射频可调制波等离子体聚合系统在316L SS样品表面沉积等离子体聚烯丙胺薄膜(PPAam)。采用−250 V的直流偏压源,氩气(Ar)做保护气体。将沉积PPAam的样品浸没在TA溶液(0.2 mg/mL, pH = 9)中室温下反应12小时后,清洗、干燥获得PPAam@TA样品。将制备的PPAam@TA样品浸没在BVLD溶液(0.2 mg/mL, pH = 9)中常温下反应12 h,清洗、干燥获得PPAam@TA@BVLD样品。而将制备的PPAam@TA浸没在SeCA溶液(0.2 mg/mL, pH = 9)中常温下反应12 h,清洗干燥后获得PPAam@TA@SeCA样品。将制备的PPAam@TA样品浸没在BVLD溶液中常温下反应40min,清洗后加入SeCA溶液,室温下反应8 h,清洗、干燥获得PPAam@TA@BVLD + SeCA多功能分子涂层。
制备各涂层的工艺如图1所示,通过QCM技术精确调控BVLD和SeCA的接枝量为1:1,通过对比PPAam@TA@BVLD + SeCA、PPAam@TA@SeCA和PPAam@TA@BVLD涂层的材料学结果,验证PPAam@TA@BVLD + SeCA涂层是否以1:1的比例接枝,并对比PPAam@TA@BVLD + SeCA、PPAam@TA@SeCA和PPAam@TA@BVLD涂层的生物学结果,评价PPAam@TA@BVLD + SeCA涂层中BVLD和TA是否协同地发挥了作用。
2.3. 材料学表征
2.3.1. QCM实时动态检测活性分子接枝量
将PPAam@TA涂层改性的石英晶片安装到QCM-D流动腔内,通入PBS缓冲液,待基线跑平20 min后通入0.2 mg/mL BVLD溶液,接枝量达到饱和后通入PBS缓冲液进行清洗。SeCA的接枝定量,以及BVLD + SeCA的双分子的接枝定量方法相同。
2.3.2. 其它材料学评价
采用傅立叶变换红外光谱法(FTIR, NICOLET 5700)检测上述各涂层表面的红外吸收峰。检测模式为漫反射,测量范围设定为4000~500 cm−1。X射线光电子谱(XPS, XSAM800)对上述各涂层表面成分进行检测,分析各个涂层中C、O、N、Se的原子含量百分比。
2.4. NO催化速率检测
采用NO测定仪(Sievers NOA 280i)进行NO催化速率的测定。向反应槽中加入5 mL的PBS溶液(含0.5 µmol/ml的EDTA、30 µmol/mL的GSH和SNAP),待基线跑平后,将PPAam@TA@SeCA、PPAam@TA@BVLD + SeCA不锈钢片插入反应槽中,待曲线不再有明显变化终止实验,记录NO催化释放速率。
2.5. 生物学评价
2.5.1. APTT
将0.2 mL APTT溶液滴加到样品表面,使其完全覆盖或者浸没,37℃孵化半小时,吸出样品上的APTT
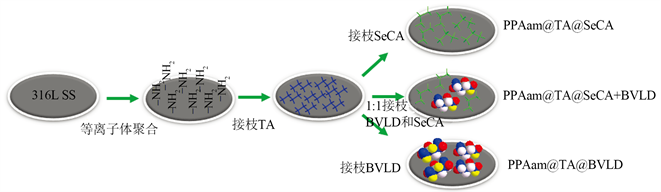
Figure 1. The schematic diagram of preparation of PPAam, PPAam@TA, PPAam@TA@BVLD, PPAam@TA@SeCA, PPAam@TA@BVLD + SeCA coatings
图1. PPAam、PPAam@TA、PPAam@TA@BVLD、PPAam@TA@SeCA、PPAam@TA@BVLD + SeCA涂层制备的示意图
试剂,加入0.2 mL待测的血浆,观测凝血现象,当出现白色絮状物时记录其凝血时间。取0.2 mL待测血浆加入0.2 mL的APTT试剂作为空白对照。
2.5.2. 人脐静脉内皮细胞(HUVECs)及人脐静脉平滑肌细胞(HUVSMCs)增殖
样品表面分别接种密度为2 × 104 cells/cm2的HUVECs和HUASMCs;分别培养1天和3天后吸出培养基,PBS清洗两次后加入350 µL含有10% CCK-8试剂的完全培养基(无酚红),37℃、5% CO2条件下孵育3小时。孵育结束后,每孔吸取200 µL反应液到96孔板,置于酶标仪(µQuant)中检测溶液在450 nm处的吸光度值(n = 4)。
3. 结果和讨论
3.1. QCM实时动态检测活性分子接枝量
图2(a)为PPAam@TA表面BVLD的实时接枝量,结果显示324 ng/cm2的BVLD有效固定在PPAam@TA表面;从其局部放大图(b)中可看出,接枝饱和量的1/2的时间点为40 min,该时间点作为BVLD + SeCA共固定时间设定的依据;图2(c)是QCM-D实时动态监测技术检测SeCA在PPAam@TA表面接枝量的动态曲线,结果显示约450 ng/cm2的SeCA固定在PPAam@TA表面;图2(d)为PPAam@TA表面BVLD和SeCA共固定的动态曲线,如图所示,通入BVLD溶液反应40 min后时,接枝量达到200 ng/cm2左右,通入PBS缓冲液清待洗。清洗结束后通入SeCA溶液反应6h。最终结果显示BVLD的有效结合量为163 ng/cm2而SeCA的结合量为176 ng/cm2,PPAam@TA表面BVLD和SeCA的有效结合量基本满足1:1的比例。
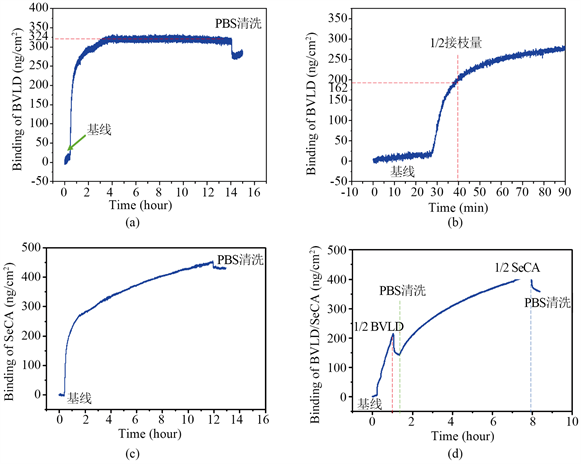
Figure 2. (a) Chemical conjugation of BVLD; (c) SeCA; (d) BVLD + SeCA onto the PPAam@TA surface monitored by real-time QCM-D; (b) enlarged image of figure (a)
图2. (a)通过QCM-D技术监测BVLD;(c) SeCA;(d) BVLD + SeCA在PPAam表面的实时接枝曲线图; (b):(a)的局部放大图
3.2. 涂层的FTIR及XPS结果
图3是PPAam、PPAam@TA和PPAam@TA@BVLD涂层的红外光谱图,从图中可以看出,PPAam涂层在3350 cm−1出现了N-H的伸缩振动峰以及在1650 cm−1出现了N-H的变型振动峰;接枝TA后,PPAam@TA的红外光谱中在1580和1500 cm−1出现了苯环的特征峰,可以证实PPAam表面上成功接枝了TA;进一步接枝BVLD后,PPAam@TA@BVLD涂层中出现了酰胺键(O=C-NH-)的吸收峰,强有力的证明了BVLD的有效固定。
图4(a)是PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD、PPAam@TA@BVLD + SeCA涂层的XPS全谱图,表1为各涂层的元素百分含量。PPAam涂层的全谱中出现了C、N、O的特征峰,证明了PPAam涂层在基底上的沉积;进一步接枝TA后,由于TA中不含有N元素,使得PPAam@TA涂层中N元素含量的明显下降;由于BVLD中的O含量明显高于PPAam@TA涂层的O含量,使得PPAam@TA@BVLD涂层中测得的O原子含量高于PPAam@TA,可进一步说明BVLD的成功固定;PPAam@TA@SeCA涂层的谱线中出现了Se的特征峰,有力的证实了SeCA在涂层表面的接枝;PPAam@TA@BVLD + SeCA涂层的谱线中同样存在Se的特征峰,由于SeCA中O含量为19.1%,BVLD中O含量为24.24%,而PPAam@TA@BVLD + SeCA涂层中O含量介于PPAam@TA@SeCA和PPAam@TA@BVLD涂层的O含量之间,可间接的说明PPAam@TA@BVLD + SeCA涂层的成功制备。
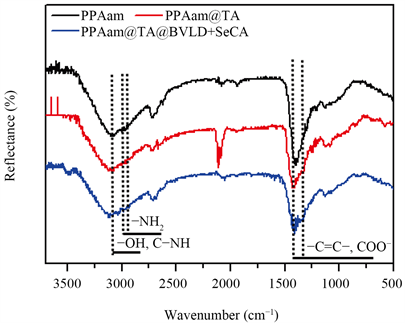
Figure 3. GATR-FTIR spectra of PPAam, PPAam@TA and PPAam@TA@BVLD
图3. PPAam、PPAam@TA和PPAam@TA@BVLD的红外光谱

Table 1. Atomic composition of samples obtained using XPS
表1. 通过XPS得到的各样品的原子组成
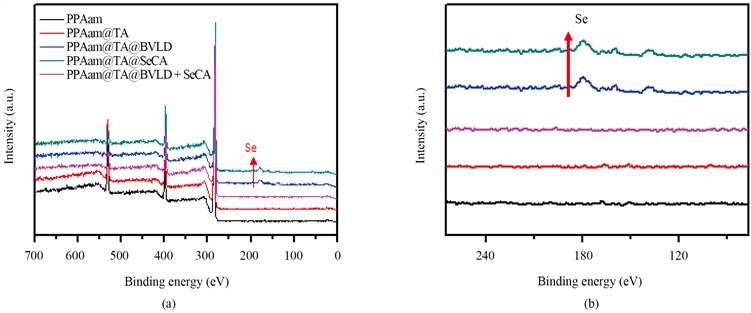
Figure 4. (a) XPS spectra of PPAam, PPAam@TA, PPAam@TA@SeCA, PPAam@TA@BVLD and PPAam@TA@BVLD + SeCA; (b) enlarged image of figure (a)
图4. (a) PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD和PPAam@TA@BVLD + SeCA的XPS的全谱图(b)局部放大图;(b):(a)的局部放大图
3.3. NO催化速率结果
图5是PPAam@TA@SeCA和 PPAam@TA@BVLD + SeCA涂层的NO催化释放速率曲线,可以看出,PPAam@TA@SeCA涂层稳定后的催化速率为0.8 × 10−10 mol∙cm−2∙min−1。PPAam@TA@BVLD + SeCA涂层的催化速率为0.45 × 10−10 mol∙cm−2∙min−1。该催化释放速率也间接说明PPAam@TA@BVLD + SeCA涂层中SeCA的接枝量为PPAam@TA@SeCA涂层的1/2。
3.4. APTT
图6是各组样品的凝血时间,结果显示,316L SS、PPAam、PPAam@TA、PPAam@TA@SeCA涂层没有抗凝活性分子,凝血时间均在35~45 s之间,不存在显著性差异;而对PPAam@TA@BVLD涂层的APTT试剂实验显示抗凝时间在65 s以上,与不含BVLD活性分子的其他对照组相比,抗凝血效果明显增强;PPAam@TA@BVLD + SeCA涂层与不含BVLD活性分子的其他对照组相比,也表现出明显的抗凝效果。1/2接枝量的BVLD涂层抗凝效果比完全接枝BVLD涂层抗凝效果略有下降,是由于SeCA占据了涂层一部分接枝的活性位点,造成BVLD的接枝量有所减少,导致凝血时间的下降。
3.5. HUVECs及HUVSMCs增殖
图7是各组样品表面内皮细胞1天和3天的形态结果。1天的结果显示,316L SS表面内皮细胞数量较少,而接枝PPAam后,所引入的-NH2对内皮增殖有促进作用,使得内皮细胞数量有一定的上升;PPAam@TA和PPAam@TA@SeCA上内皮细胞的数量与PPAam相比,无明显差异;而PPAam@TA@BVLD上的内皮细胞数量有了明显的上升,说明BVLD对内皮细胞的增殖有一定的促进作用;PPAam@TA@BVLD + SeCA上的内皮细胞虽不及PPAam@TA@BVLD的多,但相比于其他涂层,数量上仍有较为明显的增加。当培养基中添加了NO供体后,供体组中PPAam@TA@SeCA和PPAam@TA@BVLD + SeCA相比于非供体组,内皮细胞数量的增加十分明显,说明了NO对内皮细胞的增殖起到了促进的作用。这与图(b)中使用CCK-8定量检测内皮细胞增殖的结果一致,均说明了构建的PPAam@TA@BVLD + SeCA表现出良好的促内皮功能。
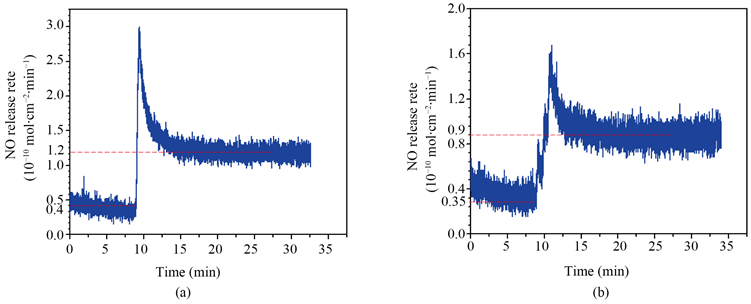
Figure 5. (a) Releaseof NO catalyzed by PPAam@TA@SeCA and (b) PPAam@TA@BVLD + SeCA coating after continuous exposure to the NO donor solution
图5. (a) PPAam@TA@SeCA涂层的NO催化释放速率;(b) PPAam@TA@BVLD + SeCA涂层的NO催化释放速率

Figure 6. Clotting time of 316L SS, PPAam, PPAam@TA, PPAam@TA@SeCA, PPAam@TA@BVLD and PPAam@TA@BVLD + SeCA
图6. 316L SS、PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD和PPAam@TA@BVLD + SeCA的凝血时间
图8是316L SS、PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD和PPAam@TA@BVLD + SeCA涂层表面平滑肌细胞的1天和3天的荧光图及增殖的结果。如图8(a)中1天的结果显示,非供体组中316L SS、PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD 和PPAam@TA@BVLD + SeCA涂层表面的细胞数量基本相差不大,无显著性差异,且细胞呈长梭形,铺展状态良好。而供体组中PPAam@TA@SeCA、PPAam@TA@BVLD + SeCA涂层上平滑肌细胞的数量与非供体组相比明显减少,表明了NO对平滑肌细胞增殖的抑制作用,且由于PPAam@TA@BVLD + SeCA催化释放NO的速率低于PPAam@TA@SeCA,对平滑肌细胞的抑制作用也没有PPAam@TA@SeCA强。3天的结果与1天的结果基本一致,更加明显的表现出NO能抑制平滑肌细胞的增生。这与图(b)中使用CCK-8定量检测内皮细胞增殖的结果一致,均说明了构建的PPAam@TA@BVLD + SeCA表现出抑制平滑肌生长的功能。
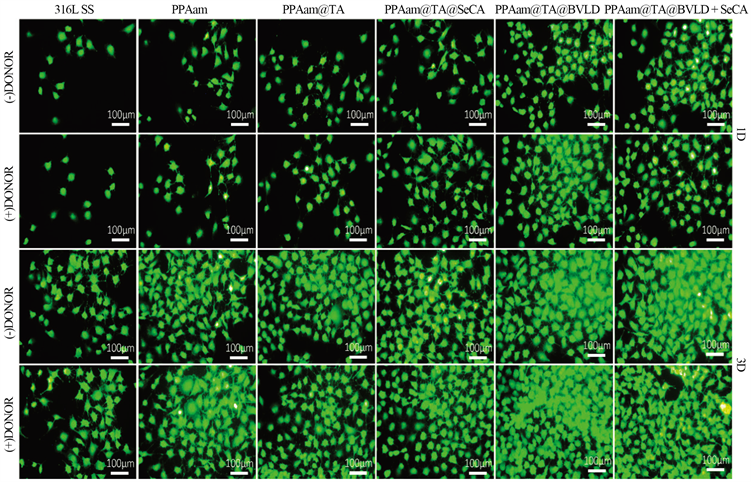 (a)
(a)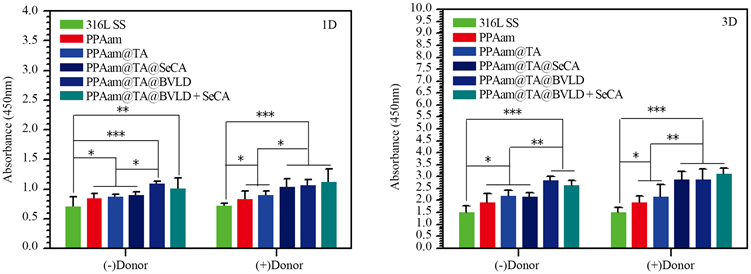 (b)
(b)
Figure 7. Adhesion and proliferationof HUVECscultured on the 316L SS, PPAam, PPAam@TA, PPAam@TA@SeCA, PPAam@TA@BVLD and PPAam@TA@BVLD + SeCA for1 and 3 days, (a) Fluorescent graphs and (b) CCK-8 Value
图7. HUVECs在316L SS、PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD和PPAam@TA@BVLD + SeCA表面的粘附与增殖。(a) 免疫荧光图片,(b) CCK-8检测结果
4. 结论
通过等离子体聚合技术在基材表面打底,进一步接枝TA,为表面提供大量活性位点,再通过迈克加成席夫碱反应实现比伐卢定和硒代胱胺的共固定。红外光谱(FT-IR)和X射线光电子能谱(XPS)的结果表明了涂层的成功制备。通过耗散型石英晶体微天平(QCM-D)确定了比伐卢定和硒代胱胺的接枝量,且通过NO动态实时催化速率检测,测得涂层的NO催化释放速率。活化部分凝血活酶时间(APTT)实验结果
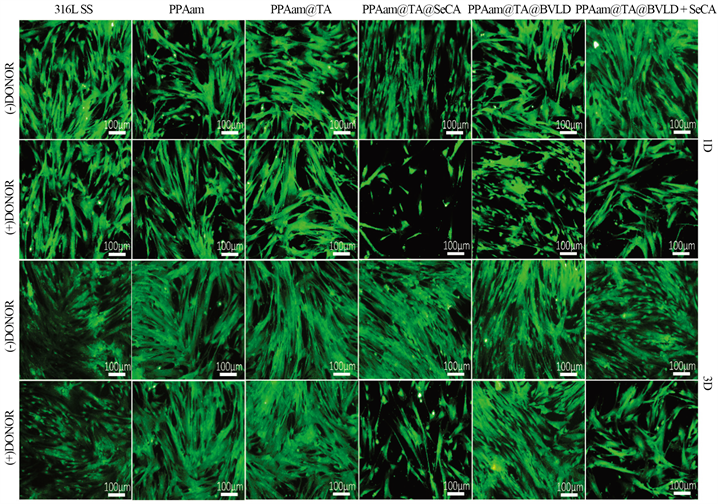 (a)
(a)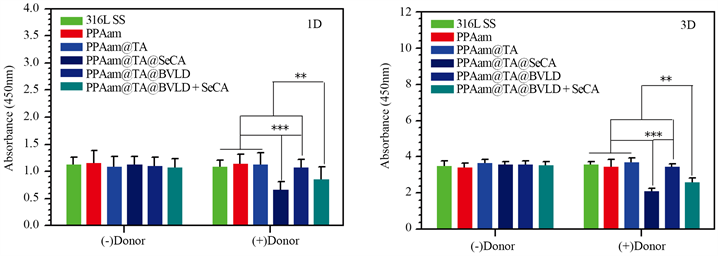 (b)
(b)
Figure 8. Adhesion and proliferation of HUASMCs cultured on the 316L SS, PPAam, PPAam@TA, PPAam@TA@SeCA, PPAam@TA@BVLD and PPAam@TA@BVLD + SeCA for1 and 3 days, (a) Fluorescent graphs and (b) CCK-8 Value
图8. HUASMCs在316L SS、PPAam、PPAam@TA、PPAam@TA@SeCA、PPAam@TA@BVLD和PPAam@TA@BVLD+SeCA表面的粘附与增殖。(a) 免疫荧光图片,(b) CCK-8检测结果
显示,接枝了BVLD的涂层明显地延长了凝血时间。内皮细胞和平滑肌细胞增殖的结果显示,构建的仿生涂层在促进内皮细胞生长的同时显著抑制了平滑肌细胞的生长。
NOTES
*通讯作者。