1. 引言
银耳,是一种胶质真菌,素以肉质厚、胶质重、口感好、营养丰富、药用价值高而闻名于世 [1] 。银耳的药用记录始见于陶弘景所著《名医别录》,后来的《神农本草经》、《本草纲目》及《中国药学大辞典》均记载了银耳的功效 [2] 。银耳多糖占银耳干重的60%以上。银耳多糖的药用功效主要在于加强机体免疫力,抑制肿瘤,降血压降血脂。
曲萌等人研究发现,银耳多糖能激活和提高细胞因子和淋巴细胞的抗肿瘤作用,并且在用药期间对身体内的主要内脏器官无明显的形态学的变化 [3] 。韩英等人研究证实了银耳多糖能较好的抑制肿瘤细胞的增殖 [4] 。过量的自由基可以诱导细胞走向衰老和凋亡。抗氧化就是抑制自由基活动,银耳多糖就有良好的抗氧化作用,周萍等通过比对多种多糖,在体外进行自由基清除的实验发现银耳多糖有较强的抗氧化能力 [5] 。早在之前薛惟建等人研究了银耳多糖调节血糖的作用,结果表明了银耳多糖能调节血糖的含量 [6] 。田春雨等人通过对用链脲佐菌素和高能量饲料喂养的大鼠进行研究,得出结论:模型大鼠的血糖、血脂有效地降低了 [7] 。此外韩英等人通过给小鼠的腹腔内注射银耳多糖,观察银耳多糖是否会使辐射小鼠损伤减少,结果表明银耳多糖对有辐射损伤的小鼠有保护作用 [8] 。
崔蕊静等人通过对比热水浸提、酶法浸提和碱浸提,发现提取效果最好的是酶法浸提,其次是碱浸提;提得银耳多糖最少的是水浸提法 [9] 。黄秀锦对比了酶法浸提和碱浸提,得出结论酶法浸提的效果是最好的,用果胶酶酶解制得银耳多糖效果较好 [10] 。用水提取银耳中多糖的方法操作简单,但是在提取过程中一些非糖物质被提出,后续粗多糖的分离纯化会变得不容易;利用酸碱浸提银耳中多糖的方法,可以提到的多糖中含有水法无法提到的多糖。要注意用酸法提取时多糖易酸解,用碱法时碱的用量可能会破坏多糖结构,会影响多糖的进一步研究;利用酶浸提银耳中多糖的方法,多糖提取量是最大的,杂质也是最少的,但是成本太高,只适用于实验室提取多糖、研究多糖结构 [11] 。提取出来的多糖要在工厂中大量生产,所以不能只考虑提取量,要综合比较多糖的提取方法,选出最适的方法,并不断地探究寻找更好的提取方案。
银耳多糖非常容易溶于水,采用水提法就能提取到银耳中所含的大多数的多糖,热水浸提法操作简单,容易实行并且成本低。但是水提法的缺点就是提取率低,何伟珍等人利用水煮法来提取银耳多糖,银耳粗多糖的提取率只有2.75% [12] 。为了得到更多的银耳多糖,可以在水浸提的基础上加上微波、超声等物理方法来辅助提取。微波是一种超高频电磁波,利用其在300 MHz~300 GHz之间的频率,吴琼等用微波辅助提取银耳中多糖的方法,提取率大都高于10%。微波加热,细胞内水分子吸收微波能,产生热量,终导致细胞破裂,减少了多糖类的残留,提高了提取率 [13] 。超声波的声波频率比20,000赫兹还高,超声波有着定向性、穿透性。银耳多糖的提取是利用超声波的空化效应,造成细胞瞬间破裂,有利于物质溶出,提高银耳多糖的提取率。周雅琳等人通过超声波辅助提取,观察银耳多糖的制得量,比较不同处理方式的影响,结果得出没有进行处理的银耳,粗多糖提取量低了22.48% [14] 。
本研究的对象是银耳子实体,根据超声波辅助水提的方法提取银耳多糖,通过单因素实验优化提取工艺,并且测量不同浓度的银耳多糖抗氧化能力。以希望优化银耳多糖的提取方法并为银耳多糖的开发利用提供参考。
2. 实验材料与方法
2.1. 实验材料与试剂
实验材料:银耳干样;
实验试剂:95%乙醇;1%葡萄糖:准确称取1 g葡萄糖,定容至100 mL,配制成10 mg/mL的葡萄糖溶液,备用;浓硫酸;5%苯酚溶液:准确称取5 g苯酚放入100 mL容量瓶定容,配制成5%苯酚溶液,避光低温保存待用;ABTS;过硫酸钾;PBS缓冲液(PH = 7.4)。
2.2. 实验主要仪器
万能粉碎机;60目筛;电热恒温鼓风干燥箱;电子天平;高速离心机;超声清洗仪;紫外分光光度计;旋转蒸发仪;循环水式多用真空泵。
2.3. 实验方法及步骤
2.3.1. 银耳多糖的提取
(一) 原料的预处理
银耳用自来水清洗干净,放入烘箱中,在50˚C下烘干至恒重,用粉碎机粉碎并且过60目筛,得到银耳粉末备用。
(二) 超声波提取银耳多糖预实验
按一定的料液比混匀,放入超声清洗仪,在温度为60˚C超声强度为40 kHz条件下立即超声20 min,4˚C,8000 rpm/min离心5 min,将上清液收集起来,加入4倍体积的95%乙醇,摇匀,放入4˚C冰箱,沉淀过夜(12~24 h),然后于4˚C,10,000 rpm/min离心机中离心5 min,倒掉上清液,置于烘箱中,调节温度(50˚C ~60˚C),烘干,加1 mL蒸馏水,得多糖原液。
(三) 标准曲线的绘制
将配制好浓度为10 mg/mL的葡萄糖溶液,分别取0 μl、50 μl、100 μl、150 μl、200 μl、250 μl、300 μl,加水补充至1 mL。浓度分别为0.0 mg/mL、0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL、3.0 mg/mL,分别取100 μl于离心管中,加入5%的苯酚溶液100 μl,混匀,然后再加入0.5 mL浓硫酸,混匀,室温避光放置20 min后,在490 nm处测其吸光度。以加入葡萄糖浓度为横坐标,490 nm下吸光度为纵坐标绘制葡萄糖标准曲线。
2.3.2. 超声提取的单因素试验
1) 提取时间的确定:向各个蒸馏瓶中加2 g样品粉末80 mL蒸馏水(料液比1:40),混合均匀,放于60˚C超声清洗仪中,立即超声提取,分别提取5 min、10 min、20 min、30 min、40 min、60 min后,4˚C,8000 rpm/min离心5 min,将上清液收集起来,加入4倍体积的95%乙醇,摇匀,放入4˚C冰箱,沉淀过夜(12~24 h),然后于4˚C,10000 rpm/min离心机离心5 min,倒掉上清液,置于烘箱中,调节温度(50˚C~60˚C),烘干,加1 mL蒸馏水,测其多糖得率。
2) 提取温度的确定:向各个蒸馏瓶中加2 g样品粉末和80 ml蒸馏水(料液比1:40),混合均匀,分别置于40˚C、50˚C、60˚C、70˚C的超声清洗仪中,立即超声提取20 min后,4˚C,8000 rpm/min离心5 min,将上清液收集起来,加入4倍体积的95%乙醇,摇匀,放入4˚C冰箱,沉淀过夜(12~24 h),然后于4˚C,10,000 rpm/min离心机离心5 min,倒掉上清液,置于烘箱中,调节温度(50˚C~60˚C),烘干,加1 mL蒸馏水,测其多糖得率。
3) 料液比的确定:分别向各组锥形瓶中加入一定量的蒸馏水,使其料液比分别为1:20、1:30、1:40、1:50、1:60,放入超声清洗仪,在温度为60˚C超声强度为40 kHz条件下立即超声20 min后,4˚C,8000 rpm/min离心5 min,将上清液收集起来,加入4倍体积95%乙醇,摇匀,放入4˚C冰箱,沉淀过夜(12~24 h),然后于4˚C,10,000 rpm/min离心机离心5 min,倒掉上清液,置于烘箱中,调节温度(50˚C~60˚C),烘干,加1 mL蒸馏水,测其多糖得率。
2.3.3. 银耳多糖抗氧化的实验
(一) 配制ABTS母液
试剂一:准确称取0.0384 g ABTS,定容至10 mL;
试剂二:准确称取0.0134 g过硫酸钾,定容至10 mL;
试剂一与试剂二等比例混合,避光16 h。
(二) 抗氧化的测定
使用PBS稀释母液至734 nm吸光度值为0.7左右,作为工作液,将制得的多糖储备液取200 μl,加800 μl的蒸馏水,配制成银耳多糖原液,分别稀释1/2、1/4、1/8、1/16、1/32、1/64、1/128、1/256、0倍,取20 μl各样品加入工作液,用PBS缓冲液调零,在734 nm处测其吸光度,并且测量出各个浓度的多糖溶液的吸光度,观察银耳多糖的抗氧化性。
3. 结果与分析
3.1. 葡萄糖的标准曲线
图1以葡萄糖溶液为标准品,绘制的标准曲线,回归方程为y = 0.8271x + 0.0421,R2 = 0.9913。根据样品测定的吸光度值对照标准曲线回归方程计算银耳多糖浓度,算出多糖提取率。
3.2. 超声波提取的单因素试验结果
3.2.1. 提取时间
由图2可知,通过观察不同时间银耳多糖提取率,呈现了先增大后减小的趋势,当提取时间为40 min时,有最大的银耳多糖得率4.6%,由此可知银耳多糖的多糖得率并不是随着时间的增加而一直增加,当到40 min时达到最大值后,多糖得率开始下降,所以并不是提取时间越长,提取的多糖越多,由图可知超声提取最佳的提取时间在30~50 min之间。
3.2.2. 提取温度
由图3可知,银耳多糖的多糖得率随着温度的增加而增加,当到60˚C时多糖得率达到最大值4.0%,再随温度升高银耳多糖的得率开始小幅度的下降,所以当温度达到60˚C时,超声波破坏样品细胞最好,使用超声提取70˚C以上的温度不好控制,因此,银耳多糖超声提取的最佳温度控制在60˚C~70˚C之间。
3.2.3. 料液比
由图4可知,银耳多糖的得率随着料液比的增大呈现先增大后减少的趋势,当料液比为1:40时达到最大的多糖得率3.8%,之后料液比继续增大,多糖得率呈下降趋势。当料液比为1:40时,银耳中多糖的提取已经基本完全,再增大水量只会增加多糖的损失,减少多糖的得率,因此,超声提取银耳多糖的最佳料液比是1:40。
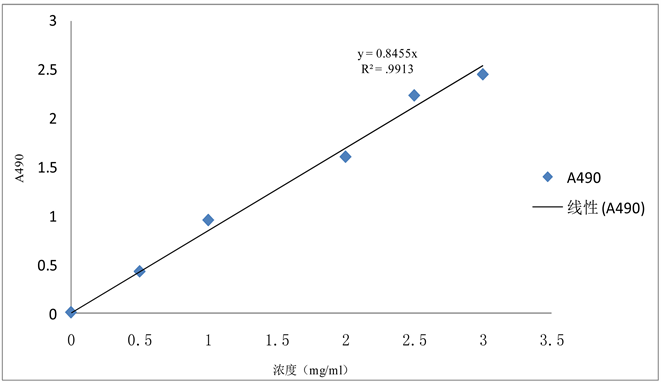
Figure 1. The standard curve of the determination of glucose content
图1. 葡萄糖标准曲线
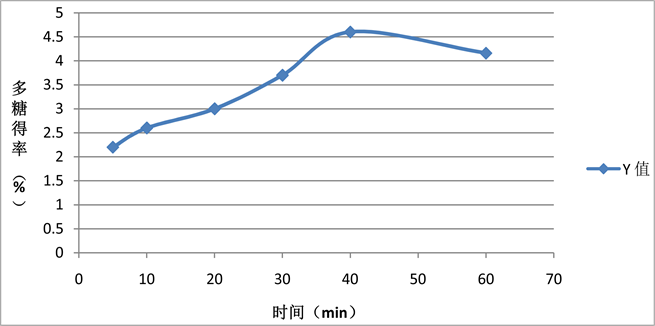
Figure 2. Effects of extraction time on Tremella fuciformis productivity
图2. 提取时间对多糖得率的影响
3.3. 银耳多糖的抗氧性
由图5可知,银耳多糖具有抗氧化性,随着稀释倍数的减小银耳多糖抗氧化能力增强。银耳多糖原液浓度为44.4 mg/mL,原液是具有最佳抗氧化性的。
4. 讨论与结论
4.1. 讨论
具有高生物活性的银耳多糖,在医药和保健品领域中得到越来越多的重视,其中,提取技术是大规模应用银耳多糖的关键。银耳多糖主要是酸性和中性多糖,用热水提取,可以得到大部分的多糖成分,

Figure 3. Effects of extraction temperature on Tremella fuciformis productivity
图3. 提取温度对多糖得率的影响
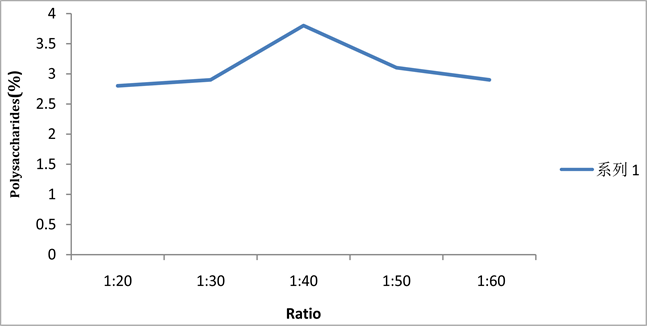
Figure 4. Effects of solid liquid ratio on Tremella fuciformis productivity
图4. 料液比对多糖得率的影响
超声处理可以在同一时间使细胞空泡化,增加细胞膜和细胞壁的通透性,从而多糖溶出,提高多糖率。
一般认为,水提取法温和、提取率较低,本实验采用了单因素分析法优化银耳多糖的提取条件,并辅以超声波处理,提取效果好。优化方法后,提取率相对较高,但相比于与碱提取法和酶水解法,还存在一定的差距,要根据多糖的保留和成本预算情况的实际应用需要,择优选择。
4.2. 结论
通过单因素试验,研究了银耳多糖提取时间、提取温度和料液比对提取效果的影响,在此基础上,确定了超声提取方法优化的提取条件:提取时间40 min,提取温度65˚C,料液比1:40,在此条件下得到的银耳多糖的多糖得率为5.1%。通过用过硫酸钾作为氧化剂、ABTS作显色剂,得到银耳多糖具有抗氧化性。
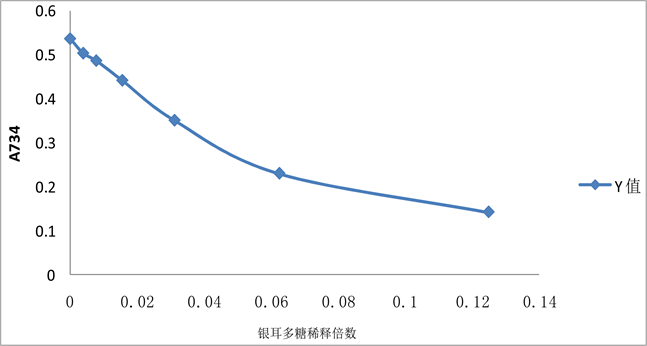
Figure 5. The influence of tremella polysaccharide concentrations against oxidation
图5. 银耳多糖浓度对抗氧化的影响
致谢
感谢国家星火科技计划(2014GA740050)对本研究的支持。
基金项目
国家星火科技计划(2014GA740050)。